generikus név: Terbutaline sulfate
adagolási forma: injekció, oldat
orvosilag felül Drugs.com. Utoljára frissítve: 2020. szeptember 1.
- Áttekintés
- Mellékhatások
- Adagolás
- Szakmai
- Kölcsönhatások
- Több
Egy steril vizes oldat a bőr alatti injekció
Rx Csak
FIGYELMEZTETÉS: HOSSZAN tartó, TOVÁBBÁ
Szintén szulfát nem engedélyezték, így az nem használható hosszabb továbbá (túl 48-72 órán belül). Különösen a terbutalin-szulfátot nem szabad a tocolysis fenntartására használni járóbeteg-vagy otthoni környezetben. A terbutalin-szulfát terhes nőknek történő alkalmazása után súlyos mellékhatásokat, köztük halált jelentettek. Az anya, ezek a mellékhatások közé tartozik a megnövekedett pulzusszám, átmeneti hiperglikémia, hypokalemia, szívritmuszavarok, tüdőödéma, miokardiális ischaemia. Megnövekedett magzati szívfrekvencia és újszülöttkori hypoglykaemia fordulhat elő az anyai beadás következtében (lásd ellenjavallatok: elhúzódó Tokolízis).
- terbutalin leírás
- terbutalin-Klinikai farmakológia
- preklinikai
- Farmakokinetika
- terbutalin
- figyelmeztetések
- az asztma romlása
- gyulladáscsökkentő szerek alkalmazása
- cardiovascularis hatások
- görcsrohamok
- Óvintézkedések
- Általános
- Gyógyszerkölcsönhatások
- Carcinogenesis, Mutagenitási a Fertilitás károsodását
- terhesség-teratogén hatások
- Használja A szülőszobára
- szoptató anyák
- gyermekgyógyászati alkalmazás
- geriátriai alkalmazás
- mellékhatások
- túladagolás
- terbutalin Adagolás és alkalmazás
- hogyan kerül forgalomba a Terbutaline
- fő kijelző PANEL
- fő kijelzőpanel
- SERIALIZATION IMAGE
- További információ a terbutalinról
- a Fogyasztói források
- Szakmai források
- Kapcsolódó kezelési útmutatók
terbutalin leírás
terbutalin-szulfát, USP, a terbutalin-szulfát injekció hatóanyaga, az USP, egy béta-adrenerg agonista hörgőtágító, amely steril, nem pirogén, vizes oldatban kapható injekciós üvegekben, szubkután beadásra. Az oldat milliliterenként 1 mg terbutalin-szulfátot, USP-t (0,82 mg szabad bázist), nátrium-kloridot izotonicitásra, 0,055% edetát-dinátrium-dihidrátot stabilizáló szerként, sósavat tartalmaz a 4-es cél pH-értékhez való beállításhoz. A terbutalin-szulfát (±)-a–3,5-dihidroxibenzyi-alkohol-szulfát (2:1) (só). A molekuláris képlet (c12h19n03) 2•H2SO4 és a szerkezeti képlet:
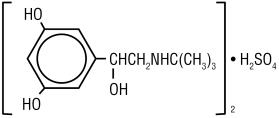
terbutalin-szulfát, USP egy fehér-szürke-fehér kristályos por. Szagtalan vagy halvány ecetsav szaga van. Vízben és 0,1 N sósavban oldódik, metanolban enyhén oldódik,kloroformban nem oldódik. Molekulatömege 548,65.
terbutalin-Klinikai farmakológia
a terbutalin-szulfát injekció béta-adrenerg receptor agonista. In vitro és in vivo farmakológiai vizsgálatok kimutatták, hogy a terbutalin preferenciális hatást fejt ki a béta2‑adrenerg receptorokra. Bár felismerték, hogy a béta2-adrenerg receptorok a bronchiális simaizom domináns receptorai, az adatok azt mutatják, hogy az emberi szívben a béta2-receptorok populációja van, 10-50% – os koncentrációban. Ezeknek a receptoroknak a pontos működését nem állapították meg (lásd a figyelmeztetéseket). Subcutan Terbutalint kapó betegeknél végzett kontrollos klinikai vizsgálatok nem mutattak ki preferenciális béta2-adrenerg hatást.
a béta-adrenerg agonisták, köztük a terbutalin farmakológiai hatásai legalább részben az intracelluláris adenil-cikláz béta-adrenerg receptorain keresztül történő stimulációnak tulajdoníthatók, amely enzim katalizálja az adenozin-trifoszfát (ATP) ciklikus 3′,5′ – adenozin-monofoszfát (cAMP) átalakulását. A megnövekedett táborszint a bronchiális simaizom relaxációjával, valamint a sejtekből, különösen a hízósejtekből származó azonnali túlérzékenységi mediátorok felszabadulásának gátlásával jár.
kontrollos klinikai vizsgálatok kimutatták, hogy a terbutalin-szulfát injekció enyhíti a hörgőgörcsöt akut és krónikus obstruktív tüdőbetegségben a pulmonalis áramlási sebesség jelentős növelésével (pl. a FEV1-ben legalább 15% – os növekedés). 0,25 mg terbutalin-szulfát injekció szubkután beadása után általában 5 percen belül mérhető változás következik be a kilégzési áramlási sebességben, és a FEV1 klinikailag jelentős növekedése 15 percen belül következik be. A maximális hatás általában 30-60 percen belül jelentkezik, és a klinikailag jelentős hörgőtágító hatás 1,5-4 órán keresztül folytatódhat. A klinikailag jelentős javulás időtartama hasonló az equimilligram epinefrin adagok esetén megfigyelthez.
preklinikai
laboratóriumi állatokon (minipigs, rágcsálók és kutyák) végzett vizsgálatok kimutatták a szívritmuszavarok és a hirtelen halál előfordulását (szövettani bizonyítékkal a myocardialis nekrózisra) béta-agonisták és metilxantinok egyidejű alkalmazása esetén. Ezen eredmények klinikai jelentősége nem ismert.
Farmakokinetika
Subcutan 0,5 mg Szintén szulfát 17 egészséges, felnőtt, férfi alanyok eredményezett átlag (SD) plazmában Ennek koncentrációja 9.6 (3.6) ng/mL, ami megfigyelhető volt, a medián (tartomány) alkalommal 0,5 (0,08-1.0) órával a beadás után. Az átlag (SD) AUC (0 48), valamint a teljes test clearance érték 29.4 (14.2) hr•ng/mL-311 (112) mL/perc volt. A terminális felezési idő meghatározása 9. 17 egyénben, egy átlag (SD) 5.7 (2.0) óra.
0, 25 mg terbutalin-szulfát subcutan adását követően két férfi betegnél a terbutalin szérum csúcskoncentrációját 5, 2 és 5, 3 ng/mL-ben figyelték meg az adagolás után körülbelül 20 perccel.
a gyógyszer eliminációs felezési ideje 14 betegből 10-nél körülbelül 2, 9 óra volt a subcutan beadást követően, de hosszabb eliminációs felezési időt (6-14 óra) találtak a másik 4 betegnél. A gyógyszer körülbelül 90% – a a szubkután beadás után 96 órával ürült ki a vizelettel, ennek körülbelül 60% – a változatlan gyógyszer. Úgy tűnik, hogy a szulfát konjugátum a terbutalin fő metabolitja, és a vizeletürítés az elimináció elsődleges útja.
terbutalin
Terbutaline Sulfate Injection, USP javallott a bronchospasmus megelőzésére és visszafordítására 12 éves vagy idősebb, asztmában és reverzibilis bronchospasmusban szenvedő, bronchitishez és emfizémához társuló betegeknél.
1. Az elhúzódó Tocolysis
terbutalin-szulfátot nem engedélyezték, és nem alkalmazható hosszan tartó tocolysis esetén (48-72 órán túl). Különösen a terbutalin-szulfátot nem szabad használni a tocolysis fenntartására járóbeteg-vagy otthoni környezetben (lásd dobozos figyelmeztetés: elhúzódó Tokolízis).
2. Túlérzékenység
a terbutalin-szulfát injekció ellenjavallt olyan betegeknél, akikről ismert, hogy túlérzékenyek a szimpatomimetikus aminokra vagy a gyógyszer bármely összetevőjére.
figyelmeztetések
az asztma romlása
az asztma néhány óra vagy több nap vagy annál hosszabb idő alatt akut módon romolhat. Ha a betegnek a szokásosnál több terbutalin-szulfát adagra van szüksége, ez az asztma destabilizációjának markere lehet, és a beteg és a kezelési rend újraértékelését igényli, különös tekintettel a gyulladáscsökkentő kezelés lehetséges szükségességére, például kortikoszteroidokra.
gyulladáscsökkentő szerek alkalmazása
a béta-adrenerg agonista hörgőtágítók alkalmazása önmagában nem biztos, hogy alkalmas az asztma kezelésére sok betegnél. Korai megfontolandó a gyulladáscsökkentő szerek, például kortikoszteroidok hozzáadása.
cardiovascularis hatások
a terbutalin-szulfát, mint minden más béta-adrenerg agonista, klinikailag jelentős kardiovaszkuláris hatást fejthet ki egyes betegeknél, pulzusszám, vérnyomás és/vagy tünetek alapján mérve. Bár az ilyen hatások nem gyakoriak a terbutalin-szulfát ajánlott dózisokban történő beadása után, ha előfordulnak, a gyógyszert fel kell függeszteni. Ezenkívül a béta-agonistákról beszámoltak arról, hogy elektrokardiogram (EKG) változásokat idéznek elő, mint például a T-hullám ellaposodása, a QTc-intervallum megnyúlása és az ST-szegmens depressziója. Ezen eredmények klinikai jelentősége nem ismert. Ezért a terbutalin-szulfátot, mint minden szimpatomimetikus amint, óvatosan kell alkalmazni kardiovaszkuláris rendellenességekben, különösen koszorúér-elégtelenségben, szívritmuszavarokban és magas vérnyomásban szenvedő betegeknél.
görcsrohamok
ritkán számoltak be görcsrohamokról Terbutalint kapó betegeknél; a görcsrohamok nem ismétlődtek meg ezeknél a betegeknél a gyógyszer abbahagyása után.
Óvintézkedések
Általános
Ennek, mint minden szimpatomimetikus aminok, óvatosan kell alkalmazni olyan betegeknél, a keringési rendellenességek, beleértve ischaemiás szívbetegség, magas vérnyomás, valamint a szívritmuszavar; a betegek hyperthyreosis vagy cukorbetegség; valamint olyan betegeknél, akik szokatlanul reagál szimpatomimetikus aminok, vagy akik görcsös betegségek. A szisztolés és a diasztolés vérnyomás jelentős változásait észlelték, és néhány betegnél várható, hogy bármely béta-adrenerg hörgőtágító alkalmazása után jelentkeznek.
a terbutalin alkalmazását követően azonnali túlérzékenységi reakciókat és a bronchospasmus exacerbációját jelentették.
A béta-adrenerg agonista gyógyszerek egyes betegeknél jelentős hypokalaemiát okozhatnak, esetleg intracelluláris tolatással, amely káros kardiovaszkuláris hatásokat okozhat. A csökkenés általában átmeneti, nem igényel kiegészítést.
nagy dózisú intravénás Terbutalinról számoltak be, ami súlyosbította a már fennálló diabetes mellitust és ketoacidózist.
Gyógyszerkölcsönhatások
a terbutalin-szulfát injekció más szimpatomimetikus szerekkel történő egyidejű alkalmazása nem ajánlott, mivel a kardiovaszkuláris rendszerre gyakorolt kombinált hatás káros lehet a beteg számára.
monoamin-oxidáz gátlók vagy triciklikus antidepresszánsok: a Terbutalint rendkívül óvatosan kell alkalmazni monoamin-oxidáz gátlókkal vagy triciklikus antidepresszánsokkal kezelt betegeknél, vagy az ilyen szerek abbahagyását követő 2 héten belül, mivel a terbutalin érrendszerre gyakorolt hatása fokozódhat.
béta-blokkolók: A béta-adrenerg receptor blokkoló szerek nemcsak blokkolják a béta-agonisták pulmonalis hatását, mint például a terbutalin-szulfát injekció, de asztmás betegeknél súlyos bronchospazmust okozhatnak. Ezért az asztmás betegeket általában nem szabad béta-blokkolókkal kezelni. Bizonyos körülmények között, például myocardialis infarctus utáni profilaxisként azonban nem lehetnek elfogadható alternatívák a béta-adrenerg blokkoló szerek asztmás betegeknél történő alkalmazására. Ebben a beállításban megfontolandó a cardioselective béta-blokkolók, bár óvatosan kell alkalmazni őket.
diuretikumok: a nem kálium-megtakarító diuretikumok (például hurok vagy tiazid diuretikumok) alkalmazásából eredő EKG-változásokat és/vagy hypokalaemiát a béta-agonisták fokozhatják, különösen akkor, ha a béta-agonista ajánlott dózisát túllépik. Bár ezeknek a hatásoknak a klinikai jelentősége nem ismert, óvatosság szükséges a béta-agonisták és a nem káliummegtakarító diuretikumok együttes alkalmazásakor.
Carcinogenesis, Mutagenitási a Fertilitás károsodását
A 2 éves vizsgálat során a Sprague-Dawley patkányok, Szintén szulfát okozott jelentős, dózisfüggő előfordulásának növekedését jóindulatú leiomyomas a mesovarium a diétás adag 50 mg/kg felett (kb 810 alkalommal a maximális ajánlott napi szubkután (sc) adag felnőttek számára mg/m2 alapján). Egy 21 hónapos, CD-1 egereken végzett vizsgálatban a terbutalin-szulfát nem mutatott tumorigenitást 200 mg/kg-ig terjedő étrendi dózisoknál(körülbelül 1600-szorosa a felnőttek maximális ajánlott napi sc-dózisának mg/m2 alapon). A terbutalin-szulfát mutagenitási potenciálját nem határozták meg.
a terbutalin-szulfátot alkalmazó patkányokon végzett reprodukciós vizsgálatok nem igazolták a fertilitás károsodását 50 mg/kg-ig terjedő orális dózisoknál(körülbelül 810-szerese a felnőttek maximális ajánlott napi sc-dózisának mg / m2 alapon).
terhesség-teratogén hatások
terhesség C Kategória
terhes nőknél nem végeztek megfelelő és jól kontrollált terbutalin-szulfát-vizsgálatot. A közzétett állatkísérletek azt mutatják, hogy a patkány utódok viselkedése és agyfejlődése megváltozott, beleértve a sejtek proliferációjának csökkenését és differenciálódását, amikor a gátakat a terhesség és a laktáció késői szakaszában subcutan kezelték Terbutalinnal. Patkánykamrákban a terbutalin-expozíció a napi 2-4 mg-os felnőttek napi adagjának körülbelül 24-48-szorosa volt, mg / m2 alapon.
a terbutalin-szulfátot nem engedélyezték, és nem alkalmazható hosszan tartó tokolízisre (48-72 órán túl). Különösen a terbutalin-szulfátot nem szabad a tocolysis fenntartására használni járóbeteg-vagy otthoni környezetben. A terbutalin-szulfát terhes nőknek történő alkalmazása után súlyos mellékhatásokat, köztük halált jelentettek. Az anya, ezek a mellékhatások közé tartozik a megnövekedett pulzusszám, átmeneti hiperglikémia, hypokalemia, szívritmuszavarok, tüdőödéma, miokardiális ischaemia. Fokozott magzati szívfrekvencia és újszülöttkori hypoglykaemia fordulhat elő az anyai beadás következtében (lásd dobozos figyelmeztetés: elhúzódó Tokolízis és ellenjavallatok: elhúzódó Tokolízis).
állatokon végzett embriofetális fejlődési vizsgálatokban nem figyeltek meg teratogén hatást utódoknál, amikor vemhes patkányok és nyulak 50 mg/kg/nap orális dózisig terbutalin-szulfátot kaptak, körülbelül 810-szer, illetve 1600-szor, a felnőttek számára javasolt maximális napi subcutan dózis mg/m2 alapon.
a terbutalin-szulfátot terhesség alatt csak akkor szabad alkalmazni, ha a lehetséges előnyök igazolják a magzatra gyakorolt potenciális kockázatot.
Használja A szülőszobára
Mivel a lehetséges béta-agonista interferencia méh összehúzódási képességét, használata Szintén szulfát injekció megkönnyebbülés, bronchospasmus a vajúdás során korlátozni kell, hogy azok a betegek, akiknél az előnyök egyértelműen meghaladják a kockázatokat.
a terbutalin átjut a placentán. Miután egyetlen adag IV beadása Szintén 22 nők a késői terhesség, akik által szállított elektív Császármetszés miatt klinikai oka, köldökzsinór vér Szintén megállapították, hogy a tartomány a 11% – ról 48% – a az anyai vérben.
szoptató anyák
nem ismert, hogy ez a gyógyszer kiválasztódik-e az anyatejbe. Ezért a terbutalin-szulfát injekciót csak akkor szabad alkalmazni az ápolás során, ha a potenciális előny igazolja az újszülött esetleges kockázatát.
gyermekgyógyászati alkalmazás
a terbutalin-szulfát injekció nem ajánlott 12 év alatti betegek számára, mivel a biztonságosság és a hatékonyság megállapításához nem áll rendelkezésre elegendő klinikai adat.
geriátriai alkalmazás
a terbutalin-szulfát injekcióval végzett klinikai vizsgálatok nem tartalmaztak elegendő számú 65 éves vagy annál idősebb alanyt annak megállapításához, hogy a fiatalabb alanyoktól eltérően reagálnak-e. Egyéb jelentett klinikai tapasztalatok nem mutattak ki különbségeket az idős és a fiatalabb betegek válaszaiban. Általában az idős betegek dózisának megválasztásakor óvatosnak kell lenni, általában az adagolási tartomány alsó végétől kezdve, ami a csökkent máj -, vese-vagy szívműködés, valamint az egyidejű betegség vagy más gyógyszeres kezelés nagyobb gyakoriságát tükrözi.
mellékhatások
a terbutalin-szulfát injekcióval megfigyelt mellékhatások hasonlóak a más szimpatomimetikumokkal gyakran észlelt mellékhatásokhoz. Mindezek a reakciók átmeneti jellegűek, és általában nem igényelnek kezelést.
Az alábbi táblázat összehasonlítja a mellékhatások láttam-val kezelt betegeknél Szintén szulfát injekció (0,25 mg, 0,5 mg), azokkal láttam a kezelt betegek adrenalin injekció (0,25 mg, 0,5 mg) során nyolc kettős-vak, keresztezett vizsgálatban, összesen 214 betegek.
| Incidence (%) of Adverse Reactions | |||||
| Terbutaline (%) | Epinephrine (%) | ||||
|
0.25 mg |
0.5 mg N = 205 |
0.25 mg N = 153 |
0.5 mg N = 61 |
||
| Reaction Central Nervous System |
|||||
| Tremor | 7.8 | 38.0 | 16.3 | 18.0 | |
| Nervousness | 16.9 | 30.7 | 8.5 | 31.1 | |
| Dizziness | 1.3 | 10.2 | 7.8 | 3.3 | |
| Headache | 7.8 | 8.8 | 3.3 | 9.8 | |
| Drowsiness | 11.7 | 9.8 | 14.4 | 8.2 | |
| Cardiovascular | |||||
| Palpitations | 7.8 | 22.9 | 7.8 | 29.5 | |
| Tachycardia | 1.3 | 1.5 | 2.6 | 0.0 | |
| Respiratory | |||||
| Dyspnea | 0.0 | 2.0 | 2.0 | 0.0 | |
| Chest discomfort | 1.3 | 1.5 | 2.6 | 0.0 | |
| Gastrointestinal | |||||
| Nausea/vomiting | 1.3 | 3.9 | 1.3 | 11.5 | |
| Systemic | |||||
| Weakness | 1.3 | 0.5 | 2.6 | 1.6 | |
| Flushed feeling | 0.0 | 2.4 | 1.3 | 0.0 | |
| Sweating | 0.0 | 2.4 | 0.0 | 0.0 | |
| Pain at injection site | 2.6 | 0.5 | 2.6 | ||
Megjegyzés: Néhány beteg több mint egy adag terbutalin-szulfátot és epinefrint kapott. Emellett szorongásról, izomgörcsről és szájszárazságról is beszámoltak (< 0, 5%). Ritkán beszámoltak a májenzimek emelkedéséről és a terbutalin alkalmazásával járó túlérzékenységi vasculitisről.
a feltételezett mellékhatások bejelentéséhez vegye fel a kapcsolatot a Hikma Pharmaceuticals USA Inc.. a 1-877-233-2001, vagy az FDA 1-800-FDA-1088 vagy www.fda.gov/medwatch.
túladagolás
a terbutalin-szulfát medián letális dózisa Érett patkányokban körülbelül 165 mg/kg volt(körülbelül 2700-szorosa a felnőttek számára ajánlott maximális napi sc dózisnak mg / m2 alapon). A terbutalin-szulfát medián SC letális dózisa fiatal patkányokban körülbelül 2000 mg/kg volt(körülbelül 32 000-szerese a felnőttek maximális ajánlott napi sc dózisának mg/m2 alapon).
A várható tünetek a túladagolás azok a túlzott béta-adrenerg stimuláció és/vagy esemény, vagy túlzás a tünetek alatt felsorolt MELLÉKHATÁSOK, pl., görcsök, szédülés, magas vérnyomás vagy alacsony vérnyomás, gyors szívverés az árak 200 ütés / perc, ritmuszavarok, idegesség, fejfájás, remegés, szájszárazság, palpitáció, hányinger, szédülés, fáradtság, rossz közérzet, álmatlanság. Hypokalaemia is előfordulhat. Nincs specifikus antidotum. A kezelés a terbutalin-szulfát injekció abbahagyását és a megfelelő tüneti kezelést foglalja magában. Megfontolható a Kardioszelektív béta-receptor blokkoló ésszerű alkalmazása, szem előtt tartva, hogy az ilyen gyógyszerek hörgőgörcsöt okozhatnak. Nincs elegendő bizonyíték annak meghatározására, hogy a dialízis előnyös-e a terbutalin-szulfát injekció túladagolásához.
terbutalin Adagolás és alkalmazás
az injekciós üvegeket csak subcutan és nem intravénás infúzióban szabad alkalmazni.
sterilitás és pontos adagolás nem biztosítható, ha az injekciós üvegeket nem az adagolás és az alkalmazás szerint használják.
egyszeri alkalmazás után dobja ki a fel nem használt adagot.
a terbutalin-szulfát injekció szokásos szubkután adagja 0, 25 mg az oldalsó deltoid területre. Ha 15-30 percen belül nem jelentkezik jelentős klinikai javulás,akkor egy második, 0,25 mg-os adag adható. Ha a beteg további 15-30 percen belül nem reagál, más terápiás intézkedéseket kell figyelembe venni. A teljes adag 4 órán belül nem haladhatja meg a 0,5 mg-ot.
Megjegyzés: A parenterális gyógyszerkészítményeket a beadás előtt szemrevételezéssel ellenőrizni kell, hogy nem tartalmaznak-e részecskéket és elszíneződést, amennyiben az oldat és a tartály megengedi.
hogyan kerül forgalomba a Terbutaline
Terbutaline Sulfate Injection, USP, 1 mg / mL, egy 2 mL-es borostyánsárga üvegben lévő 1 mL térfogatban kerül forgalomba. Minden injekciós üveg 1 mg terbutalin-szulfátot tartalmaz 1 mL oldatban; 0,25 mL oldat biztosítja a szokásos 0,25 mg-os klinikai dózist.
NDC 0143-9375-10 doboz 10 injekciós üveg.
20-25° C-on (68-77°F) tárolandó .
védje a fénytől azáltal, hogy az injekciós üvegeket eredeti csomagolásban tárolja, amíg ki nem adják.
ne használja, ha az oldat elszíneződött.
egyszeri alkalmazás után dobja ki a fel nem használt adagot.
:
HIKMA FARMACÊUTICA (Portugália), S. A..
Estrada do Rio da Mó, nº 8, 8A e 8b-Fervença,
2705 – 906 Terrugem SNT,
PORTUGAL
terjesztette:
Hikma Pharmaceuticals USA Inc.
Eatontown, NJ 07724 USA
A Novaplus a Vizient, Inc. bejegyzett védjegye.
felülvizsgált: 2020.október
PIN552-NOV/2
fő kijelző PANEL
NDC 0143-9375-01 RX csak
terbutalin
szulfát
injekció, USP
1 mg/mL
szubkután
csak

fő kijelzőpanel
NDC 0143-9375-10 RX csak
terbutalin
szulfát
injekció, USP
1 mg/ml
subcutan
csak
10 x 1 ml egyszeri adagú injekciós üveg
steril, nempirogén, vizes
subcutan injekcióhoz való oldat.
ne alkalmazza, ha az oldat elszíneződött.
Megjegyzés: a szokásos egyszeri adag az injekciós üveg tartalmának egynegyede. SEE PRESCRIBING
INFORMATION.
SERIALIZATION IMAGE
| Terbutaline SULFATE Terbutaline sulfate injection |
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
Labeler – Hikma Pharmaceuticals USA Inc. (001230762)
regisztráló – HIKMA FARMACEUTICA (Portugália), S. A. (452742943)
További információ a terbutalinról
- mellékhatások
- terhesség vagy szoptatás alatt
- adagolási információk
- Gyógyszerképek
- Gyógyszerkölcsönhatások
- alternatívák összehasonlítása
- árképzés& kuponok
- 11 vélemény
- gyógyszerosztály: adrenerg hörgtágítók
- FDA Figyelmeztet (1)
a Fogyasztói források
- Beteg adatait
- Terbutalin (Speciális Olvasás)
- Ne Subcutan (Speciális Olvasás)
Szakmai források
- Felírása Információk
- Terbutalin (Szakmai Beteg Tanácsadás)
- Szintén Tabletta (FDA)
Kapcsolódó kezelési útmutatók
- Koraszülés
- Allergiás Asztma
- Asztma, Karbantartási
- Asztma, akut
Orvosi Nyilatkozat