
egy anyag moláris térfogata (VM szimbólum) az anyag egy adott mólja által elfoglalt térfogat hőmérséklet és nyomás. Ez egyenlő az anyag molekulatömegével (m), amelyet a sűrűsége (ρ) oszt meg az adott hőmérsékleten és nyomáson:
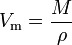
egy SI egység köbméter/mól (m3 / mol). A moláris térfogatot azonban gyakran 1000 mól (m3/kmol) vagy mól (dm3/mol) köbméterben fejezik ki gázokra, folyadékokra és szilárd anyagokra pedig centiméterben (cm3/mol).
Ha egy anyag n komponenseket tartalmazó keverék, a moláris térfogatot a következőképpen kell kiszámítani:
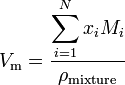
ahol x i az I.komponens molfrakciója, m i. az I. komponens molekulatömege és a pmixture a keverék sűrűsége az adott hőmérsékleten és nyomáson.
a moláris térfogat számértékeinek megadásakor fontos a hőmérséklet és a nyomás adott feltételeit is megadni. Ellenkező esetben a numerikus értékek értelmetlenek.
Ideális gázok
Az ideális gáz törvény egyenlet alakítható, hogy ezt a kifejezést a moláris térfogata ideális gáz:
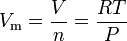
Amennyiben az SI egységek:
a= a gáz abszolút nyomás, Pa
száma= mol, a mol
a= a gáz moláris térfogata, m3/mol
a= a gáz abszolút hőmérséklet, K
a= az univerzális gáz törvény állandó 8.314472 m3·Pa·mol-1·K-1
, Ahol az USA-ban szokásos egységek:
= a gáz abszolút nyomása, a psia
= molok száma, lb-mol
= a gáz moláris térfogata, ft3/lb-mol
= a gáz abszolút hőmérséklete, fok Rankine (°R)
br>
= az 10.7316 Ft3·psia·lb-mol-l·°r-1
Az ideális gáz moláris térfogatának példa-számításai:
- si metrikus egységekben:
VM = 8.314472 × 273.15/101,325 = 0.022414 m3/mol 0 °C és 101,325 pa abszolút nyomás = 22,414 m3 / kmol 0 °C-on (273,15 k) és 101.325 kPa abszolút nyomás Vm = 8,314472 × 273,15 / 100,000 = 0,022711 m3/kmol 0 °C-on és 100,000 Pa abszolút nyomás = 22,711 m3/kmol 0 °C-on (273,15 K) és 100 kPa abszolút nyomás
- a szokásos amerikai egységekben:
VM = 10,7316 × 519.67/14.696 = 379.48 Ft3/lb-mol 60 °f-on (519.67 °r) és 14.696 PSIA
megjegyzések:
- lb-MOL rövidítése Pound-mol
- °R Rankine (abszolút hőmérsékleti skála) és °F fok Fahrenheit (hőmérsékleti skála).
- ° R = °F + 459.67
- a szakirodalom zavaró lehet, mivel egyes szerzők gyakran nem magyarázzák meg, hogy az R univerzális gáztörvényt használják-e, amely minden ideális gázra vonatkozik,vagy az RS specifikus gáztörvényt használják-e, amely csak egy adott egyedi gázra vonatkozik. A két konstans közötti kapcsolat Rs = R / M, ahol M a gáz molekulatömege.
valódi gázok
a valódi gázok azok a gázok, amelyek nem mutatnak ideális gáz viselkedést. Az ilyen gázok, a legegyszerűbb módszer a meghatározó moláris mennyiségek segítségével kompresszibilitási tényező, mint a következő kifejezést:
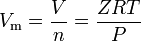
ahol Z a gáz kompresszibilitási tényező, ami hasznos termodinamikai tulajdonság módosító ideális gáz törvény figyelembe viselkedés valódi gázok. A fenti egyenlet alapvetően az állapot egyszerű egyenlete (EOS). Ennek az állapotegyenletnek a fő korlátja, hogy a gáz összenyomhatósági tényezője, A Z, nem állandó, hanem gázról gázra változik, valamint a vizsgált gáz hőmérséklete és nyomása.
a valódi gázmoláris térfogat pontosabb értékei az 1873-ban kidolgozott van der Waals-egyenlethez, az 1949-ben kidolgozott Redlich-Kwong egyenlethez, az 1972-ben kidolgozott Soave-Redlich-Kwong egyenlethez, valamint az 1976-ban kidolgozott Peng-Robinson-egyenlethez hasonló állapotegyenletekkel nyerhetők.
- 1, 0 1.1 International Union of Pure and Applied chemistry (IUPAC): Mennyiségek, Egységek, valamint Szimbólumok Fizikai Kémia 2. Kiadás, 1993
- 2.0 2.1 NIST Útmutató SI Elem 8.6.3 a 8. Szakasz
- 3.0 3.1 Meghatározása gáz kompresszibilitási értékek Információt a hogyan állapítható meg, hogy a gáz kompresszibilitási tényező, a moláris mennyiségek.
| |
előfordulhat, hogy ezen az oldalon néhány tartalom megjelent a Citizendium oldalon. |