- Bevezetés
- Anyagok, Módszerek
- Törzsek
- DNS extrakció
- stx1 és stx2 PCR Amplifikációk
- DNS szekvenálás
- microplate módszeren Vero Sejt Készítmények
- sejtmentes bakteriális készítmények
- citotoxikus vizsgálat és LD50 meghatározás
- Blokád, valamint Méreg Semlegesítő Assay
- OMV-K beszerzését és az OMV-kből származó DNS-extrakciót
- Results
- stx1 és stx2 Gene PCR Amplifications
- DNS szekvenálás
- Citotoxikus Vizsgálat, valamint LD50 Meghatározása
- Toxin semlegesítés
- stx1 Gene PCR Amplifications from OMVs
- Vita
- Szerző Hozzájárulások
- összeférhetetlenségi nyilatkozat
- rövidítések
Bevezetés
több éven át az Aeromonas spp.jelentősége., mivel az emberi hasmenést okozó szer ellentmondásos volt; számos tanulmány kimutatta, hogy az Aeromonas patogén mechanizmusa multifaktoriális, mivel számos virulencia tényező vesz részt, beleértve a citotoxinok termelését (Castro-Escarpulli et al., 2002, 2003). Ezek a toxinok hasmenést vagy vérzéses vastagbélgyulladást okozhatnak, és jelentős szerepet játszhatnak a hemolitikus-urémiás szindrómában (HUS) és a TTP fejlődésében (Bogdanović et al., 1991; Fang et al., 1999; Monforte-Cirac et al., 2010).
az ilyen betegségekben szerepet játszó citotoxinok közé tartozik a Shiga toxin és a szorosan kapcsolódó Stx. Az Stx-variánsokat Shigella, Enterobacter, Citrobacter, Acinetobacter, Campylobacter és Hamiltonella baktériumfajokban fejezik ki (Mauro és Koudelka, 2011). Alperi és Figueras (2010) leírta az Stx1 és Stx2 jelenlétét az Aeromonas spp.klinikai izolátumaiban., kapcsolódó gastroenteritis, vérzéses vastagbélgyulladás, HUS. Az ezeket a toxinokat kódoló gének különböző lambdoid bakteriofágokban helyezkednek el, amelyek lizogenizálják ezt a törzset. Ezenkívül az Aeromonas nemzetségnek van egy OMVs nevű nulla szekréciós rendszere. OMVs lehet egy eszköz, ami által egyes fehérjék, RNS, periplasmic világűrben, illetve egyéb összetevők kapcsolódó virulencia, lehet, hogy át vízszintesen más nemzetségek; ezért úgy tartják, hogy OMVs fontos szerepet játszanak a patogenitási (Guerrero-Mandujano et al., 2015a, b).
ezért a tanulmány célja az volt, hogy értékelje az Stx-nek a mexikóvárosi gyermekektől Vero sejtkultúrákban izolált törzsek által okozott károsodását.
Anyagok, Módszerek
Törzsek
Ez a tanulmány tartalmazza 66 klinikai izolátumok az INP, 54 nyert bél 12-től extra-bélrendszeri fertőzések. A törzseket az említett kórházban rutinvizsgálatra kapott példányokból izolálták; ezért a szülők vagy a gyermekek törvényes gyámjai nem kértek tájékozott beleegyezést. Minden törzset genetikailag a 16S rDNA-RFLP (Hernández-Cortez et al., 2011). Az Escherichia coli O157:H7 CECT 4076 típusos törzsét az orvosi bakteriológiai laboratórium (Escuela Nacional De Ciencias Biologicas, IPN) gyűjteményéből származó pozitív kontrollként és E. coli K12 törzsként (5512 ENCB) használták a toxintermelés negatív kontrolljaként. A törzseket rövid ideig szobahőmérsékleten tartották a vér agar alapú slantokon; hosszabb tárolás esetén -70°C-on fagyasztották 20% (w/v) glicerin-Todd-Hewitt húsleves (Oxoid, Mexikó) vagy liofilizálták 7-ben.5% ló glükóz szérum.
DNS extrakció
az összes tenyészetet triptikus szója agaron 30°C-on 18 órán keresztül termesztették. az egyes törzsek genomikus DNS-ét InstaGene Matrix (Biorad®, Mexikó) segítségével szereztük be a gyártó utasításai szerint. A DNS tisztaságát és mennyiségét az Ampli Quant AQ-07 spektrofotométer segítségével határoztuk meg. A DNS-t -20°C-on tárolták használatig.
stx1 és stx2 PCR Amplifikációk
az OMV-K DNS-éből és a genomikus DNS-ből származó stx1 és stx2 jelenlétét egyetlen PCR-reakcióval detektálták stx1f/STX1R és STXF/STXR primerek alkalmazásával, 144 és 217 bp termékkel, ezeket a primereket a szubunit a szekvenciája alapján tervezték.a primereket, a reakciót és az amplifikációs feltételeket a Hernández-Cortez által korábban leírt módon dolgozták fel et al. (2013), pozitív (E. coli O157:H7) és negatív (E. coli K12) kontrollokkal.
DNS szekvenálás
a polimeráz láncreakciós termékeket PureLink Quick Gel Extraction Kit (Invitrogen®, Mexikó) segítségével tisztítottuk a gyártó utasításai szerint. A termékeket közvetlenül egy ABI-PRISM 310 genetikai analizátoron (Applied Biosystems, Foster City, CA, USA) szekvenálták a PCR-hez használt előremenő és fordított primerek segítségével, a gyártó utasításai szerint. A szekvenálást az Instituto de Biología, UNAM (Mexikó) végezte. A szekvenciaelemzést a Nemzeti Biotechnológiai Információs Központ (NCBI) által biztosított alapvető helyi igazítási kereső eszközzel (BLAST) végezték.
microplate módszeren Vero Sejt Készítmények
Ez az eljárás végzett 96-hát microplates a Vero (ATCC CCL81) cellában monolayer 80% következménye, hozzátéve, minimális alapvető közepes (MEM; Invitro®, Mexikó), kiegészítve 10% v/v magzati szarvasmarha szérum (FBS; Invitro®, Mexikó).
a sejtszuszpenziót Homogenizáltuk és Neubauer kamrával 105-106 sejt/mL-re állítottuk be. A beállítás után a szuszpenziót 200 µL-es kútba helyezték. A mikroplátumokat 37°C-on inkubáltuk 5% CO2 alatt 24 órán keresztül (CO2 inkubátor, VWR Scientific, USA) (Giono-Cerezo et al., 1994).
sejtmentes bakteriális készítmények
minden vér agarlemezből öt telepet oltottunk be 3 mL Craig közegbe (0,4% élesztőkivonat, 3% casamino savak, 0,05% K2HPO4). Ezeket 37°C-on 24 órán át inkubálták, az alkalmazott baktériumkultúra optikai sűrűsége pedig 0,25 volt 600 nm-en. Sejt-mentes készítmények készítette centrifugálással a kultúrák a 14,000 g, 10 perc, 4°C-on, majd szűréssel a felülúszót keresztül membrán szűrő (pórusméret 0.45-kor Sartorius Minisart NML). A sejtmentes szupernatánsokat -20°C-on tároltuk. összesen 66 sejtmentes baktériumkészítményt kaptunk ilyen módon; a pozitív kontrollt (E. coli O157:H7) és a negatív kontrollt (E. coli K12) is ugyanúgy kaptuk (Giono-Cerezo et al., 1994).
citotoxikus vizsgálat és LD50 meghatározás
a sejtmentes szűrletet (20 µL) antibiotikum nélküli sejtekbe és a megfelelő növekedési közegbe oltották be. Az inokulált sejteket 37°C-on 96 órán át inkubáltuk 5% CO2-mal, és 24 óránként megfigyeltük a fordított mikroszkópon. A citotoxikus hatás várhatóan a vastag granulációval rendelkező sejtek kerekítésének és zsugorodásának, végül pedig az egyrétegű fokozatos és visszafordíthatatlan megsemmisülésének tűnik. Az összes vizsgálatot két példányban végezték el; a MEM és a Craig medium életképességi kontrolljait is elvégezték (Giono-Cerezo et al., 1994).
az LD50-et a Vero-sejtekben citotoxikus károsodást okozó pozitívként kimutatott Aeromonas törzsekben határozták meg. Egy standard 96-hát microplate módszeren a Vero sejt készült, amint azt a 2.6, de a közepes megváltozott 100 µL MEM 1% BFS. Ez a készítmény 100 µL sejtmentes baktériumkészítménynek volt kitéve, és soros hígításokat végeztek a lemezek egész során. 24 órás inkubálás után 37°C-on 5% CO2-mal meghatároztuk az LD50-et fordított mikroszkóp alatt. Az LD50-et a kúthoz rendelték, amelyben a Vero sejtek 50% – a sérült, 50%-a nem sérült (Marques et al., 1986).
Blokád, valamint Méreg Semlegesítő Assay
A méreg semlegesítő vizsgálatot végeztek a törzsek okozta citotoxikus kárt Vero sejt, mert ez kárt jelzi, hogy a Stx. Ehhez a vizsgálathoz, a microplate módszeren készült Vero sejt nőtt egyesülése 90-100% az LD50 minden egyes sejt-ingyenes bakteriális készítmény. Hogy végre a semlegesítés assay show-sejt károsodás előállított következtében Stx akció, két monoklonális antitestek (Universidad Nacional Autónoma de México), melyet az E. coli O157:H7 használtak.
Az egyes Ab egy Bradford protein mennyiségi meghatározására végzett a gyártó utasításainak megfelelően (Biorad), amelynek eredménye 78.2, valamint 74.8 µg/µL, illetve az anti-Stx1, valamint anti-Stx2 A. A koncentrált Ab dolgozott, majd kétszeres hígítású az Ab. Aztán, 10 µL Ab (anti-STX1, vagy anti-STX2) volt inkubáljuk 190 µL a sejt-ingyenes-vel koncentrációban LD50 1 h 37°C. ezt Követően 200 µL ez utóbbi volt beoltott, a Vero sejtek 90% – a gyülekezés, majd inkubáljuk 24 h 37°C-on, 5% CO2 (Marques et al., 1986).
OMV-K beszerzését és az OMV-kből származó DNS-extrakciót
külső membránhólyagok Aeromonas hydrophila F-0050-ből nyerték. A protokollt a Guerrero-Mandujano et al által korábban leírt módon hajtották végre. (2015a).
az OMVs DNS-ét Instagén mátrixon (Biorad®, Mexikó) keresztül szereztük be a gyártó utasításai szerint. Ezután az OMV-K DNS-ét a DNS-extrakciós fenol-kloroform technikával (Guerrero-Mandujano et al., 2015b).
Results
stx1 és stx2 Gene PCR Amplifications
66 klinikai Aeromonas törzs polimeráz-láncreakció-szűrése azt mutatta, hogy 22/66 (33,3%) törzs tartalmazta az stx1 gént, 42/66 (63,6%) törzs mindkét génre negatív volt, egyetlen törzs sem tartalmazott csak stx2 gént, és 2/66 (3%) törzs negatív mindkét génre nézve.
DNS szekvenálás
a BLASTn analízis 79-99%-os hasonlóságot és 3e-16/2e-97 várható értéket mutatott az E. coli O157:H7 STX-1 / stx-2 génjei és az Aeromonas spp-ből származó amplicon között., törzs.
Citotoxikus Vizsgálat, valamint LD50 Meghatározása
A citotoxicitási vizsgálat végzett Vero sejt kultúrák azt mutatta, hogy 17/66 (25.7%) cell-ingyenes baktérium készítmények okozott citotoxikus kárt, ami arra utal, termelés aktív Stx (1. Ábra), kiderült, a jellegzetes által okozott károk Stx.
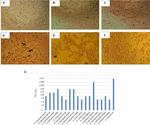
1.ábra. Vero sejtkultúrákban végzett citotoxicitási vizsgálat és LD50 meghatározás. A) Vero-sejtkultúra minimális alapvető közeggel (életképességi vizsgálat). B) Vero sejtkultúra Craig Mediummal (életképességi teszt). C) negatív kontroll E. coli K12-vel. D) pozitív kontroll E. coli O157: H7 esetén citotoxikus károsodás (nyilak) látható a sejt egyrétegű és a “régi csipke” hatás megsemmisítésével. E) az A. hydrophila F-0050 törzs citotoxikus károsodása. F) Az A. caviae 421423 törzs citotoxikus károsodása. G) az összes törzs LD50 titerének grafikus ábrázolása.
Az eredmény meghatározására LD50 titer a következők voltak: 6/17 (35.2%) cell-ingyenes baktérium készítmények bemutatott egy titere 1:16; 5/17 (29.4%) cell-ingyenes baktérium készítmények ábrázolt titere 1:8; 3/17 (17.6%) cell-ingyenes baktérium készítmények volt egy titere 1:64; 2/17 (11.7%) cell-ingyenes baktérium készítmények egy titere 1:32; valamint 1/17 (5.8%) sejt-ingyenes baktérium készítmények egy titere 1:256 (Ábra 1 G).
Toxin semlegesítés
anti-STX1 Ab alkalmazása 11/17-ben (64.7%) törzsek a kár, hogy a sejtek a felülúszót teljesen gátolta a 39.1 µg/µL Ab koncentráció; a 4/17 (23.5%) cell-ingyenes baktérium készítmények, csökken a sejt károsodás volt megfigyelhető azonos koncentrációban; valamint a 2/17 (11.7%) cell-ingyenes baktérium készítmények, cella kár volt teljesen gátolta a koncentráció 78.2 µg/µL. Használja az Ab anti-STX2 kimutatta, hogy 9/17 (52.9%) cell-ingyenes baktérium készítmények, sejt károsodás teljesen gátolta a 37.4 µg/µL, valamint 6/17 (35.2%) cell-ingyenes baktérium készítmények mutatott csökkent sejt károsodás azonos koncentrációban; valamint a 2/17 (11.7%) sejtmentes bakteriális készítmények, a sejtkárosodást teljesen gátolták 74,8 µg/µL Ab koncentrációval (2.és 3. ábra).

2.ábra. A Vero sejtkultúrában az Aeromonas spp sejtmentes bakteriális készítményei által kiváltott citotoxikus hatás gátlása. az stx1 vagy stx2 gént hordozó törzsek.
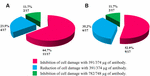
3. ábra. A sejtkárosodás gátlását vagy csökkenését mutató törzsek százalékos aránya. A) semlegesítés az anti-Stx1 Ab-vel. B) semlegesítés az anti-Stx2 Ab-vel.
stx1 Gene PCR Amplifications from OMVs
az OMVs DNS-jének polimeráz láncreakciója az A. hydrophila F-0050-ből kiderült, hogy az OMVs tartalmazza az stx1 generációt; ezért az OMVs potenciális jármű lehet a vízszintes virulencia gének átviteléhez (4.ábra).
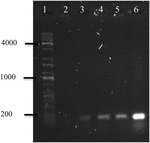
4.ábra. Az stx1 gén amplifikációjának elektroferogramja az OMVs DNS-éből. (1) Kapa univerzális létra, (2) negatív kontroll, (3) OMVs az A. hydrophila F-0050, (4) A. hydrophila F-0050, (5) OMVs E. coli O157:H7 és (6) E. coli O157:H7.
Vita
az Aeromonas nemzetség, mint az Stx gyártója, kialakuló kórokozó lehet, amely hasmenést okoz elsősorban gyermekgyógyászati betegeknél (Hernández-Cortez et al., 2011; Figueras és Baez-Hidalgo, 2014). Ennek ellenére ez a nemzetség relevánsabbá vált az orvosi területen, mivel Hus-t okozó kórokozó (San Joaquín and Pickett, 1988; Bogdanović et al., 1991; Robson et al., 1992; Fang et al., 1999; Monforte-Cirac et al., 2010).
ebben a vizsgálatban az stx1 és stx2 gének PCR-amplifikációjával azt találtuk, hogy 22/66 (33 .Az aeromonad törzsek 3% – a tartalmazta az stx1 gént, 42/66 (63,6%) törzs tartalmazta mindkét gént, és nem volt önmagában stx2-t tartalmazó törzs. Ez arra enged következtetni, hogy ez a gén széles körben elterjedt a gyermekgyógyászati betegektől izolált Aeromonas törzsekben, és hogy ezek a betegek veszélyeztethetik a HUS kialakulását.
csak egy korábbi jelentés, amelyben az stx gén vizsgálták Aeromonas izolált törzsek különböző kórházak Spanyolországban; a kapott eredmények voltak, hogy 19/80 (23.7%) törzsek volt a stx1 gén csak 1/80 (1.25%) a törzs mindkét gén esetében pozitív volt (Alperi és Figueras, 2010). Ezek az eredmények azt mutatják, hogy a gén nagyobb eloszlása van a Mexikói törzsekben; azonban figyelembe kell vennünk, hogy Spanyolországban az Aeromonas nemzetség egy ismert gasztrointesztinális kórokozó, amelyet rutinszerűen izolálnak gasztrointesztinális profilú betegeknél, ezért megfelelő kezelést kapnak ennek a nemzetségnek a szembesítésére.
Mexikóban ez a nemzetség nem szerepel a hasmenést okozó kórokozók listáján, és nem izolálják rendszeresen; ennek eredményeként nehéz bármilyen kezelést és jó életminőséget adni a betegeknek, ráadásul nincsenek statisztikák a prevalenciájáról. Ezen túlmenően a nemzetség a Mexikói lakosság társadalmi-gazdasági körülményei, köztük a vízhiány miatt relevánsabbá válik; Ez megkönnyíti annak átvitelét, és növeli annak lehetőségét, hogy a HUS közegészségügyi problémává váljon.
az amplikonok szekvenálását és a robbanás utáni keresést végezték el, amely 79-99%-os hasonlóságot és 3e-16/2e-97 várható értéket mutatott az stx1/stx2 gének között az E. coli O157:H7-hez képest.
az LD50-et úgy határozták meg, hogy a Vero sejtkultúrában a citotoxikus károsodást értékelik; ezzel a paraméterrel és a Marques et al alapján. (1986), a törzsek csoportosíthatók alacsony (2 × 101-6 × 102), mérsékelt (103-104), valamint magas (105-108) termelés (1g ábra). Marques et al. (1986) tanulmányt készítettek, amelyben hasonló vizsgálatot végeztek, mint a jelenlegi vizsgálatban, de különböző STEC törzsekkel 262/400 (63%) törzset csoportosítottak alacsony Stx-termelőkként, 48% pedig citotoxikus károsodást okozott; mindazonáltal ezeknek a törzseknek a 40%-ában a citotoxikus károsodást anti-Stx antitestekkel gátolták.
a jelen tanulmány, 25,7% – os, a baktérium-mentes készítmények okozott citotoxikus kárt jellemző Stx a Vero sejt, ami arra utal, termelés aktív Stx, minden Aeromonas törzsek voltak csoportosítva, mint alacsony termelők az Stx; azonban 50-70% – a, a sejt-ingyenes supernatants, a sejtkárosodást volt gátlásos, valamint a 20-30% – a sejt-ingyenes supernatants a sejtkárosodást csökkent (3.Ábra). A sejt-ingyenes supernatants, amelyek sejtkárosodást csökkent, ez lehetett volna, mert a két változat a toxin jelen a felülúszót, következésképpen, mivel ezek különböző immunológiai, a Stx nem lehet teljesen gátolta a sejtkárosodást maradt (Marques et al., 1986).
két korábbi vizsgálat (Haque et al., 1996; Alperi és Figueras, 2010) az Stx1-termelő Aeromonas törzsek 10,2% – át, illetve 10,53% – át kapta. Az aktív Stx-et termelő Aeromonas törzsek magasabb százalékának oka lehet az STX bakteriofág magas rendelkezésre állása a tenyészetben, mivel az Stx bakteriofág egyes STEC törzseit a szennyvíztisztító telepekből, a vágóhidakból és szarvasmarha-székletből (García-Aljaro et al., 2004, 2009). Hasonlóképpen transzdukciós vizsgálatokat végeztek in vivo az E. coli Stx-fágjaival, amelyek megfertőzhetik a bél mikrobiota baktériumokat, így a toxigén jellemző a korábban nem fertőzött törzsekre (Acheson et al., 1998; Schmidt et al., 1999; Gamage et al., 2003). Ugyanez történhet az Aeromonas nemzetséggel gastrointestinalis profil indukálásakor, majd az a tény, hogy az Aeromonas nemzetség képes a virulencia faktorokat a genomjába befogni és integrálni, ezek közül az egyik az Stx-kódoló gén.
a többi törzs citotonikus károsodást okozott a sejtben, ami az Stx-től eltérő különböző toxinok termelésére utalhat, mivel az Aeromonas olyan nemzetség, amely képes két citotonikus enterotoxin, termostabil (AST) és termolabile (ALT) (Figueras and Baez-Hidalgo, 2014) előállítására, amelyek Citotonikus károkat okozhatnak a Vero sejtekben; egy másik lehetőség az, hogy az Aeromonas törzsek egynél több bakteriofágot helyeznek be genomjukba, mivel bebizonyosodott, hogy a kettős lizogénnel rendelkező STEC törzsek képesek szabályozni a bakteriofágokat, hogy gátolják a litikus ciklusindukció kapacitását, ami az Stx termelés csökkenését eredményezi, de a gén elvesztése nélkül (García-Aljaro et al., 2004; Imamovic és Muniesa, 2011). Ezért meg kell határozni, hogy hány bakteriofágot tartalmaznak az Aeromonas törzsek, beleértve a jelen vizsgálatot is, hogy képesek legyenek korrelálni az Stx bakteriofágok jelenlétét és az Stx-ből előállított mennyiséget.
másrészt az Stx bakteriofágok jelenléte az indukálható Aeromonasban az stx gén vízszintes átviteli mechanizmusát jelenti, de ez nem az egyetlen. A legújabb tanulmányokban megállapították, hogy az Aeromonas képes OMV-k előállítására (Guerrero-Mandujano et al., 2015a) és ezek az OMV-k képesek integrált DNS-t szállítani (Guerrero-Mandujano et al., 2015b). A jelen vizsgálatban felerősítettük az stx1 gént egy klinikai eredetű A. hydrophila törzs OMVs-ből kivont DNS-ből, amely citotoxikus károsodást okozott a Vero sejtekben, és ezt a károsodást anti-Stx antitestekkel gátoltuk. Ez azt jelzi, hogy az Stx bakteriofág az stx gén transzportmechanizmusa, továbbá az OMV-k és a nemrégiben 0-as típusú Transzportrendszer képesek az stx gén Fajok közötti vagy fajközi elterjedésére. Mindazonáltal meg kell erősíteni, hogy az OMV-kben található gén teljes-e. A tanulmányban kapott eredmények alátámasztják azt a hipotézist, hogy az stx gén az Aeromonas egy másik feltételezett virulenciafaktora, amelyet az OMV-kkel lehet átvinni. Ez egy másik mechanizmust jelenthet az stx gén horizontális szállítására más Aeromonas törzsekre és / vagy más bakteriális nemzetségekre.
ezért az ok-okozati tényezők azonosítása során ezt a nemzetséget a gastroenteritis lehetséges kórokozójaként kell feltüntetni, és a szokásos egészségügyi felügyeleti eljárások részeként kell jelenteni.
Szerző Hozzájárulások
IP-M AG-M elvégezni a kísérleteket, illetve MR-R végezni a bioinformatikát elemzés, illetve elkészítette a kézirat; CH-C célja az alapozó; VB-G, illetve JM-L kritikusan nyilatkozott meg átdolgozta a kéziratot; GC-E fogant a vizsgálatban részt vett a tervezés, koordináció, értékelte az adatokat, majd elkészítette a kéziratot. Minden szerző elolvasta és jóváhagyta a végleges kéziratot. Szeretnénk köszönetet mondani Sofia Marteli Mulia-nak, hogy kedvesen kijavította a kézirat stílusát.
GC-E és VB-G támogatást kapott Estímulos al Desempeño en Investigación és Comisión y Fomento de Actividades Académicas (Instituto Politécnico Nacional) és Sistema Nacional de Investigadores (SNI, CONACyT). Ezt a tanulmányt a Nemzeti Politechnikai Intézet Kutatási és posztgraduális Titkársága finanszírozta (SIP 20160609). A SIP-IPN nem vett részt a tanulmányterv kidolgozásában, az adatok gyűjtésében, elemzésében és értelmezésében, a jelentés írásában, sem a kiadvány közzétételére vonatkozó határozatban. IP-M és AG-M ösztöndíjat kapott CONACyT és BEIFI.
összeférhetetlenségi nyilatkozat
a szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségnek tekinthetők.
Köszönjük Dr. Patricia Arzate Barbosa törzsizolátumok biztosítását, Dr. Armando Navarro pedig a monoklonális antitestek biztosítását.
rövidítések
Ab, antitest; HUS, hemolitikus urémiás szindróma; INP, Instituto Nacional de Pediatria Mexico; LD50, medián halálos adag; OMVs, Outer membrane vesicles; PCR, Polymerase chain reaction; STEC, Shiga toxin-producing E. coli; Stx, Shiga-like toxin; TTP, Thrombotic thrombocytopenic purpura.
Acheson, D. W., Reidl, J., Zhang, X., Keusch, G. T., Mekalanos, J. J., and Waldor, M. K. (1998). In vivo transduction with shiga toxin 1-encoding phage. Infect. Immun. 66, 4496–4498.
Google Scholar
Alperi, A., and Figueras, M. J. (2010). Az Aeromonas humán izolátumai shiga toxin génekkel (stx1 és stx2) nagyon hasonlítanak az Escherichia coli bridge virulens génvariánsaihoz. Clin. Mikrobiol. Megfertőzni. 16, 1563-1567. doi: 10.1111 / j. 1469-0691. 2010. 03203.x
CrossRef Full Text / Google Scholar
Bogdanovic, R., Čobeljić, M., Markovic, M., Nikolic, V., Ognjanović, M., Sarjanović, L., et al. (1991). Aeromonas hydrophila enterocolitissel összefüggő hemolitikus-urémiás szindróma. Gyermekgyógyász. Nephrol. 5, 293-295. doi: 10.1007
CrossRef teljes szöveg | Google Scholar
Castro-Escarpulli, G., Aguilera-Arreola, M. G., Giono-Cerezo, S., Hernández-Rodríguez, C. H., Rodriguez-Chacon, M., Soler, F. L., et al. (2002). Az Aeromonas nemzetség > fontos kórokozó Mexikóban? Enf. Infec. Mike. 22, 206–216.
Google Scholar
Castro-Escarpulli, G., Figueras, M. J., Aguilera-Arreola, M. G., Soler, L., Fernández-Rendón, E., Aparicio, G. O., et al. (2003). Az Aeromonas spp. jellemzése Mexikóban emberi fogyasztásra szánt fagyasztott halakból izolálva. Int. J. Élelmiszer Mikrobiol. 84, 41–49. doi: 10.1016 / S0168-1605(02)00393-8
CrossRef teljes szöveg | Google Scholar
Fang, J. S., Chen, J. B., Chen, W. J., and Hsu, K. T. (1999). Hemolitikus-ureémiás szindróma Aeromonas hydrophila enterocolitisben szenvedő felnőtt férfiakban. Nephrol. Tárcsázz. Transzplantáció. 14, 439–440. doi: 10.1093/ndt/14.2.439
CrossRef teljes szöveg/Google Scholar
Figueras, M. J., and Baez-Hidalgo, R. (2014). “Aeromonas,” in Encyclopedia of Food Microbiology, eds C. A. Batt and M. L. Tortorello (Cambridge, MA: Academic Press), 24-30.
Gamage, S. D., Strasser, J. E., Kréta, C. L., and Weiss, A. A. (2003). A nempatogén Escherichia coli hozzájárulhat a shiga toxin előállításához. Megfertőzni. Immun. 71, 3107–3115. doi: 10.1128 / IAI.71.6.3107-3115.2003
CrossRef teljes szöveg | Google Scholar
García-Aljaro, C., Muniesa, M., Jofre, J., and Blanch, A. R. (2004). Az stx2 gén prevalenciája a coliform populációkban a vízi környezetekből. Appl. Environ. Mikrobiol. 70, 3535–3540. doi: 10.1128 / AEM.70.6.3535-3540.2004
CrossRef teljes szöveg | Google Scholar
García-Aljaro, C., Muniesa, M., Jofre, J., and Blanch, A. R. (2009). Genotípusos és fenotípusos sokszínűség a környezeti Escherichia coli törzsekből származó indukált, stx2-hordozó bakteriofágok között. Appl. Environ. Mikrobiol. 75, 329–336. doi: 10.1128 / AEM.01367-08
CrossRef Full Text / Google Scholar
Giono-Cerezo, S., Rodríguez-Ángeles, M. G., Rodríguez-Cadena, M. J., and Valdespino-Gómez, J. L. (1994). Az Escherichia coli enterotoxinjainak és citotoxinjainak azonosítása vero sejtkultúrával és szilárdfázisú hibridizációval (colony blot). Latinoam Tiszteletes. Mikrobiol. 36, 231–241.
Google Scholar
Guerrero-Mandujano, A., López-Villegas, E. O., Longa-Briseño, A., and Castro-Escarpulli, G. (2015a). A külső membrán hólyagok előállítása az Aeromonas hydrophila klinikai törzsében. EC Mikrobiol. 1, 113–117.
Google Scholar
Guerrero-Mandujano, A., Palma-Martínez, I., and Castro-Escarpulli, G. (2015b). A DNS szállítása az Aeromonas hydrophila külső membránhólyagjaival. EC Mikrobiol. 2, 354–357.
Google Scholar
Haque, Q. M., Sugiyama, A., Iwade, Y., Midorikawa, Y., and Yamauchi, T. (1996). Az Aeromonas spp.hasmenéses és környezeti izolátumai készítsen egy toxint, amely hasonló a shiga-szerű toxinhoz 1. Curr. Mikrobiol. 32, 239–245. doi: 10.1007/s002849900043
CrossRef teljes szöveg | Google Scholar
Hernández-Cortez, C., Aguilera-Arreola, M. G., Chávez-Méndez, Y., Arzate-Barbosa, P., Lara-Hernandez, A., és Castro-escarpulli, G. (2011). Az Aeromonas spp. törzseinek genetikai azonosítása elszigetelt az Országos gyermekgyógyászati Intézetben. Enfer Tiszteletes. Infecc. Gyermekgyógyászati. 24, 157–165.
Google Scholar
Hernández-Cortez, C., Méndez-Tenorio, A., Aguilera-Arreola, M. G., and Castro-Escarpulli, G. (2013). Négy multiplex polimeráz láncreakció tervezése és szabványosítása a gasztrointesztinális betegségeket okozó baktériumok kimutatására. Afr. J. Mikrobiol. Res. 7, 2673-2681. doi: 10.5897/AJMR2013.5452
CrossRef teljes szöveg | Google Scholar
Imamovic, L., and Muniesa, M. (2011). A Shiga toxint kódoló bakteriofágok fertőzőképességének számszerűsítése és értékelése marhahúsban és salátában. Appl. Environ. Mikrobiol. 77, 3536–3540. doi: 10.1128 / AEM.02703-10
CrossRef teljes szöveg | Google Scholar
Marques, L. R. M., Moore, M. A., Wells, J. G., Wachsmuth, I. K., and O ‘ Brien, A. D. (1986). Shiga-szerű toxin termelése Escherichia coli által. J. Fertőz. Dis. 154, 338–341. doi: 10.1093/infdis/154.2.338
CrossRef Full Text/Google Scholar
Mauro, S. A., and Koudelka, G. B. (2011). Shiga toxin: expresszió, Eloszlás, szerepe a környezetben. Toxinok 3, 608-625. doi: 10.3390/toxins3060608
CrossRef teljes szöveg | Google Scholar
Monforte-Cirac, M. L., Palacian-Ruiz, M. P., Aisa-Iriarte, M. L., és Espuelas-Monge, M. (2010). Az Aeromonas hemolitikus urémiás szindróma: egy klinikai esetről. Clin Tiszteletes. Szellem. 210, 206–207. doi: 10.1016 / j. Ker.2009.08.002
CrossRef teljes szöveg/Google Scholar
Robson, W. L. M., Leung, A. K. C., and Trevenen, C. L. (1992). Aeromonas hydrophila enterocolitissel összefüggő hemolitikus-urémiás szindróma. Gyermekgyógyászati. Nephrol. 6, 221–222. doi: 10.1007
CrossRef Full Text / Google Scholar
San Joaquin, V. H., and Pickett, D. A. (1988). Aeromonas-kapcsolódó gastroenteritis gyermekeknél. Gyermekgyógyász. Megfertőzni. Dis. J. 7, 53-57. doi: 10.1097 / 00006454-198801000-00013
CrossRef teljes szöveg | Google Scholar
Schmidt, H., Bielaszewska, M., and Karch, H. (1999). Az enterális Escherichia coli izolátumok transzdukciója az Escherichia coli O157:H7-ből izolált f3538 bakteriofágot kódoló shiga toxin 2 származékával. Appl. Environ. Mikrobiol. 65, 3855–3861.
Google Scholar