mennyi energia szabadul fel az ATP hidrolízis során?
Reader Mode
ATP gyakran nevezik az energia valuta a sejt. A sejtben a metabolikus transzformációktól a jelátviteli eseményekig terjedő reakciók százai kapcsolódnak az ATP víz általi hidrolíziséhez (szó szerint “vízlazítás”). A reakció ATP + H2O <> ADP + PI az adenozin-trifoszfátot (ATP) adenozin-difoszfáttá (ADP) és szervetlen foszfáttá (pi) alakítja. Az ehhez a reakcióhoz kapcsolódó szabad energiaváltás a sejtreakciók nagy részét a membránpotenciállal hajtja végre, a másik két domináns energiaforrás pedig az energiát csökkenti. De pontosan mennyit ér ez az energiapénz, és mit árul el a megvásárolható vegyi ügyletekről? Természetesen erre a kérdésre nincs válasz, mivel az e hidrolízis reakció által felszabadított energia mennyisége az intracelluláris körülményektől függ, de lehetséges, hogy néhány egyszerű becslést igénybe véve érezzük ennek a pénznemnek a hozzávetőleges “értékét”.

1. Ábra: A kapcsolat a Gibbs ingyen energia az ATP hidrolízis normál körülmények között, hogy az egyensúlyi állandó, valamint a kapcsolatban a szabad energia a hidrolízis alatt élettani körülmények között a fiziológiai fehérjék koncentrációja.
az ATP-hidrolízis miatti Gibbs-féle szabad energiaváltás (ΔG) az 1.ábrán látható reakció különböző résztvevőinek koncentrációjától függ. Ha a koncentrációk távolabb vannak egyensúlyi értéküktől, akkor a ΔG abszolút értéke nagyobb. “Standard” feltételek mellett (azaz az ATP-hidrolízis Gibbs szabad energiája -28-tól -34 kJ/mol-ig (azaz ≈12 kBT, BNID 101989) változik, a kation Mg2 + koncentrációjától függően. Az Mg-ionoktól való függőség azért következik be, mert a pozitív töltésű magnéziumionok segítenek az ATP molekula stabilizálásában. A cellában azonban a körülmények soha nem állnak közel a standard állapotértékekhez. Például az 1M ATP koncentrációja azt jelentené, hogy az oldott anyag tömege hasonló lenne a víz oldószeréhez. Az 1. ábrán a fiziológiás szabad energia (ΔG) gyakran zavaró levezetését mutatjuk be, figyelembe véve a koncentrációk arányát a standard értéktől (ΔGo). Az olyan kifejezések szerinti felosztásnak, mint például az egységek logaritmusként való ellátásához, mindig tartalmaznia kell egy unitless kifejezést. Néha meglepő azt gondolni, hogy ha a sejt egyensúlyban lenne, akkor a ΔG értéke nulla lett volna,és nem lenne energia az ATP hidrolízissel. Szerencsére ez soha nem így van az élő szervezetekben. .
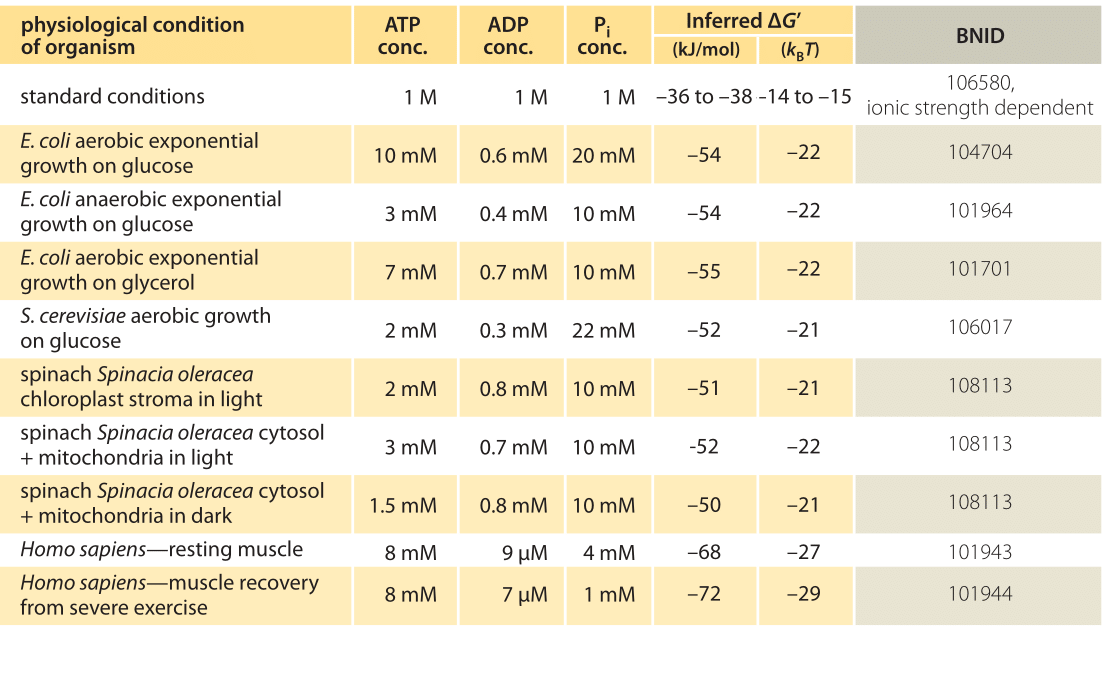
1. táblázat: szabad energia ATP hidrolízishez különböző szervezetekben, különböző fiziológiai körülmények között. A -37,6 kJ/mol ΔG’ 0 értékéből levezetett ΔG’számítások. Ez a táblázat értékeit egymás között konzisztensvé teszi, de kis eltéréseket hoz létre az elsődleges forrásokban jelentett ΔG értékektől. Ezek az eltérések az ionos szilárdság, a pH és a mérési módszerek eltéréseiből eredhetnek. Az értékeket egy vagy két jelentős számjegyre kerekítik. A spenótban, ahol a Pi-koncentrációt nem jelentették, 10 mM-es jellemző értéket alkalmaztak (BNID 103984, 103983, 111358, 105540).
a gyakorlatban a fiziológiai állapotok a vizsgált organizmustól, a vizsgált sejt szövetétől vagy rekeszétől, valamint a metabolikus és egyéb reakciók aktuális energiaigényétől függenek. Például a perfúzált patkánymájban az ATP-ADP arány körülbelül 10:1 volt a citozolban, de 1:10 a mitokondriumokban magas glikolízis mellett, alacsony glikolízis mellett mindkét arány sokkal közel volt az 1-hez (BNID 111357). Ezért a ΔG értéktartománya várható. Ennek a tartománynak a megértéséhez az a kulcs, hogy megértsük, mennyi Q különbözik a K-tól, azaz hogyan különböznek a koncentrációk a standard feltételektől. Az összes releváns komponens (ATP, ADP és Pi) tipikus intracelluláris koncentrációja mM-es tartományban van, jóval alacsonyabb, mint a szokásos körülmények között. Az arány / koncentráció az mM tartományban sokkal alacsonyabb, mint egy, és a reakció energetikailag kedvezőbb lesz, mint az 1. táblázatban bemutatott normál körülmények között. A legnagyobb értéket ≈-70 kJ / mol (≈30kbt) az edzés után felépülő sportolók emberi izomzatának értékeiből számították ki (BNID 101944). A glükózon növekvő E. coli sejtekben -47 kJ / mol értéket jelentettek (≈20kbt, BNID 101964). Ahhoz, hogy ezeket a számokat perspektívába tegyük, egy molekuláris motor, amely nagyjából 5 pN (BNID 101832) erőt fejt ki egy 10 nm-en (BNID 101857) a lépés mérete 50 pN nm-es sorrendben működik, valamivel több, mint 10 kBT energiát igényel, jóval azon a tartományon belül, amit egyetlen ATP képes szállítani.
A ΔG számításai megkövetelik a releváns intracelluláris koncentrációk pontos mérését. Az ilyen koncentrációkat in vivo emberben nukleáris mágneses rezonancia alkalmazásával mérik. A foszfor természetes formája (31P) mágneses tulajdonságokkal rendelkezik, ezért nincs szükség külső anyag hozzáadására. Az érdekes szövet, például az izom erős mágneses térbe kerül, és a rádióimpulzusok frekvenciájának eltolódásával az ATP és a Pi koncentrációját közvetlenül az NMR spektrum csúcsaiból következtetjük. E. coli, az ATP koncentrációját közvetlenül az ATP biolumineszcencia vizsgálattal lehet mérni. A tenyészetből eltávolított növekvő baktériumok mintáját luciferáz, a tintahalakkal szimbiózisban élő baktériumokból származó fehérje segítségével lehet meghatározni, de ez már molekuláris riporterként csatlakozott a biológusok eszköztárához. A luciferáz enzim ATP-t alkalmaz egy olyan reakcióban, amely fényt termel, amelyet luminométerrel lehet mérni, az ATP-koncentráció pedig a jel erősségéből következtethető. Tehát cellatartalmunk van bemenetként, luciferáz mint “eszköz”, amely az ATP mennyiségét fénykibocsátássá alakítja, amely a mért kimenetként szolgál. Az olyan eszközök használata, mint ezek, úgy találja, hogy a” való életben “az ATP körülbelül kétszer annyit ér, mint a” standard ” körülmények között, mivel a koncentrációk kedvezőbbek az előremutató reakcióhoz.
azzal fejezzük be, hogy állandó kérdés, hogy miért különítették el az adenin nukleotidot, hogy a GTP fő energiapénzként szolgáljon, a többi nukleotid pedig sokkal kisebb szerepet tölt be. Véletlen választás, amely később “fagyott baleset” lett, vagy szelektív előny volt az ATP számára a GTP, a CTP, az UTP és a TTP felett?




