Key Terms
győződjön meg róla, hogy meghatározhatja és használhatja a kontextusban az alábbi kulcsfontosságú kifejezéseket.
- Adams ‘ catalyst
- hidrogénezés
vizsgálati Megjegyzések
a heterogén kémiai reakcióknak legalább két különböző fázisában (pl. szilárd gázzal) vannak reakciói, míg a homogén reakciók egyfázisban fordulnak elő (pl. gáz egy másik gázzal).
némi zavart okozhat az alkének és a hidrogén reakciójában használt katalizátor leírása. Általában három fémet—nikkelt, platinát és palládiumot—használnak, de egy vegyész nem tud egyszerűen egy ilyen fémdarabot az alkén és a hidrogén keverékébe helyezni, és reakciót kapni. Minden fém katalizátort speciális módon kell elkészíteni:
- a nikkelt általában finoman osztott formában használják, úgynevezett ” Raney nikkel.”Úgy készül, hogy egy ni-Al ötvözetet NaOH-val reagál.
- a palládiumot inert anyag, például faszén (PD/C) kereskedelmileg “alátámasztva” állítják elő. Az alként általában etanolban oldják, amikor PD / C-t használnak katalizátorként.
- platinum használják PtO2, Adams katalizátor, bár ez valójában platina fém, hogy a katalizátor. A szén-szén kettős kötéshez használt hidrogén szintén csökkenti a platina (IV) – oxidot finoman osztott platina fémre. Az alkén oldószereként etanolt vagy ecetsavat használnak.
más, többszörös kötéseket tartalmazó vegyületek, például ketonok, észterek és nitrilek nem reagálnak hidrogénnel az alkének hidrogénezésére használt körülmények között. Az alábbi példák egy alkén csökkenését mutatják, de a jelen lévő keton – és nitrilcsoportok érintetlenek maradnak,és nem csökkennek.

az aromás gyűrűk szintén nem csökkennek az alkének csökkentésére alkalmazott körülmények között, bár ezek a gyűrűk úgy tűnik, hogy három szén-szén kettős kötést tartalmaznak. Amint majd később látni, aromás gyűrűk nem tartalmaznak kettős kötések, sok kémikusok inkább képviselik a benzol gyűrű, mint egy hatszög egy kör belsejében

inkább, mint a hatszög három váltakozó kettős kötések.
a benzolgyűrű ábrázolását tovább tárgyaljuk a 15.2.szakaszban.
a szén-szén kettős kötések és a hidrogén közötti reakció módszer a vegyületben lévő kettős kötések számának meghatározására. Például egy ciklohexén mól reagál egy mól hidrogénnel, hogy egy mól ciklohexánt állítson elő:

de egy mól 1,4-ciklohexadién reagál két mól hidrogénnel, hogy egy mól ciklohexánt képezzen:
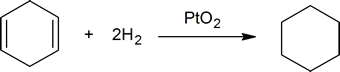
egy vegyész azt mondaná, hogy a ciklohexén egy hidrogén ekvivalenssel reagál, az 1,4-ciklohexadién pedig két ekvivalens hidrogénnel reagál. Ha ismert mennyiségű ismeretlen, telítetlen szénhidrogént vesz be, és meghatározza, hogy mennyi hidrogént fog felszívni, könnyen meghatározhatja a szénhidrogénben jelen lévő kettős kötések számát (lásd a 2. kérdést alább).
a hidrogén szén-szén kettős kötéshez való hozzáadását hidrogénezésnek nevezzük. Az ilyen kiegészítés általános hatása a kettős kötés funkcionális csoportjának reduktív eltávolítása. A regioszelektivitás nem kérdés, mivel ugyanaz a csoport (hidrogénatom) kötődik az egyes kettős kötésű karbonokhoz. Két hidrogénatom legegyszerűbb forrása a molekuláris hidrogén (H2), de az alkének hidrogénnel való keverése nem eredményez észrevehető reakciót. Bár a teljes hidrogénezési reakció exoterm, a magas aktiválási energia megakadályozza, hogy normális körülmények között megtörténjen. Ezt a korlátozást katalizátor alkalmazásával ki lehet kerülni, amint az az alábbi ábrán látható.
az alkén-addíciós reakció egyik példája az úgynevezett folyamat hydrogenation.In hidrogénezési reakció, két hidrogénatomot adunk az alkén kettős kötésén keresztül, ami telített alkánt eredményez. A kettős kötés hidrogénezése termodinamikailag kedvező reakció, mivel stabilabb (alacsonyabb energiájú) terméket képez. Más szavakkal, a termék energiája alacsonyabb, mint a reaktáns energiája; így exoterm (hő szabadul fel). A felszabaduló hőt a hidrogénezés hőjének nevezik, ami egy molekula stabilitásának mutatója.


katalizátorok olyan anyagok, amelyek megváltoztatják a kémiai reakció sebességét (sebességét) anélkül, hogy fogyasztanák vagy megjelennének a termék részeként. A katalizátorok a reakciók aktiválási energiájának csökkentésével hatnak, de nem változtatják meg a reagensek és termékek relatív potenciális energiáját. A legszélesebb körben használt hidrogénező katalizátorok közé tartoznak a finomra osztott fémek, mint például a platina, a palládium és a nikkel. A katalitikus hidrogénezés legalább két szakaszban történik, az ábrán látható módon. Először az alként adszorbeálni kell a katalizátor felületén, néhány hidrogénnel együtt. Ezután két hidrogén eltolódik a fémfelületről a kettős kötés szénére, a kapott telített szénhidrogén, amely gyengébben adszorbeálódik, elhagyja a katalizátor felületét. Az utolsó események pontos jellege és időzítése nem tisztázott.

az energiagazdálkodási ábrán látható módon az alkének hidrogénezése exoterm, és az ábrán látható ΔE (zöld színű) hő szabadul fel. Ez a reakcióhő felhasználható azon alkének termodinamikai stabilitásának értékelésére, amelyek különböző számú alkil-szubsztituenst tartalmaznak a kettős kötésen. Például az alábbi táblázat három C5H10 alkén hidrogénezésének melegítését sorolja fel, amelyek ugyanazt az alkánterméket (2-metil-bután) adják. Mivel a reakció nagy hője nagy energiájú reagenst jelez, ezek a melegítések fordítottan arányosak az alkén-izomerek stabilitásával. Egy durva közelítés, azt látjuk, hogy minden alkil szubsztituens egy kettős kötés stabilizálja ezt a funkcionális csoport egy kicsit több, mint 1 kcal/MOL.
| Alkene Isomer | (CH3)2CHCH=CH2 3-methyl-1-butene |
CH2=C(CH3)CH2CH3 2-methyl-1-butene |
(CH3)2C=CHCH3 2-methyl-2-butene |
|---|---|---|---|
| Heat of Reaction ( ΔHº ) |
–30.3 kcal/mole | –28.5 kcal/mole | –26.9 kcal/mole |

az itt bemutatott mechanizmusból arra számítunk, hogy a hidrogén hozzáadása syn-sztereoszelektivitással történik. Ez gyakran igaz, de a hidrogénező katalizátorok a kettős kötés izomerizációját is okozhatják a hidrogén hozzáadása előtt, ebben az esetben a sztereoszelektivitás bizonytalan lehet.

gyakorlatok
- a reakcióban
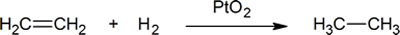
- 0.500 mol etén reagál _ _ _ _ _ _ mol hidrogénnel. Így egy kémikus azt mondhatja, hogy az etén egy _______ hidrogénnel reagál.
- az etén _______; míg a _______ oxidálódik.
- az eténben a szén oxidációs száma _______; etán esetében _______.
- amikor egy bizonyos triglicerid (zsír) 1000 g-ját hidrogéngázzal kezelik Adams katalizátor jelenlétében, megállapítást nyert, hogy a 99,8 kPa-nál és 25,0°C-on fogyasztott hidrogéngáz térfogata 162 mL. Egy külön kísérlet azt jelzi, hogy a zsír moláris tömege 914 g mol−1. Hány szén-szén kettős kötést tartalmaz a vegyület?
válaszok:
-
-
válasz megjelenítése
-
válasz megjelenítése
-
válasz megjelenítése
-
-
Show Válasz
Examples
Question
Predict the products if the following alkenes were reacted with catalytic hydrogen.

Solution

Contributors
- Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
- Prof. Steven Farmer (Sonoma Állami Egyetem)
- Szerves Kémia biológiai hangsúlyozással Tim Soderberg (Minnesota Egyetem, Morris)