izom plaszticitás
a vázizom a test legnagyobb szövete. Nagyon műanyag, és drámai, nem patológiás ingadozásokon megy keresztül mind a tömegben, mind az erősségben, számtalan környezeti hatás hatására. Az anabolikus szteroidok rezisztenciáját vagy expozícióját követően az izmok hipertrófián mennek keresztül, és növelik annak tömegét, keresztmetszetét és erejét (Aagaard, 2004; Schiaffino et al., 2013). Ugyanezek a paraméterek esedékesen csökkenhetnek, amikor az izmok atrófiát indítanak a sértések bármelyikére reagálva, amelyek a következők: éhezés, denerváció, immobilizáció, szepszis, rák cachexia, szívelégtelenség, cukorbetegség, veseelégtelenség, krónikus obstruktív tüdőbetegség, és szerzett immunhiányos szindróma (Schiaffino et al., 2013).
az atrófia következményei nyilvánvaló következményekkel járnak az egészségre. Az izomgyengeség jelentős mértékben hozzájárul mind a mortalitáshoz, mind a morbiditáshoz, és minden halálok fokozott kockázatával jár (Metter et al., 2002). Tény, hogy csökkenti az izomsorvadás a rák cachexia jelentősen meghosszabbítja az életet (Zhou et al., 2010). Is, sok idősebb egyének szenvednek sarcopenia, egy elhúzódó izomsorvadás zavar, amely általában akkor kezdődik, 50 éves kor után, és magában foglalja a veszteség mintegy 1% – A izomtömeg évente (Woo, 2017). Ez azt jelenti, hogy a 80 éves kor, szarkopéniás egyének elvesztették mintegy 40% – át izomtömeg, kulcsfontosságú tényező esik, törékeny, ápolási otthon felvételi. Következésképpen az atrófia mechanizmusainak és lehetséges terápiás válaszainak megértése széles alap-és klinikai érdeklődésre számot tart (Ali and Garcia, 2014; Cohen et al., 2015; Ziaaldini et al., 2017).
Myonuclear Domain hipotézis
a vázizom meglehetősen egyedülálló, mivel az érett sejtek syncytiálisak, több száz magot tartalmazhatnak. Ez egy szükséges alkalmazkodás, mivel az egyes izomrostok hatalmasak lehetnek, elérve a ~600 mm (23 in) hosszúságot (például sartorius izom; Yang et al., 1998) és olyan térfogatok, amelyek több mint 100 000-szer nagyobbak lehetnek, mint egy tipikus mononukleált sejt (Bruusgaard et al., 2003). A több magból származó hozzájárulások szükségesek ahhoz, hogy nagy mennyiségű mRNS-t termeljenek, amelyek a kontraktilis berendezés (Nevalainen et al., 2013).
mind az izom műanyag jellege, mind a syncytial szervezete vitát váltott ki, amely csak a közelmúltban tűnik megoldottnak—a “myonuclear domain hipotézis” (Qaisar and Larsson, 2014; Gundersen, 2016; Schwartz et al., 2016). Ez az elmélet a Strassburger (1893) által javasolt “Wirkungssphäre” vagy “befolyási szféra” fogalmából származik, amelyben azt állította, hogy egy mag csak egy diszkrét citoplazma térfogatát támogathatja, ezáltal meghatározva a sejtméret felső korlátait. Ezt az elvet tovább dolgozta ki Gregory (2001), aki azzal érvelt, hogy a sejtek dezoxiribonukleinsav-tartalma és térfogata szorosan kapcsolódik egymáshoz. A vázizom syncytial jellege segít ezeknek a sejteknek leküzdeni ezt a korlátozást. A myonukleáris domain hipotézis azt diktálja, hogy a megfelelő nukleáris-citoplazmatikus arány fenntartása érdekében a hipertrófia során új magokat adnak hozzá, amelyek atrófiával elvesznek.
jelentős adatok bizonyítják, hogy a nukleáris szám növekszik az izom-hipertrófiával (Moss, 1968; Cabric and James, 1983; Egner et al., 2016), bár némi ellentmondás marad (Murach et al., 2018). Ez a folyamat intenzív vizsgálati terület volt, és a közelmúltban meghatározták az új magok hipertrófia során történő megszerzését szabályozó mögöttes molekuláris mechanizmusokat (Guerci et al., 2012; Bentzinger et al., 2014; Ross et al., 2018). Ezek a számfeletti az atommagok szerzett, amikor lineage-korlátozott őssejtek, jellemzően műholdas sejtek, biztosítékot izomrostok is hozzájárulnak a magok (Brack, valamint Véletlenszerű, 2012; Bachman et al., 2018). A műholdas sejtek az alagsori membrán alatt helyezkednek el, és a sarcolemma-t ütköztetik (Katz, 1961; Mauro, 1961). Nyugalmi állapotban maradnak mindaddig, amíg anabolikus szteroidok, például a tesztoszteron vagy a rezisztencia gyakorlását követő fókuszkárosodás nem stimulálja őket, ekkor újra belépnek a sejtciklusba és szaporodnak (Joubert and Tobin, 1995; Abreu et al., 2017). Néhány lánysejt összeolvad az izomrostokkal, és elősegíti mind a javítást, mind a növekedést, míg mások letartóztatják és helyreállítják a műholdas medencét (Dumont et al., 2015; Goh and Millay, 2017). A fennmaradó többlet sejtek apoptózison mennek keresztül (Schwartz, 2008).
a myonuclearis domain hipotézis ellentmondásos aspektusa az az állítás, hogy a myonucleusok elvesznek az atrófia során. Számos olyan beavatkozás van, amely atrófiát okoz az állati modellekben, beleértve: immobilizáció, denerváció és szepszis (Fitts et al., 1986; Minnaard et al., 2005; O ‘ Leary et al., 2012). Mindegyik esetben mind az izom keresztmetszeti területe (az elsődleges vizsgálat), mind az apoptotikus sejtek megjelenése a szövetben (McCall et al., 1998; Smith et al., 2000; Strasser et al., 2000; Alway et al., 2003; McClung et al., 2007; Andrianjafiniony et al., 2010; Guo et al., 2012; Palumbo et al., 2012; Barnes et al., 2015; Cheema et al., 2015; Li et al., 2016; Kletzien et al., 2018). Ezekben a vizsgálatokban az apoptózist számos módszerrel mérik, beleértve a kaszpáz aktivációt, a mitokondriális EndoG felszabadulást vagy a DNS fragmentációját . Ezek a vizsgálatok meggyőző adatokat szolgáltatnak arról, hogy az apoptózis drámaian megnő az atrófia korai szakaszában. Például egy nemrégiben átfogó tanulmányban (Guo et al., 2012), Guo et al. az egereket 14 napos hátsó végtagi szuszpenziónak vetették alá, ami az izom nedves tömegének ~69%-os csökkenését és a keresztmetszeti terület ~43,8% – os csökkenését eredményezte a nem szabályozott kontralaterális izomhoz képest. A szerzők számszerűsítették számos apoptózis markerek, beleértve TUNEL festés, kaszpáz-3 hasítás / aktiválás, és a hasítás poli (adenozin-difoszfát ribóz) polimeráz (PARP), a fehérje részt vesz a DNS-javítás. Ezen apoptózis-intézkedések mindegyike jelentősen nőtt a hátsó végtagok felfüggesztését követően. Míg a tanulmány elsődleges célja az volt, hogy értékelje az elektromos stimuláció pozitív hatását az atrófia korlátozására sértés után, ők és sok más kutató úgy értelmezik az ilyen típusú adatokat, mint amelyek erős támogatást nyújtanak a myonukleáris domain hipotézishez.
sejtbiológiai szempontból a sejtmagok feltételezett elvesztése egy syncytialis szövetben, mint például a vázizom, jelentős gyakorlati problémát jelent. Hogyan válhat egy egyedi mag olyan veszélybe, hogy genomja gyorsan összezsugorodik és fragmentálódik, miközben szomszédai megmaradnak, és segítenek fenntartani az izomrost életképességét? Tekintettel arra, hogy az apoptózist általában a kaszpázok néven ismert cisztein proteázok aktiválása közvetíti, nem világos, hogy milyen mechanizmus szolgálhat a diffúz proteáz aktivitásának korlátozására egy közös citoplazmán belül.
ezt a kérdést közvetetten egy másik syncytial sejttípusban, a humán syncytiotrophoblastban, a placentát körülvevő szövetben, amely körülbelül 5 × 1010 magot tartalmaz (Mayhew et al., 1999). Amikor az apoptózist a syncytiotrophoblastban indukálják, körülbelül 5 mikron / perc sebességgel terjed, amíg az egész szövet be nem kerül (Longtine et al., 2012). Következésképpen nincsenek” kiváltságos ” régiók a syncytial citoplazmán belül, és az összes mag végül megsemmisül.
a vázizom apoptózisának elemzésével kapcsolatos egyik legfontosabb kihívás az, hogy ez egy nagyon heterogén szövet, ahol a magok körülbelül fele az izomrostokon kívül helyezkedik el (Schmalbruch and Hellhammer, 1977). Ezek a mononukleált sejtek közé tartoznak a műholdas sejtek, endothel sejtek, fibroblasztok, pericytes, és makrofágok (Tedesco et al., 2010). Következésképpen nagyon nehéz meghatározni, hogy a sarcolemma melyik oldala, a mag lakik, így ha ez egy igazi myonucleus.
in Vivo Time-Lapse képalkotás jelölt egér izomrostok
annak ellenére, hogy a nagyszámú papírok bizonyítják apoptózis során izomsorvadás, több szerző megkérdőjelezte ezeket az eredményeket (Wada et al., 2002; Zhong et al., 2005; Aravamudan et al., 2006; Gundersen and Bruusgaard, 2008; Duddy et al., 2011; Qaisar and Larsson, 2014). Például izolált izomrostok in vitro, Duddy et al. megjegyezte, hogy míg az izomrost mennyisége idővel csökkent, tükrözve egy atrófiás folyamatot, a myonuclei száma stabilnak tűnt (Duddy et al., 2011).
egy sor elegáns kísérletek, a Gundersen lab injektált egyedi extensor digitorum longus (EDL) vagy soleus izmok izomrostok színezékek, hogy önállóan jelölt a magok és citoplazma érzéstelenített egerek (Bruusgaard and Gundersen, 2008; Bruusgaard et al., 2010). Ez lehetővé tette számukra, hogy idővel azonosítsák az egyes izomrostok egyes magjait in vivo, majd értékeljék sorsát. Például az EDL izmokat hipertrófiára indukálták a fő szinergisták ablációjával (Bruusgaard et al., 2010). A 6.és 11. nap között a myonukleuszok száma mintegy 54%-kal nőtt, a 9. és 14. nap között pedig 35% – kal nőtt a keresztmetszeti terület (1. ábra). Ezek az adatok összhangban vannak azzal a hipotézissel, hogy az izmok a hipertrófia során a rost jelentős növekedése előtt szupernumeráris magokat szereznek.

1.ábra. A myonucleit hipertrófia során szerezték be, de az egér atrófiája során nem veszítették el. Micrographs azonos EDL izomrost idővel indukcióját követően hipertrófia (felső sor), majd az ezt követő indukció atrófia (alsó sor). Fluoreszcensen jelölt oligonukleotidokat használtak a magok in vivo megjelenítéséhez. A szaggatott vonalak a sarcolemma-t képviselik. Skála bar = 50 µm. (Kiigazított Bruusgaard et al., 2010. A Nemzeti Tudományos Akadémia eljárásának engedélyével használják.)
ezután megvizsgálták ezeknek az egyedülállóan azonosítható myonukleáknak a sorsát ugyanazon izomrostokban, amikor atrófiára indukálták őket. A denerváció az izomrost térfogatának körülbelül 50% – os csökkenéséhez vezetett, de a myonuclei nem veszítette el (1. ábra; Bruusgaard et al., 2010). A figyelmen kívül hagyása-a nukleáris veszteség nem is volt köszönhető, hogy a atrophiás inger óta nyert ugyanazt az eredményt, amikor az izmok volt okozta, hogy sorvadás válaszul tetrodotoxin által kiváltott ideg-blokád, hindlimb felfüggesztés, rák cachexia, vagy detraining (Bruusgaard, valamint Gundersen, 2008; Bruusgaard et al., 2010; Winje et al., 2018A). Valójában tanulmányaik során több mint 200 000 egyedi myonucleit vizsgáltak atrófiás izmokban, és csak 4 TUNEL-pozitív (apoptotikus) magot figyeltek meg, ami a magok mindössze ~0, 002% – ának elvesztését jelenti (Bruusgaard et al., 2012). Ezek az adatok erősen alátámasztják azt a hipotézist, hogy a vázizom atrófiáját nem kíséri myonukleáris halál.
Rovarizom mint modell
olyan erős, mint ezek a vizsgálatok, vannak bizonyos korlátozások, amelyek az emlős modellek használatával járnak. Először is mindig olyan kísérleti beavatkozásokra támaszkodnak, mint például a denerváció az izom atrófia kiváltására. Másodszor, az ellenoldali izomot általában belső kontrollként használják, annak ellenére, hogy ugyanazoknak a környezeti jeleknek is ki van téve, mint például a stresszhormonok (Bonaldo and Sandri, 2013). Végül, a vázizmok a fejlődés során programozott sejthalálon (PCD) is áteshetnek, és ezek a modellek ritkán foglalkoznak az apoptózis szerepével ezekben a sejtekben.
egy alternatív modell, amely nem szenved ezen korlátozások egyikétől sem, és lehetővé teszi az izommagok vizsgálatát mind az atrófia, mind a természetben előforduló PCD során, a dohány hawkmoth Manduca sexta interszegmentális izomja (ISM). Az izmusok óriás izomrostokból álló lapokból állnak, ahol minden sejt körülbelül 5 mm hosszú, legfeljebb 1 mm átmérőjű (2a ábra). Az izmusok a hason belüli szegmentális határokhoz kapcsolódnak, és mind a lárvák mászó viselkedését, mind a felnőtt lepke eclosion (megjelenése) viselkedését generálják, amikor a metamorfózis végén kiszabadul a pupalis kutikulából.
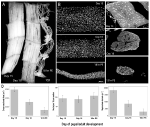
2.ábra. A myonuclei megtartása mind az atrófia, mind az intersegmentális izmok (izmusok) halála során a moly Manduca sexta-ból. A) A fejlődés három szakaszából származó izmusok: homeosztatikus (a pupal-felnőtt fejlődés 15. napja; balra); atrófiás (18. nap; középső); és haldoklik (18 óra post-eclosion; jobbra). Scale bar egyenlő ~1 mm (adaptált Schwartz et al., 2016). B) ugyanabból a fejlődési szakaszból származó Izmusokat a dapi atomfestékkel megtisztították és megfestették, majd konfokális mikroszkópiával láthatóvá tették (Schwartz et al., 2016). C) az ISM szálszakaszokat (10 µm) a dapi nukleáris festékkel festették. Vegye figyelembe az izomfehérje (világosszürke terület) drámai elvesztését az atrófia és a halál során, de a magok megtartását minden szakaszban (Schwartz et al., 2016). D) az ISM szál térfogatának (balra), a nukleáris számnak (középen) és a myonukleáris tartomány méretének (jobbra) a homeosztázis, az atrófia és a halál során történő mennyiségi meghatározása. (Átlagos ± standard hiba.) (A Schwartz et al., 2016).
a normál 18 napos pupal-felnőtt fejlődés 15. napján az ISMs hormonálisan kiváltott atrófiás programot indít, amely 3 nappal később az eclosion idején 40% – os tömegveszteséget eredményez (2a ábra; Schwartz and Truman, 1983). Ez a drámai izomtömeg-veszteség megegyezik a szarkopéniában szenvedő 80 éves egyéneknél tapasztaltakkal, de 30 év helyett több mint 3 napig tart. Miközben az izmusok tömegüket vesztik, megtartják a normális élettani tulajdonságokat, mint például a nyugalmi potenciál és az erő / keresztmetszeti terület (Schwartz and Ruff, 2002). Az ISMs-t az eclosion viselkedésének generálására használják a 18. nap végén, majd kezdeményezik a PCD-t, mindkettőt peptidhormon váltja ki (Schwartz and Truman, 1982, 1983). .
az emlős izmokkal ellentétben az izmusok nem tartalmaznak kapillárisokat, műholdas sejteket, endothelialis sejteket vagy perikitákat, ami azt jelenti, hogy gyakorlatilag az összes sejtmag a szövetben az izomrostokon belül helyezkedik el (Beaulaton and Lockshin, 1977). Két független módszert alkalmaztunk a nukleáris sors nyomon követésére mind az atrófia, mind a halál során ebben a modellben (Schwartz et al., 2016). Az első egy szabványos anatómiai megközelítés volt. Amikor az izmusok sorvadáson és halálon mennek keresztül, drámai csökkenés tapasztalható mind a szálak térfogatában, mind keresztmetszetében, de súlyosan, a nukleáris szám változatlan volt (2b ábra). A szekcionált szövetek kvantitatív vizsgálatok során azt találtuk, hogy az atrófia során ~49%-kal csökkent a rost keresztmetszeti területe, és további 30% – kal csökkent a halál korai szakaszában (2C,D ábra; Schwartz et al., 2016). A magok száma azonban ebben az időszakban nem változott, ami azt jelenti, hogy funkcionálisan 84% – kal csökkent a myonucleáris domain.
A második módszerrel alkalmazott volt, hogy az intézkedés a DNS-tartalom az egyes izomrostok állatokból napján, 13-án, amikor az izmok homeosztatikus, amíg a 18 óra utáni eclosion, amikor az izmok erősen degenerált (Schwartz et al., 2016). Számszerűsítettük 420 egyedi sejt DNS-tartalmát, és megállapítottuk, hogy a fejlődés során nem volt jelentős veszteség. Ezek a biokémiai elemzések jól megegyeznek az anatómiai adatokkal, és arra utalnak, hogy mind a magok, mind a genomikus DNS relatív koncentrációja funkcionálisan megnőtt, amikor az izmok elsorvadtak és meghaltak. Következésképpen mind az egerek, mind a lepkék adatai azt sugallják, hogy az izommagok nem apoptózison mennek keresztül az atrófia (vagy PCD) során, és arra a következtetésre jutnak, hogy a myonukleáris domain hipotézist el kell utasítani.
következtetések
ezek a megfigyelések számos hatással vannak mind az izom alapvető biológiájának megértésére, mind a lehetséges terápiás beavatkozások kifejlesztésére. Bár jelentős adatok jelentik az apoptotikus magok jelenlétét a szövetben az atrófiás sértéseket követően, a legfrissebb adatok azt sugallják, hogy ezek nem igaz myonucleusok, hanem inkább elítélték az izomroston kívüli mononukleáris sejteket. Ennek az eltérésnek az elsődleges oka az, hogy az apoptózis kimutatására használt hagyományos eszközök nem rendelkeznek a szükséges felbontással annak megfelelő meghatározásához, hogy a szarkolemma melyik oldala található haldokló sejtben. Módszerek, amelyek kifejezetten a myonucleit címkézik, vagy fluoreszcens festékek in vivo injekcióival (Bruusgaard and Gundersen, 2008), vagy genetikai manipulációkkal marker fehérjék kifejezésére (Duddy et al., 2011), felfedi néhány, ha bármilyen apoptotikus magok belül jelzett szálak. A közelmúltban bebizonyosodott, hogy a protein Pericentriolar Material 1 (PCM1) címke elleni antitestek csak az autentikus myonuclei ígéretes eszközt kínál, amely alkalmazható a hagyományos szövettani anyagokra, amelyeket rutinszerűen elemeznek a területen (Winje et al., 2018b).
a vázizmok azon kudarca, hogy apoptózist alkalmazzanak a myonuclei kiküszöbölésének mechanizmusaként, nem meglepő. Úgy tűnik, hogy az érett vázizom nagyrészt kizárja az apoptózis kezdeményezését abban az esetben, ha felszabályozza a hatékony túlélési fehérjék expresszióját, mint például az apoptózis fehérje X-linked inhibitora (XIAP) (Smith et al., 2009) és az apoptózis represszor a caspase recruitment domainnel (ARC) (Xiao et al., 2011), miközben egyidejűleg kifejezi az apoptózis mediátorok alacsony szintjét, mint például az apoptotikus proteáz aktiváló faktor 1 (Apaf-1) (Burgess et al., 1999). Ennek van értelme teleologically óta izmok vannak kitéve extrém zavarok, beleértve a zavar a sarcolemma következő intenzív testmozgás, olyan katasztrofális lenne, ha kiváltott sejthalál inkább, mint kezdeményezett szövet javítás, esetleg hipertrófia. Más terminálisan differenciált sejtekhez hasonlóan az izmok általában nem apoptotikus mechanizmusokat alkalmaznak, leginkább autofágikus PCD-t (más néven II. típusú degeneráció) (Clarke, 1990; Schwartz et al., 1993; Kole et al., 2013; Ginet et al., 2014), amikor a fejlesztés során meghalnak.
még akkor is, ha volt olyan mechanizmus, amellyel az izmok szelektíven célozhatják az egyes magokat, nem világos, hogy ez előnyös lenne. Valójában a” többlet ” magok megtartása az atrófia során külön előnyt jelent az egyén számára, mivel a vázizmok gyakran atrófiás és hipertrófiás ciklusokon mennek keresztül olyan környezeti feltételek mellett, mint például az élelmiszerek rendelkezésre állása. Az a képesség, hogy gyorsan felépüljön a már meglévő myonuclei felhasználásával, fontos szerepet játszhat az alkalmazkodásban (Jackson et al., 2012) segít megmagyarázni az “izommemória” jelenségét (Staron et al., 1991; Gundersen, 2016). A testmozgás fiziológiája területén jól dokumentált, hogy sokkal könnyebb az izom-fitnesz bizonyos szintjét a testmozgással újra megszerezni, mint az első helyen elérni, még akkor is, ha hosszú beavatkozási időszak volt a detraining. Más szóval, a “Használd vagy veszítsd el” kifejezést lehet pontosabban megfogalmazni, mint “használd vagy veszítsd el, amíg újra nem dolgozol rajta.”Ezt közvetlenül a Gundersen laboratórium egy másik kísérlete bizonyította, amely kimutatta, hogy ha egy izom új magokat szerzett, akkor a hipertrófiás inger eltávolítása után hosszú ideig megtartja őket. Női egerekben izom hipertrófiát váltottak ki azáltal, hogy 2 hétig tesztoszteronnal kezelték őket, majd 3 héttel a szteroid visszavonása után megvizsgálták az izmokat (Egner et al., 2013). Az izomtérfogat visszatért a kiindulási szintre, de az újonnan megszerzett magok még 3 hónappal később is fennmaradtak. Amikor a izmai voltak kitéve a túlterhelést, hogy újra akarja indítani túltengés, a szteroid-kezelést is gyorsan ment a 36% – os növekedés a rost mennyisége, míg a kontroll izmok csak 6% – kal nőtt. Ezek az adatok arra utalnak, hogy a” többlet ” magok gyorsan mobilizálhatók az átképzés megkönnyítése érdekében.
ezek a megfigyelések potenciális hatással vannak a közegészségügyi politikára. Kimutatták, hogy az izomnövekedés, a fiziológiai funkció és a regeneratív kapacitás mind az életkorral csökken, nagyrészt a műholdas sejtek proliferációjának csökkenése miatt (Blau et al., 2015). Következésképpen, a testmozgás serdülőkorban, amikor az izomnövekedést fokozza a hormonok, a táplálkozás és a robusztus műholdas medence, funkcionálisan szolgálhat, hogy az egyének, hogy “bank” myonuclei, hogy lehet levonni az élet későbbi szakaszában, hogy lassítja az öregedés hatásait, és esetleg megelőzi szarkopénia.
Ezen túlmenően ezeknek az adatoknak következményei vannak a versenysport területén. Az anabolikus szteroidok használata egy erős inger izom hipertrófia, valamint az új myonuclei (Egner et al., 2013). Mivel ezek a magok hosszú ideig fennmaradnak a szteroid használat befejezése után, a sportolók valószínűleg az illegális kábítószer-használat előnyeit élvezik az észlelés kockázata nélkül.
összefoglalva, míg az új magok izomnövekedéssel történő hozzáadása nagyrészt elfogadott, az atrófiás magok apoptotikus vesztesége nem támogatható, ami arra utal, hogy a myonuclearis domain hipotézis szigorú értelmezése nem támogatható. Ehelyett úgy tűnik, hogy miután megszerezte, a myonuclei akkor is fennmarad, ha az izom atrófiás lesz, vagy sejthalált kezdeményez.
szerzői hozzájárulások
a szerző megerősíti, hogy egyedüli közreműködője ennek a műnek, és jóváhagyta a közzétételre.
finanszírozás
a kiadványhoz kapcsolódó munkát az Eugene M. és Ronnie Isenberg professzori Alapítvány pénzeszközei támogatták. A szerzőnek nem nyújtottak vállalati támogatást, kereskedelmi termékeket nem említettek vagy hagytak jóvá.
összeférhetetlenségi nyilatkozat
a szerző kijelenti, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségnek tekinthetők.
elismerések
a szerző köszönetet mond Christine Brown asszonynak a kézirat elkészítésében nyújtott segítségért, valamint az Eugene M. és Ronnie Isenberg professzori Alapítvány támogatásért.
Aagaard, P. (2004). Az izmok “erősebbé” tétele: testmozgás, táplálkozás, gyógyszerek. J. Musculoskelet. Neuronális. Interact. 4, 165–174.
P > PubMed Abstract / Google Scholar
Abreu, P., Mendes, S. V., Ceccatto, V. M., and Hirabara, S. M. (2017). Az aerob izom-adaptáció által kiváltott műholdas sejtaktiválás az embereken és rágcsálókon végzett állóképességi gyakorlatra adott válaszként. Élet Sci. 170, 33–40. doi: 10.1016 / j.lfs.2016.11.016
P>PubMed Abstract | CrossRef Full Text | Google Scholar
Ali, S., and Garcia, J. M. (2014). Szarkopénia, cachexia és öregedés: diagnózis, mechanizmusok és terápiás lehetőségek-egy mini-felülvizsgálat. Gerontológia 60, 294-305. doi: 10.1159 / 000356760
P > PubMed Abstract / CrossRef Full Text / Google Scholar
Alway, S. E., Martyn, J. K., Ouyang, J., Chaudhrai, A., and Murlasits, Z. S. (2003). Id2 expression during apoptosis and satellite cell activation in unloaded and loaded quail skeletal muscles. Am. J. Physiol. Regul. Integr. Comp. Physiol. 284, R540–R549. doi: 10.1152/ajpregu.00550.2002
PubMed Abstract | CrossRef Full Text | Google Scholar
Andrianjafiniony, T., Dupre-Aucouturier, S., Letexier, D., Couchoux, H., and Desplanches, D. (2010). Oxidative stress, apoptosis, and proteolysis in skeletal muscle repair after unloading. Am. J. Phys. Cell Physiol. 299, C307–C315. doi: 10.1152/ajpcell.00069.2010
P > PubMed Abstract / CrossRef teljes szöveg | Google Scholar
Aravamudan, B., Mantilla, C. B., Zhan, W. Z., and Sieck, G. C. (2006). Denervációs hatások a patkány membránszálak myonukleáris tartományméretére. J. Appl. Physiol. 100, 1617–1622. doi: 10.1152 / japplphysiol.01277.2005
CrossRef teljes szöveg | Google Scholar
Bachman, J. F., Klose, A., Liu, W., Párizs, N. D., Blanc, R. S., Schmalz, M., et al. (2018). A prepubertális vázizomnövekedés Pax 7-expresszáló műholdas sejtből származó myonuclearis hozzájárulást igényel. Fejlesztés 145:167197.
Google Scholar
Barnes, B. T., Confides, A. L., Rich, M. M., and Dupont-Versteegden, E. E. (2015). Különböző izom apoptotikus utak aktiválódnak az izmokban különböző rost típusú patkány modell kritikus betegség myopathia. J. Muscle Res. Sejt Motil. 36, 243–253. doi: 10.1007 / s10974-015-9410-8
PubMed Abstract | CrossRef Full Text/Google Scholar
Beaulaton, J., and Lockshin, R. A. (1977). Ultrastrukturális vizsgálat az Anthereae polyphemus és Manduca sexta (insecta, lepidoptera) interszegmentális izmainak normális degenerációjáról, különös tekintettel a sejtes autofágiára. J. Morphol. 154, 39–57. doi: 10.1002 / jmor.1051540104
P > PubMed Abstract / CrossRef teljes szöveg / Google Scholar
Bentzinger, C. F., von Maltzahn, J., Dumont, N. A., Stark, D. A., Wang, Y. X., Nhan, K., et al. (2014). A Wnt 7a serkenti a myogén őssejt-motilitást és a beolvadást, ami jobb izomerőt eredményez. J. Cell Biol. 205, 97–111. doi: 10.1083 / jcb.201310035
P > PubMed Abstract / CrossRef teljes szöveg | Google Scholar
Blau, H. M., Cosgrove, B. D., and Ho, A. T. (2015). Az izom őssejtek központi szerepe az öregedéssel járó regeneratív kudarcban. Nat. Med. 21, 854–862. doi: 10.1038 / nm.3918
P > PubMed Abstract / CrossRef Full Text / Google Scholar
Bonaldo, P., and Sandri, M. (2013). Az izomsorvadás sejtes és molekuláris mechanizmusai. Dis. Modell. Mech. 6, 25–39. doi: 10.1242 / dmm.010389
CrossRef Full Text / Google Scholar
Brack, A. S., and Rando, T. A. (2012). Szövet-specifikus őssejtek: tanulságok a vázizom műholdas sejt. Sejt Őssejt 10, 504-514. doi: 10.1016 / j. stem.2012.04.001
P>PubMed Abstract | CrossRef Full Text | Google Scholar
Bruusgaard, J. C., Egner, I. M., Larsen, T. K., Dupre-Aucouturier, S., Desplanches, D., and Gundersen, K. (2012). A myonukleáris szám nem változik az izom kirakodása és újratöltése során. J. Appl. Physiol. 113, 290–296. doi: 10.1152 / japplphysiol.00436.2012
P> PubMed Abstract | CrossRef Full Text | Google Scholar
Bruusgaard, J. C., and Gundersen, K. (2008). Az in vivo time-lapse mikroszkópos vizsgálat azt mutatja, hogy a Murin myonuclei nem veszítette el az izom atrófia heteit. J. Clin. Befektetni. 118, 1450–1457. doi: 10.1172/JCI34022
P>PubMed Abstract | CrossRef teljes szöveg | Google Scholar
Bruusgaard, J. C., Johansen, I. B., Egner, I. M., Rana, Z. A., and Gundersen, K. (2010). A túlterheléssel szerzett Myonuclei megelőzi a hipertrófiát, és nem vész el a detraining során. Proc. NAT. Acad. Sci. U. S. A. 107, 15111-15116. doi: 10.1073 / pnas.0913935107
CrossRef teljes szöveg | Google Scholar
Bruusgaard, J. C., Liestol, K., Ekmark, M., Kollstad, K., and Gundersen, K. (2003). Az in vivo vizsgált normál egerek izomrostjaiban a magok száma és térbeli eloszlása. J. Physiol. 551, 467–478. doi: 10.1113 / jphysiol.2003.045328
P > PubMed Abstract / CrossRef teljes szöveg / Google Scholar
Burgess, D. H., Svensson, M., Dandrea, T., Gronlund, K., Hammarquist, F., Orrenius, S., et al. (1999). A humán vázizom citoszolok nem reagálnak a II. típusú kaszpázok citokróm C-függő aktivációjára, és hiányzik az APAF-1. A Sejthalál Különbözik. 6, 256–261. doi: 10.1038 / sj.cdd.4400489
P > PubMed Abstract / CrossRef Full Text / Google Scholar
Cabric, M., and James, N. T. (1983). Morphometric analyses on the musces of exercise trained and untrained dogs. Am. J. Anat. 166, 359–368. doi: 10.1002 / aja.1001660309
P > PubMed Abstract / CrossRef teljes szöveg / Google Scholar
Cheema, N., Herbst, A., McKenzie, D., and Aiken, J. M. (2015). Az apoptózis és a nekrózis a vázizomrost-veszteséget közvetíti az életkor által kiváltott mitokondriális enzimatikus rendellenességekben. Öregedő Sejt 14, 1085-1093. doi: 10.1111 / acel.12399
P>PubMed Abstract / CrossRef Full Text / Google Scholar
Clarke, P. G. (1990). Fejlődési sejthalál: morfológiai sokféleség és több mechanizmus. Anat. Embriol. 181, 195–213.
Google Scholar
Cohen, S., Nathan, J. A., and Goldberg, A. L. (2015). Izomsorvadás a betegségben: molekuláris mechanizmusok és ígéretes terápiák. Nat. Rev. Drog Discov. 14, 58–74. doi: 10.1038/nrd4467
P>PubMed Abstract | CrossRef teljes szöveg | Google Scholar
Duddy, W. J., Cohen, T., Duguez, S., and Partridge, T. A. (2011). Az izolált izomrost, mint a disuse atrophia modellje: a PhAct jellemzése, Az f-aktin mennyiségi meghatározására szolgáló módszer. Felh. Cell Res. 317, 1979-1993. doi: 10.1016 / j. yexcr.2011.05.013
P > PubMed Abstract / CrossRef Full Text / Google Scholar
Dumont, N. A., Wang, Y. X., and Rudnicki, M. A. (2015). A műholdas sejt működését szabályozó belső és külső mechanizmusok. Fejlesztés 142, 1572-1581. doi: 10.1242 / dev.114223
P > PubMed Abstract / CrossRef Full Text / Google Scholar
Egner, I. M., Bruusgaard, J. C., Eftestol, E., and Gundersen, K. (2013). A celluláris memória mechanizmus segíti túlterhelés hypertrophia izom hosszú után epizodikus expozíció anabolikus szteroidok. J. Physiol. 591, 6221–6230. doi: 10.1113 / jphysiol.2013.264457
P>PubMed Abstract | CrossRef Full Text | Google Scholar
Egner, I. M., Bruusgaard, J. C., and Gundersen, K. (2016). A műholdas sejtek kimerülése megakadályozza a rost hipertrófiáját a vázizomban. Fejlesztés 143, 2898-2906. doi: 10.1242 / dev.134411
P > PubMed Abstract / CrossRef Full Text / Google Scholar
Fitts, R. H., Metzger, J. M., Riley, D. A., and Unsworth, B. R. (1986). A használaton kívüli modellek: a hátsó felfüggesztés és az immobilizáció összehasonlítása. J. Appl. Physiol. 60, 1946–1953.
Google Scholar
Ginet, V., Pittet, M. P., Rummel, C., Osterheld, M. C., Meuli, R., Clarke, P. G., et al. (2014). Az asphyxiated term újszülötteknél és patkányoknál a thalamusban haldokló neuronok autofágikusak. Ann. Neurol. 76, 695–711. doi: 10.1002 / ana.24257
P > PubMed Abstract / CrossRef teljes szöveg | Google Scholar
Goh, Q., and Millay, D. P. (2017). A myomaker által közvetített őssejtfúzió követelménye a vázizom hipertrófia esetén. elife 6. doi: 10.7554 / eLife.20007
P > PubMed Abstract / CrossRef Full Text / Google Scholar
Gregory, T. R. (2001). Véletlen, koevolúció vagy okozati összefüggés? DNS-tartalom, sejtméret és a C-értékű enigma. Biol. Camb Tiszteletes. Philos. Soc. 76, 65–101. doi: 10.1017 / s1464793100005595
PubMed Abstract / CrossRef teljes szöveg / Google Scholar
Guerci, A., Lahoute, C., Hebrard, S., Collard, L., Graindorge, D., Favier, M., et al. (2012). A myofibers által termelt Srf-függő parakrin jelek szabályozzák a műholdas sejt által közvetített vázizom-hipertrófiát. Cell Metab. 15, 25–37. doi: 10.1016 / j. cmet.2011.12.001
P> PubMed Abstract | CrossRef teljes szöveg | Google Scholar
Gundersen, K. (2016). Izommemória és az izomsorvadás és hipertrófia új sejtmodellje. J. Exp. Biol. 219, 235–242. doi: 10.1242 / jeb.124495
P > PubMed Abstract / CrossRef Full Text / Google Scholar
Gundersen, K., and Bruusgaard, J. C. (2008). Nukleáris domének az izom atrófia során: elveszített magok vagy paradigma Elveszett? J. Physiol. 586, 2675–2681. doi: 10.1113 / jphysiol.2008.154369
P>PubMed Abstract | CrossRef Full Text | Google Scholar
Guo, B. S., Cheung, K. K., Yeung, S. S., Zhang, B. T., and Yeung, E. W. (2012). Az elektromos stimuláció befolyásolja a műholdas sejtek proliferációját és az apoptózist a kirakodás által kiváltott izom atrófiában egerekben. PLoS One 7: e30348. doi: 10.1371 / folyóirat.pone.0053523
P > PubMed Abstract / CrossRef teljes szöveg | Google Scholar
Jackson, J. R., Mula, J., Kirby, T. J., Fry, C. S., Lee, J. D., Ubele, M. F., et al. (2012). A műholdas sejtek kimerülése nem gátolja a felnőtt vázizom újbóli növekedését a kirakodás által kiváltott atrófia után. Am. J. Phys. Sejtfiziol. 303, C854-C861. doi: 10.1152 / ajpcell.00207.2012
P> PubMed Abstract | CrossRef teljes szöveg | Google Scholar
Joubert, Y., and Tobin, C. (1995). A tesztoszteron kezelés azt eredményezi, hogy a nyugalmi műholdas sejtek aktiválódnak és a patkány levator ani izom sejtciklusába kerülnek. Dev. Biol. 169, 286–294. doi: 10.1006 / dbio.1995.1144
P> PubMed Abstract | CrossRef teljes szöveg | Google Scholar
Katz, B. (1961). Az afferens idegrost végzése a béka izomorsójában. Philos. Trans. R. Soc. Lond. B Biol. Sci. 243, 221–240.
P > PubMed Abstract / Google Scholar
Kletzien, H., Hare, A. J., Leverson, G., and Connor, N. P. (2018). A sejthalál korral összefüggő hatása a rost morfológiájára és a nyelv izomzatának számára. Izomideg 57, E29-E37. doi: 10.1002 / mus.25671
P > PubMed Abstract / CrossRef Full Text / Google Scholar
Kole, A. J., Annis, R. P., and Deshmukh, M. (2013). Érett neuronok: túlélésre felszerelve. Sejthalál. 4:e689. doi: 10.1038 / cddis.2013.220
P> PubMed Abstract | CrossRef teljes szöveg/Google Scholar
Li, T. S., Shi, H., Wang, L., and Yan, C. (2016). A csontvelő mesenchymalis őssejtjeinek hatása a műholdas sejtproliferációra és apoptózisra az immobilizáció által kiváltott izom atrófiában patkányokban. Med. Sci. Monit. 22, 4651–4660. doi: 10.12659 / MSM.898137
P > PubMed Abstract / CrossRef Full Text / Google Scholar
Lockshin, R. A., and Williams, C. M. (1965). Programozott sejthalál-I. a degeneráció citológiája a Pernyi silkmoth interszegmentális izmaiban. J. Rovar Physiol. 11, 123–133. doi: 10.1016/0022-1910(65)90099-5
PubMed Abstract / CrossRef Full Text / Google Scholar
Longtine, M. S., Barton, A., Chen, B., and Nelson, D. M. (2012). Az élő sejtes képalkotás azt mutatja, hogy az apoptózis lokálisan indul, és hullámként terjed a syncytiotrophoblastokban az emberi placenta villous trofoblasztok elsődleges kultúráiban. Placenta 33, 971-976. doi: 10.1016 / j.placenta.2012.09.013 P>PubMed Abstract | CrossRef Full Text/Google Scholar
Mauro, A. (1961). A vázizomrostok műholdas sejtje. J. Biophys. Biochem. Cytol. 9, 493–495.
Google Scholar
Mayhew, T. M., Leach, L., McGee, R., Ismail, W. W., Myklebust, R., and Lammiman, M. J. (1999). Proliferáció, differenciálódás és apoptózis villous trofoblasztban a terhesség 13-41. hetében (beleértve az annulátum lamellákra és a nukleáris póruskomplexekre vonatkozó megfigyeléseket). Placenta 20, 407-422. doi: 10.1053 / plac.1999.0399.
PubMed Abstract / CrossRef Full Text / Google Scholar
McCall, G. E., Allen, D. L., Linderman, J. K., Grindeland, R. E., Roy, R. R. R., Mukku, V. R., et al. (1998). A myonuclearis doménméret fenntartása patkány soleusban túlterhelés és növekedési hormon/IGF-I kezelés után. J. Appl. Physiol. 84, 1407–1412.
Google Scholar
McClung, J. M., Kavazis, A. N., DeRuisseau, K. C., Falk, D. J., Deering, M. A., Lee, Y., et al. (2007). Kaszpáz-3 a membrán myonukleáris tartomány szabályozása a mechanikus szellőztetés által kiváltott atrófia során. Am. J. Respir. Crit. Care Med. 175, 150–159. doi: 10.1164 / rccm.200601 – 142oc
P > PubMed Abstract | CrossRef teljes szöveg | Google Scholar
Metter, E. J., Talbot, L. A., Schrager, M., és Conwit, R. (2002). A vázizom erőssége az egészséges férfiak minden okozta mortalitásának előrejelzőjeként. J. Gerontol. Egy Biol. Sci. Med. Sci. 57, B359-B365. doi: 10.1093 / gerona / 57.10.B359
P > PubMed Abstract / CrossRef Full Text / Google Scholar
Minnaard, R., Drost, M. R., Wagenmakers, A. J., van Kranenburg, G. P., Kuipers, H., and Hesselink, M. K. (2005). Csontvázizom-pazarlás és kontraktilis teljesítmény szeptikus patkányokban. Izom Ideg 31, 339-348. doi: 10.1002 / mus.20268
P > PubMed Abstract / CrossRef teljes szöveg | Google Scholar
Moss, F. P. (1968). A szálak mérete és a magok száma közötti összefüggés a hazai szárnyasok vázizomzatának normális növekedése során. Am. J. Anat. 122, 555–563. doi: 10.1002 / aja.1001220308 P>PubMed Abstract | CrossRef Full Text/Google Scholar
Murach, K. A., Englund, D. A., Dupont-Versteegden, E. E., McCarthy, J., and Peterson, C. A. (2018). Myonuclear domain rugalmasság kihívások merev feltételezések műholdas sejtek hozzájárulását vázizom szál hipertrófia. Elöl. Physiol. 9:635. doi: 10.3389 / fphys.2018.00635
CrossRef Full Text / Google Scholar
Nevalainen, M., Kaakinen, M., and Metsikko, K. (2013). Az mRNS átiratok és fordítási aktivitás megoszlása a csontváz myofiberekben. Sejtszövet Res. 353, 539-548. doi: 10.1007 / s00441-013-1659-x
P > PubMed Abstract / CrossRef teljes szöveg / Google Scholar
O ‘ Leary, M. F., Vainshtein, A., Carter, H. N., Zhang, Y., and Hood, D. A. (2012). Denerváció által kiváltott mitokondriális diszfunkció és autofágia az apoptózis-hiányos állatok vázizomzatában. Am. J. Phys. Sejtfiziol. 303, C447-C454. doi: 10.1152/ajpcell.00451.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
Palumbo, C., Rovesta, C., and Ferretti, M. (2012). Striated muscle fiber apoptosis after experimental tendon lesion in a rat model. J. Anat. 221, 358–363. doi: 10.1111/j.1469-7580.2012.01554.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Qaisar, R., and Larsson, L. (2014). What determines myonuclear domain size? Indian J. Physiol. Pharmacol. 58, 1–12.
PubMed Abstract | Google Scholar
Ross, J. A., Levy, Y., Svensson, K., Philp, A., Schenk, S., and Ochala, J. (2018). A SIRT1 szabályozza a vázizomrostok nukleáris számát és doménméretét. J. Cell. Physiol. 233, 7157–7163. doi: 10.1002 / jcp.26542
P > PubMed Abstract / CrossRef Full Text / Google Scholar
Schiaffino, S., Dyar, K. A., Ciciliots, S., Blaauw, B., and Sandri, M. (2013). Szabályozó mechanizmusok vázizom növekedés és sorvadás. FEBS J. 280, 4294-4314. doi: 10.1111 / febs.12253
P > PubMed Abstract / CrossRef Full Text / Google Scholar
Schmalbruch, H., and Hellhammer, U. (1977). A felnőtt patkányizmok magjainak száma, különös tekintettel a műholdas sejtekre. Anat. Rec. 189, 169–175. doi: 10.1002 / ar.1091890204 P>PubMed Abstract | CrossRef teljes szöveg/Google Scholar
Schwartz, L. M. (2008). Sorvadás és a vázizomzat sejthalála. A Sejthalál Különbözik. 15, 1163–1169. doi: 10.1038 / cdd.2008.68 P>PubMed Abstract | CrossRef Full Text/Google Scholar
Schwartz, L. M., Brown, C., McLaughlin, K., Smith, W., and Bigelow, C. (2016). A myonukleáris domén nem marad fenn a vázizomban sem atrófia, sem programozott sejthalál során. Am. J. Phys. Sejtfiziol. 311, C607-C615. doi: 10.1152 / ajpcell.00176.2016
P> PubMed Abstract | CrossRef teljes szöveg | Google Scholar
Schwartz, L. M., and Ruff, R. L. (2002). Változások a vázizom összehúzódó tulajdonságaiban a fejlődési programozott atrófia és halál során. Am. J. Phys. Sejtfiziol. 282, C1270-C1277. doi: 10.1152 / ajpcell.01275.2000
CrossRef teljes szöveg | Google Scholar
Schwartz, L. M., Smith, S. W., Jones, M. E., és Osborne, B. A. (1993). Az összes programozott sejthalál apoptózison keresztül történik? Proc. NAT. Acad. Sci. U. S. A. 90, 980-984.
Google Scholar
Schwartz, L. M., and Truman, J. W. (1983). Hormonális szabályozás aránya metamorf fejlődés a dohány hornworm Manduca sexta. Dev. Biol. 99, 103–114. doi: 10.1016/0012-1606(83)90257-9
PubMed Abstract / CrossRef Full Text / Google Scholar
Schwartz, L. M., and Truman, J. W. (1982). Peptid és szteroid szabályozás izom degeneráció egy rovar. Tudomány 215, 1420-1421. doi: 10.1126 / tudomány.6278594 P>PubMed Abstract | CrossRef Full Text/Google Scholar
Smith, H. K., Maxwell, L., Martyn, J. A., And Bass, J. J. (2000). Nukleáris DNS fragmentáció és morfológiai változások a felnőtt nyúl vázizmában rövid távú immobilizáció után. Sejtszövet Res. 302, 235-241. doi: 10.1007 / s004410000280
P > PubMed Abstract / CrossRef teljes szöveg / Google Scholar
Smith, M. I., Huang, Y. Y., and Deshmukh, M. (2009). A vázizom differenciálódása endogén XIAP-ot idéz elő az apoptotikus út korlátozására. PLoS One 4: e5097. doi: 10.1371 / folyóirat.pone.0005097
CrossRef Full Text / Google Scholar
Staron, R. S., Leonardi, M. J., Karapondo, D. L., Malicky, E. S., Falkel, J. E., Hagerman, F. C., et al. (1991). Az erőkifejtés és a vázizom-alkalmazkodás nehézrezisztencia-kiképzett nőknél a detraining és átképzés után. J. Appl. Physiol. 70, 631-640.
Google Scholar
Strassburger, E. (1893). A sejtmagok működési területe és a sejtméret. Histol Beitr. 5, 97-124.
Google Scholar
Strasser, H., Tiefenthaler, M., Steinlechner, M., Eder, I., Bartsch, G. és Konwalinka, G. (2000). Korfüggő apoptózis és rhabdosphincter sejtek elvesztése. J. Urol. 164, 1781–1785. doi: 10.1016/S0022-5347(05)67106-6
P> PubMed Abstract | CrossRef teljes szöveg | Google Scholar
Tedesco, F. S., Dellavalle, A., Diaz-Manera, J., Messina, G., and Cossu, G. (2010). A vázizom javítása: a vázizom őssejtek regeneratív potenciálja. J. Clin. Befektetni. 120, 11–19. doi: 10.1172 / JCI40373
P > PubMed Abstract / CrossRef teljes szöveg | Google Scholar
Wada, K. I., Takahashi, H., Katsuta, S., and Soya, H. (2002). Érett egerekben a hosszú távú denerváció után nem csökken a myonukleáris szám. Am. J. Phys. Sejtfiziol. 283, C484-C488. doi: 10.1152 / ajpcell.00025.2002
CrossRef teljes szöveg | Google Scholar
Winje, I. M., Sheng, X., Hansson, K. A., Solbrå, A., Tennøe, S., Saatcioglu, F., et al. (2018a). A Cachexia egerekben nem indukálja a myonuclei vagy az izomrostok elvesztését a xenografált prosztatarák során. Acta Physiol. e13204. doi: 10.1111 / apha.13204
CrossRef Full Text / Google Scholar
Winje, I. M., Bengtsen, M., Eftestol, E., Juvkam, I., Bruusgaard, J. C. és Gundersen, K. (2018b). A myonuclei specifikus címkézése a pericentriolar 1 anyaggal szembeni antitestekkel a vázizomszövet szakaszokon. Acta Physiol. 223:e13034. doi: 10.1111 / apha.13034
CrossRef teljes szöveg | Google Scholar
Woo, J. (2017). Szarkopénia. Clin. Geriatr. Med. 33, 305–314. doi: 10.1016 / j. cger.2010.02.012
CrossRef Full Text / Google Scholar
Xiao, R., Ferry, A. L., and Dupont-Versteegden, E. E. (2011). A differenciált myotubes sejthalál-rezisztenciája fokozott apoptotikus mechanizmusokkal jár a myoblasztokhoz képest. Apoptózis 16, 221-234. doi: 10.1007 / s10495-010-0566-9
PubMed Abstract | CrossRef Full Text/Google Scholar
Yang, D., Morris, S. F., and Sigurdson, L. (1998). A sartorius izom: anatómiai megfontolások rekonstrukciós sebészek számára. Sugársebész. Anat. 20, 307–310. doi: 10.1007
P > PubMed Abstract / CrossRef teljes szöveg / Google Scholar
Zhong, H., Roy, R. R., Siengthai, B., and Edgerton, V. R. (2005). Az inaktivitás hatása a szál méretére és a myonukleáris számra a patkány soleus izomzatában. J. Appl. Physiol. 99, 1494–1499. doi: 10.1152 / japplphysiol.00394.2005
CrossRef teljes szöveg | Google Scholar
Zhou, X., Wang, J. L., Lu, J., Song, Y., Kwak, K. S., Jiao, Q., et al. (2010). A cachexia és az izomsorvadás Act RIIB antagonizmussal történő visszafordítása tartós túléléshez vezet. 142-es cella, 531-543. doi: 10.1016 / j.cell.2010.07.011
P>PubMed Abstract / CrossRef Full Text / Google Scholar
Ziaaldini, M. M., Marzetti, E., Picca, A., and Murlasits, Z. (2017). A szarkopénia biokémiai útjai és a testmozgással történő modulációjuk: narratív áttekintés. Elöl. Med. 4:167. doi: 10.3389 / fmed.2017.00167
CrossRef teljes szöveg / Google Scholar