A normál sejtmetabolizmus a vér pHwithin nagyon szűk határértékeinek fenntartásától függ (7, 35-7, 45).
Még viszonylag mildexcursions kívül ez a normális pH-tartományban lehet deleteriouseffects, beleértve a csökkent oxigén szállítás szövetek, electrolytedisturbances változik a szívizom összehúzódási képességét; túlélési israre, ha a vér pH-érték alá esik 6.8 vagy fölé emelkedik, a 7.8.
A problemfor a szervezet normális anyagcsere kapcsolódó withcontinuous termelés a hidrogén ion (H+), valamint a szén-dioxid(CO2) is, melyek általában csökkenti a pH-t. A mechanismwhich legyőzi ezt a problémát pedig arra szolgál, hogy fenntartsa vér normális pH(azaz megőrzése sav-bázis homeosztázis) egy komplex szinergia rossz járó vegyi anyag, pufferek, a vér, a vörösvértestek(eritrociták), amely kering a vér, a funkció threeorgans: tüdő, vese, agy.
mielőtt elmagyarázná, hogy ezek az öt elem hogyan járul hozzá a vér pH-jának általános fenntartásához, hasznos lenne néhány alapfogalom gyors áttekintése.
- mi az a sav, mi az a bázis és mi a pH?
- mi a puffer? – a hidrogén-karbonát pufferrendszer
- a tüdőfunkció, a CO2 és a sav-bázis transzportja
- a vesék és a sav-bázis egyensúly
- ZAVAROK, A SAV-BÁZIS EGYENSÚLY
- a sav-bázis zavarok okai
- légzőszervi acidózis – (emelkedett pCO2(a),csökkent pH)
- légzőszervi alkalózis – (reducedpCO2 (a), fokozott pH)
- metabolikus acidózis – (decreasedHCO3 -, csökkent pH)
- metabolikus alkalózis – (megnövekedett HCO3 -, megnövekedett pH)
- kompenzáció – a sav-bázis egyensúly következménye
- vegyes sav-bázis zavarok
- összefoglaló
- néhányan javasolták, hogy folytassák tovább
mi az a sav, mi az a bázis és mi a pH?
egy sav olyan anyag, amely felszabadítjahidrogénionok (H+) a disszociáció oldatban.
például: Sósav (HCl) hidrogénionokra és kloridionokra disszociál
HCl ![]() H+ + Cl-
H+ + Cl-
karbonsav (H2CO3) disszociál a hidrogénionokra és a bikarbonátionokra
H2CO3 ![]() H+ +HCO3–
H+ +HCO3–
megkülönböztetünk olyan erős savakat, mint a sósav ésgyenge savak, mint a szénsav. A különbség az, hogy erős savaktöbb mint gyenge savak. Következésképpen az erős sav hidrogénionkoncentrációja sokkal magasabb,mint a gyengéa sav.
a bázis olyan anyag, amely oldatban elfogadjahidrogénionokat.
például az alap–hidrogén-karbonát (HCO3 -) hidrogénionokat fogad el szénsav előállítására:
HCO3 – + H + ![]() H2CO3
H2CO3
pH a savasság és lúgosság 0-14-es skálája. A tiszta víz pH-ja 7, semleges (sem savas, sem lúgos). pH 7-nél magasabb, lúgos és 7-nél alacsonyabb savas. Így a vér pH-ja (7,35-7,45) enyhén lúgos, bár a klinikai gyógyászatban az alkalosis kifejezés, talán zavarosan, a 7-nél nagyobb vér pH-jára van fenntartva.45és a kifejezés acidózis van fenntartva a vér pH kevesebb, mint 7,35.
a pH a hidrogénion-koncentráció (H+) mértéke.A két kapcsolódó szerint a followingequation:
pH = – log10
hol van az a koncentráció, a hidrogén ionok inmoles / liter (mol/L)
ez az egyenlet
pH 7.4 = H+ koncentráció 40 nmol/L
pH 7.0 = H+ koncentráció 100 nmol/L
pH 6.0 = H+ koncentráció 1000 nmol/L
egyértelmű, hogy:
- a két paraméter változás fordítottan; ahogy a hidrogénion-koncentráció növekszik, a pH
- a logaritmikus kapcsolat miatt a hidrogénion-koncentráció nagy változása valójában a pH kis változása. például a hidrogénion-koncentráció megduplázása miatt a pH csak 0, 3
mi a puffer? – a hidrogén-karbonát pufferrendszer
pufferek olyan oldatban lévő vegyi anyagok, amelyek minimalizálják a pH-értéket, amely akkor fordul elő, amikor savakat adnak hozzá “felmosó” hidrogénionok. A puffer egy gyenge sav oldatakonjugát bázis. A vérben az elv pufferrendszer a gyengeasav, karbonsav (H2CO3) és konjugatebáza, bikarbonát (HCO3–). Hogy magyarázza meg, hogyan rendszer minimálisra csökkenti a változások pH, tegyük fel, hozzá egy erős savas,pl. a HCl, hogy a bikarbonát puffer:
A sav fogja szétválasztani, felszabadító hidrogén-ionok:
HCl ![]() H+ + Cl–
H+ + Cl–
A bikarbonát puffer majd ‘nyel’ a hidrogén ionok, formingcarbonic sav a folyamat:
HCO3 – + H + ![]() H2CO3 (karbonsav)
H2CO3 (karbonsav)
A lényeg az, hogy mivel a Hclh-ből származó hidrogénionokat beépítették a gyenge szénsavba, amely nemegyszerűen társul, az oldatban lévő hidrogénionok teljes számaés ezért a pH nem változik annyira, mint a puffer hiányában.
bár egy puffer nagymértékben minimalizálja a változást, nem szünteti meg, mert még egy gyenge sav (például a szénsav) is bizonyos mértékig disszociál. A pufferoldat pH-ja a gyenge sav és konjugált bázis relatív koncentrációjának függvénye.
pH = 6.1 + log ( /)
Hol = koncentráció ofbicarbonate
= koncentrációja, szénsavas
Ez a kapcsolat, ismert, mint a Henderson-Hasselbalch egyenlet azt mutatja,hogy a pH-szabályozza az arány bázis(HCO3–) koncentráció sav(H2CO3) koncentráció.
mivel hidrogénionokat adnak a bikarbonát pufferhez:
H+ + HCO3 – ![]() H2CO3
H2CO3
bikarbonát (bázis) fogyasztják (a koncentráció csökken) éskarbonsavat állítanak elő (a koncentráció növekszik). Ha a hidrogéneket továbbra is hozzáadják, az összes hidrogén-karbonátot végül szénsavvá alakítják (szénsavvá alakítják), és nem lesz pufferhatás – a pH akkor élesen csökken, ha több savat adnának hozzá.
Ha azonban a szénsav folyamatosan eltávolítható a rendszerből, és a bikarbonát folyamatosan regenerálódik,akkor a hidrogénionok folyamatos hozzáadása ellenére is fenntartható a pH-érték.
amint világossá válik aacid-base egyensúly fiziológiájának részletesebben, vagyis valójában mi történik a testben. Ennek hiányában a tüdő biztosítja a szénsav eltávolítását (széndioxidként), a vesék pedig biztosítják a karbonát folyamatos regenerálódását.
a tüdőnek ez a szerepe a bikarbonát pufferrendszer szingularakterisztikájától függ, vagyis a szénsav szén-dioxiddá és vízdé alakítható.
a következő egyenlet felvázolja a bikarbonát pufferelő rendszer összes elemének összefüggését, mivel az
H+ +HCO3– ![]() H2CO3
H2CO3 ![]() H2O + CO2
H2O + CO2
fontos megjegyezni hogy a reakciók reverzibilisek.Az irány az egyes relatív koncentrációtól függelem. Így például a széndioxid emelkedésekoncentráció hatására a bal oldalon a szénsav fokozott képződésével, végül hidrogénionokkal reagál.
Ez magyarázza a szén-dioxid savpotenciálját, és elvezet minket ahhoz a fontos tényezőhöz, amelyet a tüdő és a vörösvértestek a sav-bázis egyensúlyba hoznak.
a tüdőfunkció, a CO2 és a sav-bázis transzportja
a vér állandó CO2-mennyisége, amely nélkülözhetetlen a normál sav-bázis egyensúlyhoz, a szövetsejtek metabolizmusának eredménye és a tüdő által kiválasztódó levegő egyensúlyát tükrözi.
a szén-dioxid kibocsátásának sebességének megváltoztatásával a tüdő szabályozza a vér szén-dioxid-tartalmát.A szén-dioxid-termelésből származó események sorrendjea lejárt levegőben történő eltávolításra vonatkozó jeleket az ábra írja le. 1.A szén-dioxid diffundál a szövetsejtekből, hogy körülvévekapilláris vér (ábra. 1a). Kis részük feloldódik a vérplazmában, és változatlan formában szállítják a tüdőbe.
de a legtöbb diffúz a vörösvértestekben, ahol vízzel kombinálódik, hogy szénsavat képezzen.A sav disszociál a hidrogénionok termelésével éskarbonát. A hidrogénionok a dezoxigénezett hemoglobinnal(a hemoglobin itt pufferként működik) egyesülnek, így a sejt pH-jában a veszélyesesés, a koncentráció mentén pedig a hidrogén-karbonát diffundálódikgradiens a vörösvértestből a plazmába.
így a szövetekben előállított széndioxid nagy részét a tüdőbe szállítják, mint a bikarbonatein vérplazmát.
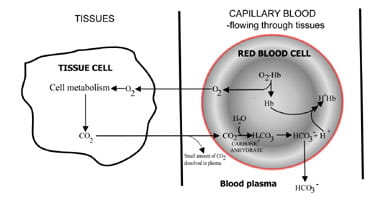
ábra. 1A. szövetekben előállított CO2A tüdőbe történő szállítás céljából bikarbonátra cserélve.
|
|
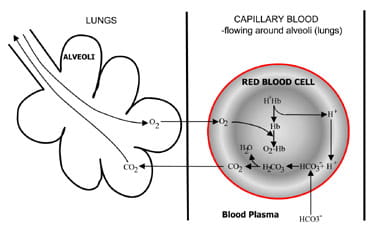
Fig. 1b. At the lungs bicarbonate convertedback to CO2 and eliminated by the lungs.
a tüdő alveolusaiban a folyamat megfordul (ábra. 1b).A hidrogénionok kiszorulnak a hemoglobinból, mivel oxigént vesz felaz inspirált levegőből. A hidrogénionokat most bibikarbonáttal pufferelik, amely a plazmából a vörösvérsejtbe diffundál, és karbonsav képződik. Ahogy ez a koncentráció emelkedik, az ISA vízhez és a szén-dioxidhoz igazodik. Végül a szén-dioxidelengedi a koncentrációs gradienst a vörösvértestektől az alveolusokig a lejárt levegőben.
Légúti chemoreceptors az agytörzs válaszolni, valamint a szén-dioxid-koncentrációja a vérben, ami increasedventilation (légzés) ha a szén-dioxid-koncentráció emelkedik anddecreased, szellőztetés, ha a szén-dioxid esik.
a vesék és a sav-bázis egyensúly
a normális celluláris metabolizmus a hidrogénionok folyamatos termelődését eredményezi. Láttuk, hogy kombináljukezek a hidrogénionok, a bikarbonát puffer a vérben minimalizáljákhatásukat. A pufferelés azonban csak rövid távon hasznos, végül a hidrogénionokat el kell távolítani a testből.Ezenkívül fontos, hogy a használt bikarbonátot használjákbuffer hidrogénionok folyamatosan cserélődnek.
ezt a két feladatot,a hidrogénionok eltávolítását és a bikarbonát regenerálódását a vesék végzik. A vesetubulus sejtek gazdagok a szén-anhidráz enzimben, ami elősegíti a szén-dioxid és a víz karbonsav képződését. A szénsav disszociálja a tobikarbonátot és a hidrogénionokat. A hidrogén-karbonát újra felszívódikvér, a hidrogénionok átjutnak a tubulus lumenébe éskiválasztják a szervezetből a vizeletben.
Ez a vizeletürítés függ a pufferek, a principallifoszfát és az ammónia ionok vizeletében való jelenlététől.
ZAVAROK, A SAV-BÁZIS EGYENSÚLY
a Legtöbb sav-bázis zavarok következtében
- – betegség vagy károsítja a szerveket (vese, tüdő, agy), amelynek normális működéséhez szükséges sav-bázis homeosztázis,
- – betegség, aminek a hatására kórosan fokozott termelése metabolikus savak olyan, hogy homeosztatikus mechanizmusok túlterheltek
- orvosi beavatkozás (pl. mechanikus szellőztetés, egyes gyógyszerek)
az artériás vérgázok a vérvizsgálat, amelyet az andmonitor sav-bázis zavarok azonosítására használnak. Három paraméter mérvea vérgáz-analízis, az artériás vér pH-ja( pH), a szén-dioxid parciális nyomása az artériás vérben(pCO2 (a)) ésA bikarbonát (HCO3–) koncentrálása alapvető fontosságú (lásd az I. táblázatot referenciaként (normál) tartomány).E három eredmény lehetővé teszi a sav-alapú osztályozástüremkedés a négy etiológiai kategória egyikére:
- Respiratory acidosis
- Respiratory alkalosis
- Metabolic acidosis
- Metabolic alkalosis
|
Adults |
Neonates |
|
|
pH |
7.35-7.45 |
7.30-7.40 |
|
pCO2 (kPa) |
4.7-6.0 |
3.5-5.4 |
|
Bicarbonate |
22-28 |
15-25 |
TABLE I. Hozzávetőleges referencia (normál)tartományok
ahhoz, Hogy megértsük, hogyan az eredmények pH, pCO2(a), illetve a hidrogén-karbonát vagy használatosak sav-bázis zavarok az aci, vissza kell térnünk a Henderson-Hasselbalch egyenlet
pH = 6.1 + log (/ )
mérjük a pH-hidrogén-karbonát, de nem szénsavas(H2CO3). Van azonban kapcsolat a pCO2(A) és a H2CO3 között, amely lehetővé teszi a Henderson-Hasselbalch egyenlet újragondolását a vérgáz-analízis során mért három paraméter (pH, pCO2(a) ésbikarbonát) között:
pH = 6,1 + log ( /( pCO2(a) × 0.23))
eltávolításával állandók ebből az egyenletből, a relationshipbetween a három mért paramétereket lehet több simplystated:
pH ∝ / pCO2(a)
Ez a kapcsolat, döntő a megértés, mind thatfollows vonatkozó sav-bázis zavarok, kimondja, hogy arterialblood pH-érték arányos az arány hidrogén-karbonát concentrationto pCO2(egy). Ez lehetővé teszi a következőketdeductions:
- pH normális marad mindaddig, amíg az arány : pCO2(a) normális marad
- pH növekszik (azaz alkalózis fordul elő), ha vagy növekszik, vagy pCO2(a) csökken.
- pH csökken (azaz acidózis lép fel) ha vagy csökken, vagy a pCO2(a) növekszik
- ha mind a pCO2(a), mind pedig viszonylag azonos mennyiségben növekszik, az arány, ezért a pH normális
- ha mind a pCO2(a), mind pedig viszonylag azonos mennyiségben csökken, az arány és ezért a pH normális.
a sav-bázis zavarok elsősorban az eitherpCO2(a) – t érintik, ebben az esetben légzészavarnak vagy metabolicdisturbance-nak nevezik:
- Ha az elsődleges torzulás, egy emelt pCO2(a) (ami miatt acidózis – lásd fent), a feltétel az úgynevezett légzési acidózis
- Ha az elsődleges zavar csökkentett pCO2(a) (ami miatt alkalózis – lásd fent), a feltétel az úgynevezett respiratorikus alkalózis
- Ha az elsődleges zavar kapcsolódó kedvezményes hidrogén-karbonát (amelynek eredményeként a acidózis – lásd fent), a feltétel az úgynevezett metabolikus acidózis
- Ha az elsődleges zavar társul felvetett hidrogén-karbonát (amelynek eredményeként a alkalózis – lásd fent), a feltétel az úgynevezett metabolikus alkalózis
a sav-bázis zavarok okai
légzőszervi acidózis – (emelkedett pCO2(a),csökkent pH)
a légzőszervi acidózist a nem megfelelő alveoláris szellőzés(hypoventiláció) és ennek következtében az ofCO2 vérből történő csökkent eliminációja jellemzi. A légzőszervi betegségek, mint pl. bronchopneumonia, emphysema, asztma és krónikus obstruktív légutak, mind összefügghetnek a légzőszervi acidózis kialakulásához elegendő hypoventilációval.
egyes gyógyszerek (pl. morfin ésbarbiturátok) légzőszervi acidózist okozhatnak az agy légzésközpontjának lehangolásával. Sérülés vagy trauma a mellkas falánés a légzés mechanikájában részt vevő izomzatcsökkenti a szellőzés sebességét. Ez magyarázza a légzőszervi acidozist, amely megnehezítheti az olyan betegségek lefolyását,mint a poliomyelitis, a Guillain-Barre-szindróma, valamint a súlyos mellkasi trauma helyreállítása.
légzőszervi alkalózis – (reducedpCO2 (a), fokozott pH)
ezzel szemben a légzőszervi alkalózist csökkentipco2(a) a túlzott alveoláris szellőzés miattés ami a CO2 túlzott eltávolítását eredményezi a vérből.Olyan betegség, amelyben a csökkent oxigén miatt a vérben (hipoxémia) aspirációs központot stimulálják, légzőkészüléket eredményezhetnekalkalózis.
példák közé tartozik a súlyos vérszegénység, tüdőembóliaés felnőtt légzőszervi szindróma. Hiperventiláció elegendőa légzési alkalózis a szorongásos támadások egyik jellemzője lehet éssúlyos fájdalomra reagál. Az egyik kevésbé üdvözlő tulajdonságszalicilát (aszpirin) stimuláló hatása a légzőkészülékrecenter. Ez a hatás a légzőszervi alkalózisra vonatkozika szalicilát túladagolása után következik be. Végül, overenthusiasticmechanikus szellőzés okozhat légúti alkalózis.
metabolikus acidózis – (decreasedHCO3 -, csökkent pH)
a csökkent bikarbonát mindig a metabolicacidosis egyik jellemzője. Ez két okból következik be: fokozott használatbikarbonát abnormális savterhelés pufferelésében vagy megnövekedett veszteségbikarbonát a szervezetből. A diabéteszes ketoacidózis és a lacticacidosis két olyan állapot, amelyet a metabolikus savak túltermelése és ennek következtében a bikarbonát kimerülése jellemez.
az első esetben a keto-savak(B-hidroxi-vajsav és acetoecetsav) kórosan magas vérkoncentrációja tükrözi az insulindeficienciából eredő számos metabolikus eltérést.
minden sejt tejsavat termel, ha oxigénhiányuk van, így a tejsavtermelés és az ebből eredő metabolitacidózis bármely olyan állapotban előfordul, amelyben a thetiszbe történő oxigénszállítás súlyosan sérül.
példák közé tartozik a szívmegállás és a hipovolémiás sokkhoz kapcsolódó bármely állapot (pl. massivefluid loss). A máj fontos szerepet játszik a kis eltávolításábana normál sejtmetabolizmus során termelt tejsav mennyisége, így a tejsavas acidózis a májbetegség egyik jellemzője lehet.
a bikarbonát rendellenes elvesztése a testbőlsúlyos hasmenés. Ha nincs bejelölve, ez metabolikus acidózishoz vezethet.A hidrogén-karbonát regenerálódásának és a hidrogénionok kiválasztásának elmulasztásamegmagyarázza a renalfailure-ben előforduló metabolikus acidózist.
metabolikus alkalózis – (megnövekedett HCO3 -, megnövekedett pH)
a bikarbonát mindig metabolikus alkalózisban emelkedik. Ritkán a bikarbonát túlzott adagolása vagy a bikarbonatein antacid készítmény lenyelése metabolikus alkalózist okozhat, de ezáltalában átmeneti. A hidrogénionok rendellenes elvesztése a testbőllegyen az elsődleges probléma. A bikarbonát, ami egyébként a vérben felhalmozódó elvesztett hidrogénionok puffereléséhez vezetne. A gyomornedv savas és gyomornedv, vagy bármely olyan betegség, amelyben a gyomortartalom a szervezetből a hidrogénionok elvesztését jelenti.
aa gyomornedv Projektilis hányása például magyarázza ametabolikus alkalózist, amely pyloricstenosisban szenvedő betegeknél fordulhat elő. A súlyos káliumhiány metabolikus alkalózist okozhata hidrogén és a potassiumionok közötti kölcsönös kapcsolat miatt.
kompenzáció – a sav-bázis egyensúly következménye
létfontosságú az élet számára, hogy a pH ne menjen túl messze a normálistól, és a szervezet mindig megpróbálja visszaadni a kóros pH-értéket, ha a sav-bázis egyensúly megzavarodik. Ennek az életmentő folyamatnak a kompenzációjára kerül sor. Ahhoz, hogy megértsükkompenzáció, fontos emlékeztetni arra, hogy a pH-t a theratio szabályozza: pCO2 (a). mindaddig, amíg az arány normális, a pH normális lesz.
vegye figyelembe a metabolikus acidózisban szenvedő beteget, akinek pH-ja alacsonymert a bikarbonát alacsony. A normál értékhez viszonyított minden fontos arány mellett a betegnek csökkentenie kell a hispCO2-t (a). A légzőkészülék kemoreceptoraiaz agyközpontja növekvő hidrogénion-koncentrációra(alacsony pH) reagál, ami fokozott szellőzést (hiperventilációt) ésa szén-dioxid fokozott eliminációjával; thepCO2(A) csökken, és az arány : pCO2(a) visszatéra normális szintre.
a metabolikus alkalózis kompenzációja, amely magas, ezzel szemben magában foglalja a légzés elnyomását és ezáltal a széndioxid visszatartásáthogy a pCO2 (a) emelkedik, hogy megfeleljen a növekedésnek . A légzésdepresszió azonban nem kívánatos mellékhatása a szövetek megfelelő oxigénellátásának. Emiatt légzési kompenzáció aa metabolikus alkalózis korlátozott.
a pCO2(a) elsődleges zavarait (respiratoryacidosis és alkalosis) kompenzálja a hidrogénion kiválasztódásának vese-korrekciója, ami olyan változásokat eredményez, amelyek megfelelően kompenzálják a pCO2(a) elsődleges változását. Így a respiratorikus acidózis (raisedpCO2(a)) renalkompenzációja magában foglalja abikarbonát fokozott reabszorpcióját, a légzőszervi alkalózis(csökkentett pCO2(a)) vese kompenzációja pedig csökkent bicarbonatereabszorpciót foglal magában.
a sav-bázis egyensúly fogalma a kompenzáció során vizuálisan továbbítva az ábrán. 2. A II. táblázat összefoglalja a vérgázokatolyan eredmények, amelyek mind a négy sav – bázis zavart jellemzikés kompenzáció után.
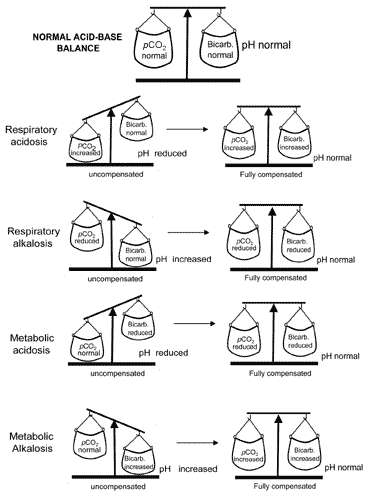
ábra. 2. A “sav-bázis egyensúly” : compensationrestores normal pH
|
Primary disturbance |
||||
|
Respiratory |
Repiratory |
Metabolic |
Metabolic |
|
|
Some |
Emphysema |
Hyper- |
Renal failure |
Bicarbonate Potassium |
|
Compen- |
RENAL |
RENAL |
RESPIRA- |
RESPIRA- |
|
Initial blood |
pH |
pH |
pH |
pH |
|
Blood gas |
pH pCO2 |
pH pCO2 |
pH pCO2 |
Korlátozott |
|
Blood gas |
pH normal |
pH normal |
pH normal |
Limited |
Printfriendly változata táblázat, pdf.
II. táblázat a vérgáz a sav-bázis egyensúly zavarait eredményezi
az elsődleges metabolikus zavar légzési kompenzációjasokkal gyorsabban fordul elő, mint az aprimáris légzési zavarok metabolikus (vese) kompenzációja. A második esetben a kompenzációnapokon, nem órákon keresztül történik.
Ha a kompenzáció a pH normál értékre való visszatérését eredményezi, akkor azt mondják, hogy a beteg teljeskompenzált. De sok esetben a kompenzáció visszatér phtowards normális elérése nélkül normalitás; ilyen esetekbena beteget részben kompenzálják.
a fent leírt Forreasonok, a metabolikus alkalózis nagyon ritkán teljeskompenzált.
vegyes sav-bázis zavarok
a fenti vitából feltételezhető, hogy minden sav-bázis zavarban szenvedő beteg csak a sav-bázis egyensúly négy kategóriájának egyikében szenved. Lehet, hogy ez a helyzet,de bizonyos körülmények között a betegek több mintegy zavar.
például vegye figyelembe a krónikus betegségben szenvedő beteget, mint például az emphysema, akinek hosszú ideje részesenkompenzált légzőszervi acidózis. Ha ez a beteg szintén adiabetikus volt, aki nem vette be a normál inzulinadagot, és ennek eredményekéntmetabolikus ketoacidózis állapotban volt, a vérgáz eredménye mind a légzőszervi acidózis, mind ametabolikus acidózis kombinált hatását tükrözi.
az ilyen vegyes sav-bázis zavarok nem gyakoriak, és csak az arterialblood gáz eredményei alapján nehéz lehet feloldani.
összefoglaló
a normál vér pH-jának fenntartása több szervrendszert is magában foglalés a keringési integritástól függ. Nem meglepő, hogy a sav-bázis egyensúly zavara megnehezítheti a különböző betegségek lefolyását, valamint a test számos részének traumáját. A testnek jelentős ereje van a vér pH-jának megőrzésére, ésa rendellenességek általában súlyos krónikus betegséget vagy akut betegséget jelentenek.
az artériás vérgáz-analízis eredményei azonosíthatják a sav-bázis zavarokat, és értékes információkat szolgáltathatnak annak okairól.
néhányan javasolták, hogy folytassák tovább
- Thomson WST, Adams JF, Cowan RA. Klinikai sav-bázis egyensúly. Oxford: Oxford Medical Publications 1997
- Harrison RA. Sav-bázis egyensúly. Respir Care Clin N. America 1995; 1,1: 7-21
- Woodrow P. arteriális vérgáz-analízis. Ápolási szabvány 2004; 18,21: 45-52
- Sirker AA, Rhodes a, Gounds RM, Bennet ED. A sav-bázis fiziológiája: a “hagyományos” és a “modern” megközelítés. Anesztézia 2002; 57: 348-56