bizonyos paraméterek, például méret, hosszúság és szög meghatározása atomi skálán nem könnyű. Ezeknek a paramétereknek a fontossága miatt a tudósok olyan módszereket fejlesztettek ki, amelyek a paramétereket atomi szinten levezetik vagy kiszámítják. A kötésrend és a kötéshossz két olyan fontos paraméter, amely az atompár közötti kötések típusát és erősségét jelzi.
Ez a cikk magyarázza,
1. Mik azok a Kötéssorrendek és kötéshossz
2. A Kötéssorrend és kötéshossz kiszámítása
– A Kötéssorrend kiszámítása
– A kötéshossz kiszámítása
mik azok a Kötésrendek és kötéshossz
kötéshossz és kötésrendelés két paraméter, amelyek kovalens kötésekhez kapcsolódnak. A kötésrend a két atom közötti kémiai kötések száma, a kötéshossz pedig a kovalens kötésű atomok két magja közötti távolság. Ez a cikk elmagyarázza, hogyan kell kiszámítani a kötési sorrendet és a kötés hosszát atomi szinten.
A kötési sorrend kiszámítása
a kötési sorrend a két atom közötti kémiai kötések száma. Ez jelzi a kötés stabilitását. Kovalens kötésekben a kötési sorrend a megosztott elektronok száma. Például az egyetlen kötéssel összekapcsolt atompár kötési sorrendje egy, míg a kettős kötéssel összekapcsolt atompár kötési sorrendje kettő. A nulla kötési sorrend azt jelzi, hogy nincs kötés az atomok között. A molekula stabilitása növekszik a kötési rend növekedésével. A rezonancia kötéssel rendelkező molekuláknak nem kell egész számnak lenniük. A kovalens vegyületek két atom, a bond érdekében között egy pár atomok határozzák meg első rajz a Lewis felépítése, majd annak meghatározása, a típusú kötvények között az atomok – nulla bond, egyedülálló, kettős vagy hármas kötelék. Például a hidrogéngáz kötési sorrendjét az alábbiak szerint határozzuk meg.
- rajzolja meg a Lewis struktúrát
H: H
- határozza meg a kötések/pár valence elektronok számát
egy pár elektron, így a kötési sorrend 1.
Ha több mint két atom van, a kötési sorrendet az alábbiak szerint kell meghatározni. Lásd a példát: nitrát ion.
- Felhívni a Lewis szerkezet
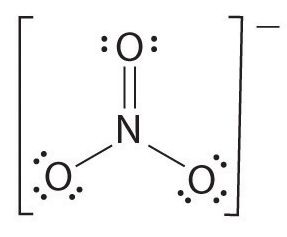
- a Gróf száma összesen kötvények (a nitrát-ion, annak 4)
- A száma bond csoportok között egyes atomok (az ammónia, a 3)
- Ezért a bond order = Összesen kötvények/ száma bond csoportok
= 4/3
= 1.33
Ezért a bond érdekében a nitrát-ion 1.33
A kötéshossz kiszámítása
a kötéshossz a kovalens kötésű atomok két magja közötti távolság. A kötés hossza általában 0,1-0,2 nm tartományban van. Ha két hasonló atomot kötünk össze, a kötés hosszának felét kovalens sugárnak nevezzük. A kötés hossza két atom kötött elektronjainak számától vagy a kötési sorrendtől függ. Magasabb a kötési sorrend, rövidebb a kötés hossza a pozitív töltésű magok erős húzóerejének köszönhető. A kötés hossza picometer. Egy -, kettős-és hármas kötésben a kötéshossz a
hármas kötés<kettős kötés<egyetlen kötés
Elektronegativitás segítségével kiszámítható a kötés hossza két különböző elektronegativitással rendelkező atom között. A következő empirikus képletet Shoemaker és Stevenson javasolta a kötés hosszának kiszámításához.
dA-B = rA + rB-0.09 (xA-xB)
dA-B az A és B két atom közötti kötési távolság, rA és rB az A és B kovalens sugara, és
(xA-xB) az A és B közötti elektronegativitási különbség.
egy másik módszert alkalmaznak a közelítő kötés hosszának kiszámításához. Ebben a módszerben az első Lewis-struktúrát a kovalens kötés típusának meghatározására húzzuk. Ezután a Cordero et al által végzett tanulmányokról készített diagram* segítségével. és Pyykköt és Atsumit az egyes atomok kötéseinek megfelelő sugara határozza meg. Ezután a kötés hosszát a két sugár összegével határozzuk meg. Például a szén-dioxid kötési hosszának meghatározásakor először Lewis-szerkezetet rajzolunk.
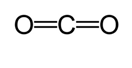
a diagram szerint a szén kettős kötés kovalens sugara 67 pikométer, az oxigén kettős kötés pedig 57 pikométer. Ezért a szén-dioxid kötési hossza körülbelül 124 pikométer (57 pm+ 67 pm).
*kovalens diagram itt található
referencia:
Cordero, Beatriz, et al. “Covalent radii revisited.”Dalton Transactions 21 (2008): 2832-2838.
Libretexts. “Bond rend és Hossz.”Chemistry LibreTexts. Libretexts, 05 December. 2016. Web. Január 10. 2017.
Lister, Ted és Janet Renshaw. A kémia megértése a fejlett szintre. N. p.: Nelson Thornes, 2000. Nyomtatás.
Pratiyogita Darpan. “Az elemek tulajdonságai az elektronikus szerkezetükhöz viszonyítva .”Competition Science Vision Aug. 1998: n. pag. Nyomtatás.
Pyykkö, Pekka és Michiko Atsumi. “Molecular Double-Bond Covalent Radii for Elements Li-E112.”Chemistry–A European Journal 15.46 (2009): 12770-12779.
![]()