yleisnimi: Terbutaliinisulfaatti
annosmuoto: injection, solution
Drugs.com. viimeksi päivitetty 1. syyskuuta 2020.
- yleiskatsaus
- haittavaikutukset
- yhteisvaikutukset
- lisää
annostus Professional
steriili vesiliuos ihonalaista injektiota varten
vain Rx
varoitus: pitkittynyttä Tokolyysiä
Terbutaliinisulfaattia ei ole hyväksytty, eikä sitä tule käyttää pitkittyneeseen tokolyysiin (yli 48-72 tuntia). Erityisesti Terbutaliinisulfaattia ei tule käyttää ylläpitotokoolyysiin avohoidossa tai kotona. Vakavia haittavaikutuksia, mukaan lukien kuolema, on raportoitu terbutaliinisulfaatin antamisen jälkeen raskaana oleville naisille. Äidillä näitä haittavaikutuksia ovat sydämen sykkeen nousu, ohimenevä hyperglykemia, hypokalemia, sydämen rytmihäiriöt, keuhkopöhö ja sydänlihasiskemia. Äidin anto voi aiheuttaa sikiön sydämen sykkeen nopeutumista ja vastasyntyneen hypoglykemiaa (KS.vasta-aiheet: pitkittynyt Tokolyysi).
- Terbutaliinisulfaatti
- terbutaliini – Kliininen farmakologia
- prekliinisissä
- farmakokinetiikka
- käyttöaiheet ja käyttö terbutaliini
- vasta-aiheet
- Varoitukset
- astman huononeminen
- anti-inflammatoristen aineiden käyttö
- kardiovaskulaariset vaikutukset
- kouristuskohtaukset
- varotoimet
- Yleiset
- Lääkkeiden yhteisvaikutukset
- karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
- raskaus-teratogeeniset vaikutukset
- käyttö synnytyksessä
- imettävät äidit
- lapsipotilaille
- geriatrinen käyttö
- haittavaikutukset
- yliannostus
- terbutaliini Annostus ja antotapa
- miten terbutaliini toimitetaan
- pääasiallinen näyttöpaneeli
- pääasiallinen näyttöpaneeli
- SERIALIZATION IMAGE
- lisää terbutaliinista
- Consumer resources
- Ammattiresurssit
- hoito-ohjeet
Terbutaliinisulfaatti
TERBUTALIINISULFAATTI, USP, terbutaliinisulfaatin injektion vaikuttava aine, USP, on beeta‑adrenerginen bronkodilataattori, joka on saatavana steriilinä, epipyrogeenisena vesiliuoksena injektiopulloissa ihon alle annettavaksi. Yksi millilitra liuosta sisältää 1 mg Terbutaliinisulfaattia, USP: tä (0, 82 mg vapaata emästä), natriumkloridia isotonisuutena, 0, 055% dinatriumdihydraattia stabilointiaineena ja suolahappoa, jotta tavoitearvo pH 4 voidaan säätää. Terbutaliinisulfaatti on (±) – a–3,5-dihydroksibentsyi-alkoholisulfaatti (2:1) (suola). Sen molekyylikaava on (C12H19N03) 2 * H2SO4 ja rakennekaava on:
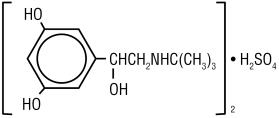
Terbutaliinisulfaatti, USP on valkoista tai harmaanvalkoista kiteistä jauhetta. Se on hajuton tai siinä on heikko etikkahapon haju. Se liukenee veteen ja 0,1 N suolahappoon, liukenee hieman metanoliin ja liukenematon kloroformiin. Sen molekyylipaino on 548,65.
terbutaliini – Kliininen farmakologia
Terbutaliinisulfaatti-injektio on beeta-adrenergisen reseptorin agonisti. Farmakologiset tutkimukset In vitro ja in vivo ovat osoittaneet, että Terbutaliinilla on ensisijainen vaikutus beeta2‑adrenergisiin reseptoreihin. Vaikka on tunnustettu, että beeta2-adrenergiset reseptorit ovat vallitsevia reseptoreita keuhkoputken sileässä lihaksessa, tiedot osoittavat, että ihmisen sydämessä on beeta2-reseptoreita, joiden pitoisuus on 10-50%. Näiden reseptorien tarkkaa toimintaa ei ole selvitetty (KS.varoitukset). Kontrolloidut kliiniset tutkimukset potilailla, jotka ovat saaneet terbutaliinia ihon alle, eivät ole osoittaneet erityistä beeta2-adrenergista vaikutusta.
beeta-adrenergisten agonistien, terbutaliini mukaan lukien, farmakologiset vaikutukset johtuvat ainakin osittain solunsisäisen adenyylisyklaasin beetasalpaajareseptorien kautta tapahtuvasta stimulaatiosta.Adenosiinitrifosfaatti (ATP) on entsyymi, joka katalysoi adenosiinitrifosfaatin (ATP) muuntumista sykliseksi 3′,5′-adenosiinimonofosfaatiksi (cAMP). CAMP-arvojen kohoaminen liittyy keuhkoputkien sileän lihaksen rentoutumiseen ja välittömän yliherkkyyden välittäjäaineiden vapautumisen estymiseen soluista, erityisesti syöttösoluista.
kontrolloidut kliiniset tutkimukset ovat osoittaneet, että Terbutaliinisulfaatti-injektio lievittää bronkospasmia akuutissa ja kroonisessa obstruktiivisessa keuhkosairaudessa lisäämällä merkittävästi keuhkojen virtausta (esim.FEV1: n nousu vähintään 15%). Ihon alle annetun 0, 25 mg terbutaliinisulfaatti-injektion jälkeen mitattavissa oleva muutos ekspiratorisessa virtauksessa tapahtuu yleensä 5 minuutin kuluessa ja kliinisesti merkitsevä FEV1: n nousu tapahtuu 15 minuutin kuluessa. Maksimivaikutus saavutetaan yleensä 30-60 minuutin kuluessa, ja kliinisesti merkittävä keuhkoputkia laajentava vaikutus voi jatkua 1, 5-4 tuntia. Kliinisesti merkitsevän paranemisen kesto on verrattavissa equimilligram-epinefriiniannosten kestoon.
prekliinisissä
koe-eläimillä (minisioilla, jyrsijöillä ja koirilla) tehdyissä tutkimuksissa on todettu sydämen rytmihäiriöitä ja äkkikuolemaa (johon liittyy histologista näyttöä sydänlihaskuoliosta), kun beeta-agonisteja ja metyyliksantiineja annetaan samanaikaisesti. Näiden löydösten kliinistä merkitystä ei tunneta.
farmakokinetiikka
ihon alle annettu 0, 5 mg Terbutaliinisulfaattia 17 terveelle aikuiselle mieshenkilölle johti terbutaliinin huippupitoisuuden keskiarvoon (SD) plasmassa 9, 6 (3, 6) ng / mL, mikä havaittiin keskimäärin 0, 5 (0, 08-1, 0) tunnin kuluttua annostelusta. Keskimääräinen (SD) AUC (0-48) oli 29, 4 (14, 2) h•ng/mL ja kokonaispuhdistuma 311 (112) mL/min. Terminaalinen puoliintumisaika määritettiin 9: llä 17 potilaasta, ja sen keskiarvo (SD) oli 5, 7 (2, 0) tuntia.
kun kahdelle mieshenkilölle annettiin 0, 25 mg terbutaliinisulfaattia ihon alle, terbutaliinin huippupitoisuudet seerumissa havaittiin noin 20 minuutin kuluttua annostelusta 5, 2 ja 5, 3 ng / mL.
lääkkeen eliminaation puoliintumisaika 10 potilaalla 14: stä oli noin 2, 9 tuntia ihonalaisen annostelun jälkeen, mutta pitempiä eliminaation puoliintumisaikoja (6-14 tuntia) havaittiin 4 muulla potilaalla. Noin 90% lääkkeestä erittyi virtsaan 96 tunnin kuluttua ihonalaisesta annostelusta, ja noin 60% tästä oli muuttumatonta lääkettä. Sulfaattikonjugaatti näyttää olevan terbutaliinin päämetaboliitti ja erittyminen virtsaan on pääasiallinen eliminaatioreitti.
käyttöaiheet ja käyttö terbutaliini
Terbutaliinisulfaatti-injektiona USP on tarkoitettu bronkospasmin ehkäisyyn ja kumoamiseen 12-vuotiailla ja sitä vanhemmilla potilailla, joilla on astma ja korjautuva bronkospasmi, johon liittyy keuhkoputkentulehdus ja keuhkolaajentuma.
vasta-aiheet
1. Pitkittynyttä tokolyysiä
terbutaliinisulfaattia ei ole hyväksytty, eikä sitä tule käyttää pitkittyneeseen tokolyysiin (yli 48-72 tuntia). Erityisesti Terbutaliinisulfaattia ei tule käyttää tokolyysin ylläpitoon avohoidossa tai Kotona (KS.laatikko varoitus: pitkittynyt Tokolyysi).
2. Yliherkkyys
Terbutaliinisulfaatti-injektio on kontraindisoitu potilaille, joiden tiedetään olevan yliherkkiä sympatomimeettisille amiineille tai jollekin tämän lääkevalmisteen aineosalle.
Varoitukset
astman huononeminen
astma voi pahentua akuutisti tuntien kuluessa tai kroonisesti useiden päivien tai pitempään. Jos potilas tarvitsee tavallista enemmän Terbutaliinisulfaattiannoksia, tämä voi olla merkki astman epävakaudesta ja edellyttää potilaan ja hoito‑ohjelman uudelleenarviointia, jossa kiinnitetään erityistä huomiota tulehduslääkityksen, esim.kortikosteroidien, mahdolliseen tarpeeseen.
anti-inflammatoristen aineiden käyttö
bronkodilatoivien beeta-adrenergisten agonistien käyttö yksinään ei ehkä riitä hallitsemaan astmaa monilla potilailla. Tulehduslääkkeiden, esim. kortikosteroidien, lisäämistä tulisi harkita jo varhaisessa vaiheessa.
kardiovaskulaariset vaikutukset
Terbutaliinisulfaatti, kuten kaikki muutkin beeta-adrenergiset agonistit, voi aiheuttaa joillakin potilailla kliinisesti merkittävän kardiovaskulaarisen vaikutuksen pulssilla, verenpaineella ja / tai oireilla mitattuna. Vaikka tällaiset vaikutukset ovat harvinaisia terbutaliinisulfaatin annon jälkeen suositelluilla annoksilla, jos niitä ilmenee, lääkkeen käyttö voidaan joutua keskeyttämään. Lisäksi beeta-agonistien on raportoitu aiheuttaneen EKG-muutoksia, kuten T-aallon madaltumista, QTc-ajan pitenemistä ja ST-segmentin alenemista. Näiden löydösten kliinistä merkitystä ei tunneta. Siksi Terbutaliinisulfaattia, kuten kaikkia sympatomimeettisiä amiineja, tulee käyttää varoen potilailla, joilla on sydän-ja verisuonisairauksia, erityisesti sepelvaltimon vajaatoimintaa, sydämen rytmihäiriöitä ja hypertensiota.
kouristuskohtaukset
terbutaliinia saavilla potilailla on raportoitu harvoin kohtauksia; kohtaukset eivät uusiutuneet näillä potilailla lääkkeen käytön lopettamisen jälkeen.
varotoimet
Yleiset
terbutaliinia, kuten kaikkia sympatomimeettisiä amiineja, tulee käyttää varoen potilailla, joilla on sydän-ja verisuonisairauksia, mukaan lukien iskeeminen sydänsairaus, hypertensio ja sydämen rytmihäiriöt; potilailla, joilla on kilpirauhasen liikatoiminta tai diabetes; ja potilailla, jotka ovat epätavallisen herkkiä sympatomimeettisille amiineille tai joilla on kouristuskohtauksia. Merkitseviä muutoksia systolisessa ja diastolisessa verenpaineessa on havaittu ja niitä voidaan odottaa tapahtuvan joillakin potilailla minkä tahansa beeta-adrenergisen bronkodilataattorin käytön jälkeen.
terbutaliinin annon jälkeen on raportoitu välittömiä yliherkkyysreaktioita ja bronkospasmin pahenemista.
beeta-adrenergiset agonistilääkkeet voivat joillakin potilailla aiheuttaa merkittävää hypokalemiaa, mahdollisesti solunsisäisen vaihtelun kautta, mikä voi aiheuttaa haitallisia sydän-ja verisuonivaikutuksia. Lasku on yleensä ohimenevää, ei vaadi täydentämistä.
suurten laskimonsisäisten Terbutaliiniannosten on raportoitu pahentavan diabetes mellitusta ja ketoasidoosia.
Lääkkeiden yhteisvaikutukset
Terbutaliinisulfaatti-injektion samanaikaista käyttöä muiden sympatomimeettien kanssa ei suositella, koska potilaan yhteisvaikutus sydän-ja verisuonijärjestelmään voi olla haitallinen.
Monoamiinioksidaasin estäjät tai trisykliset masennuslääkkeet:terbutaliinia tulee antaa äärimmäisen varovasti potilaille, joita hoidetaan monoamiinioksidaasin estäjillä tai trisyklisillä masennuslääkkeillä, tai 2 viikon kuluessa tällaisten lääkkeiden käytön lopettamisesta, koska terbutaliinin vaikutus verisuonistoon voi voimistua.
beetasalpaajat: Beeta-adrenergiset reseptorisalpaajat eivät ainoastaan estä beeta-agonistien, kuten Terbutaliinisulfaatti-injektion, keuhkovaikutusta, vaan ne voivat aiheuttaa astmapotilaille vakavan bronkospasmin. Siksi astmaa sairastavia potilaita ei yleensä tulisi hoitaa beetasalpaajilla. Tietyissä olosuhteissa, esimerkiksi sydäninfarktin jälkeisenä profylaksina, beetasalpaajien käytölle astmapotilailla ei välttämättä ole hyväksyttäviä vaihtoehtoja. Tässä tilanteessa Kardioselektiivisten beetasalpaajien käyttöä voidaan harkita, vaikkakin niiden käytössä on noudatettava varovaisuutta.
diureetit: beeta-agonistit voivat akuutisti pahentaa ei-kaliumia säästävien diureettien (kuten Loopin tai tiatsididiureettien) käytöstä mahdollisesti aiheutuvia EKG-muutoksia ja / tai hypokalemiaa, erityisesti silloin, kun beeta-agonistin suositeltu annos ylittyy. Vaikka näiden vaikutusten kliinistä merkitystä ei tunneta, varovaisuutta on noudatettava annettaessa beeta-agonisteja samanaikaisesti ei-kaliumia säästävien diureettien kanssa.
karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Sprague-Dawley-rotilla tehdyssä 2 vuotta kestäneessä tutkimuksessa Terbutaliinisulfaatti aiheutti mesovariumin hyvänlaatuisten leiomyoomien merkittävän ja annosriippuvaisen lisääntymisen vähintään 50 mg/kg: n ruokavalioannoksilla (noin 810‑kertainen suositeltava päivittäinen ihonalainen (SC) annos aikuisille mg / m2: n perusteella). CD-1-hiirillä tehdyssä 21 kuukautta kestäneessä tutkimuksessa terbutaliinisulfaatti ei osoittanut tuumorigeenisuutta, kun sitä käytettiin ravinnon mukana enintään 200 mg/kg: aan asti (noin 1 600 kertaa aikuisten suositeltu päivittäinen sc-annos mg/m2: n perusteella). Terbutaliinisulfaatin mutageenisuuspotentiaalia ei ole määritetty.
lisääntymistutkimukset rotilla, jotka käyttivät Terbutaliinisulfaattia, eivät osoittaneet hedelmällisyyden heikkenevän enintään 50 mg/kg: n oraalisilla annoksilla (noin 810-kertainen aikuisille suositeltu sc-vuorokausiannos mg / m2: n perusteella).
raskaus-teratogeeniset vaikutukset
Raskauskategoria C
ei ole olemassa riittäviä ja hyvin kontrolloituja tutkimuksia terbutaliinisulfaatista raskaana olevilla naisilla. Julkaistut eläinkokeet osoittavat, että rotan jälkeläisillä esiintyy muutoksia käyttäytymisessä ja aivojen kehityksessä, mukaan lukien solujen proliferaation ja erilaistumisen väheneminen, kun emoja hoidettiin ihon alle terbutaliinilla tiineyden ja laktaation loppuvaiheessa. Terbutaliinialtistukset rotan emoilla olivat noin 24-48-kertaiset verrattuna ihmisen tavanomaiseen annokseen aikuisilla (2-4 mg/vrk, mg/m2).
Terbutaliinisulfaattia ei ole hyväksytty eikä sitä tule käyttää pitkittyneeseen tokolyysiin (yli 48-72 tuntia). Erityisesti Terbutaliinisulfaattia ei tule käyttää ylläpitotokoolyysiin avohoidossa tai kotona. Vakavia haittavaikutuksia, mukaan lukien kuolema, on raportoitu terbutaliinisulfaatin antamisen jälkeen raskaana oleville naisille. Äidillä näitä haittavaikutuksia ovat sydämen sykkeen nousu, ohimenevä hyperglykemia, hypokalemia, sydämen rytmihäiriöt, keuhkopöhö ja sydänlihasiskemia. Äidin anto voi aiheuttaa sikiön sydämen sykkeen nopeutumista ja vastasyntyneen hypoglykemiaa (KS.kehystetty varoitus: pitkittynyt Tokolyysi ja vasta-aiheet: pitkittynyt Tokolyysi).
eläinten alkio-ja sikiönkehitystutkimuksissa ei havaittu teratogeenisia vaikutuksia jälkeläisillä, kun tiineet rotat ja kaniinit saivat terbutaliinisulfaattia suun kautta annettuna enintään 50 mg/kg/vrk, mikä on noin 810-kertainen ja 1600-kertainen suurin suositeltu päivittäinen ihonalainen annos aikuisille mg / m2-periaatteella.
Terbutaliinisulfaattia tulee käyttää raskauden aikana vain, jos mahdollinen hyöty oikeuttaa mahdollisen riskin sikiölle.
käyttö synnytyksessä
koska beeta-agonistilla saattaa olla häiriöitä kohdun supistumiskykyyn, terbutaliinisulfaatti-injektion käyttö bronkospasmin lievittämiseen synnytyksen aikana on rajoitettava potilaisiin, joilla hyödyt ovat selvästi riskejä suuremmat.
terbutaliini läpäisee istukan. Kun terbutaliinia annettiin kerta-annoksena laskimoon 22: lle raskauden loppupuolella elektiivisellä keisarileikkauksella kliinisistä syistä, todettiin terbutaliinin napaveritasojen olevan 11-48% äidin veritasoista.
imettävät äidit
ei tiedetä, erittyykö tämä lääke äidinmaitoon. Siksi terbutaliinisulfaatti-injektiota tulee käyttää imetyksen aikana vain, jos mahdollinen hyöty oikeuttaa mahdollisen vaaran vastasyntyneelle.
lapsipotilaille
Terbutaliinisulfaatin injektiota ei suositella alle 12-vuotiaille potilaille, koska kliiniset tiedot turvallisuudesta ja tehosta ovat riittämättömät.
geriatrinen käyttö
Terbutaliinisulfaatti-injektion kliinisiin tutkimuksiin ei osallistunut riittävästi 65 vuotta täyttäneitä tutkimushenkilöitä, jotta olisi voitu määrittää, onko heillä erilainen vaste kuin nuoremmilla tutkimushenkilöillä. Muissa raportoiduissa kliinisissä kokemuksissa ei ole havaittu eroja vasteissa iäkkäiden ja nuorempien potilaiden välillä. Iäkkään potilaan annoksen valinnassa on yleensä oltava varovainen, ja se on aloitettava yleensä annosalueen alapäästä, mikä johtuu maksan, munuaisten tai sydämen toiminnan heikkenemisen ja samanaikaisen sairauden tai muun lääkehoidon yleisyydestä.
haittavaikutukset
Terbutaliinisulfaatti-injektion yhteydessä havaitut haittavaikutukset ovat samanlaisia kuin yleisesti muiden sympatomimeettien yhteydessä havaitut. Kaikki nämä reaktiot ovat ohimeneviä eivätkä yleensä vaadi hoitoa.
seuraavassa taulukossa verrataan terbutaliinisulfaattiruiskeella (0, 25 mg ja 0, 5 mg) hoidettujen potilaiden haittavaikutuksia epinefriiniruiskeella (0, 25 mg ja 0, 5 mg) hoidettujen potilaiden haittavaikutuksiin kahdeksassa vaihtovuoroisessa kaksoissokkotutkimuksessa, joihin osallistui yhteensä 214 potilasta.
| Incidence (%) of Adverse Reactions | |||||
| Terbutaline (%) | Epinephrine (%) | ||||
|
0.25 mg |
0.5 mg N = 205 |
0.25 mg N = 153 |
0.5 mg N = 61 |
||
| Reaction Central Nervous System |
|||||
| Tremor | 7.8 | 38.0 | 16.3 | 18.0 | |
| Nervousness | 16.9 | 30.7 | 8.5 | 31.1 | |
| Dizziness | 1.3 | 10.2 | 7.8 | 3.3 | |
| Headache | 7.8 | 8.8 | 3.3 | 9.8 | |
| Drowsiness | 11.7 | 9.8 | 14.4 | 8.2 | |
| Cardiovascular | |||||
| Palpitations | 7.8 | 22.9 | 7.8 | 29.5 | |
| Tachycardia | 1.3 | 1.5 | 2.6 | 0.0 | |
| Respiratory | |||||
| Dyspnea | 0.0 | 2.0 | 2.0 | 0.0 | |
| Chest discomfort | 1.3 | 1.5 | 2.6 | 0.0 | |
| Gastrointestinal | |||||
| Nausea/vomiting | 1.3 | 3.9 | 1.3 | 11.5 | |
| Systemic | |||||
| Weakness | 1.3 | 0.5 | 2.6 | 1.6 | |
| Flushed feeling | 0.0 | 2.4 | 1.3 | 0.0 | |
| Sweating | 0.0 | 2.4 | 0.0 | 0.0 | |
| Pain at injection site | 2.6 | 0.5 | 2,6 | 1,6 | |
Huom.: jotkut potilaat saivat enemmän kuin yhden annosvahvuuden terbutaliinisulfaattia ja epinefriiniä. Lisäksi raportoitiin ahdistusta, lihaskramppeja ja suun kuivumista (< 0, 5%). Maksaentsyymiarvojen nousua ja yliherkkyysvaskuliittia on raportoitu harvoin terbutaliinin annon yhteydessä.
ilmoittaaksesi epäillyistä haittavaikutuksista, ota yhteyttä Hikma Pharmaceuticals USA Inc.. 1-877-233-2001 tai FDA 1-800-FDA-1088 tai www.fda.gov/medwatch
yliannostus
täysikasvuisilla rotilla terbutaliinisulfaatin kuolettavan annoksen mediaani oli noin 165 mg/kg (noin 2700 kertaa aikuisten suositeltu päivittäinen ihonalainen annos mg / m2). Terbutaliinisulfaatin letaalin annoksen mediaani nuorilla rotilla oli noin 2 000 mg/kg (noin 32 000 kertaa aikuisten suositeltu vuorokausiannos mg/m2).
yliannostuksen odotettuja oireita ovat liiallinen beeta-adrenerginen stimulaatio ja / tai haittavaikutuksissa lueteltujen oireiden esiintyminen tai liioittelu, esim.kouristuskohtaukset, angina pectoris, hypertensio tai hypotensio, takykardia, jonka nopeus on enintään 200 lyöntiä minuutissa, rytmihäiriöt, hermostuneisuus, päänsärky, vapina, suun kuivuminen, sydämentykytys, pahoinvointi, huimaus, väsymys, huonovointisuus ja unettomuus. Myös hypokalemiaa voi esiintyä. Spesifistä vastalääkettä ei ole. Hoito koostuu terbutaliinisulfaatti-injektion keskeyttämisestä ja asianmukaisesta oireenmukaisesta hoidosta. Kardioselektiivisen beetareseptorisalpaajan harkittua käyttöä voidaan harkita ottaen huomioon, että tällainen lääkitys voi aiheuttaa bronkospasmia. Ei ole riittävästi näyttöä sen määrittämiseksi, onko dialyysistä hyötyä terbutaliinisulfaatti-injektion yliannostuksessa.
terbutaliini Annostus ja antotapa
injektiopulloja tulee käyttää vain ihonalaiseen antoon eikä laskimonsisäiseen infuusioon.
steriiliyttä ja tarkkaa annostusta ei voida taata, jos injektiopulloja ei käytetä annoksen ja annostelun mukaisesti.
käyttämättä jäänyt annos on hävitettävä kerta-annoksen jälkeen.
tavallinen ihonalainen Terbutaliinisulfaattinjektioannos on 0, 25 mg annettuna olkavarren lateraalialueelle. Jos merkittävää kliinistä paranemista ei tapahdu 15-30 minuutin kuluessa, voidaan antaa toinen 0, 25 mg: n annos. Jos vastetta ei saada 15-30 minuutissa, on harkittava muita hoitotoimenpiteitä. Kokonaisannos 4 tunnin kuluessa ei saa ylittää 0, 5 mg: aa.
Huomautus: parenteraaliset lääkevalmisteet on tarkastettava silmämääräisesti hiukkasten ja värimuutosten varalta ennen annostelua aina, kun liuos ja pakkaus sen sallivat.
miten terbutaliini toimitetaan
TERBUTALIINISULFAATTI-injektio, USP, 1 mg / mL, toimitetaan 1 mL: n tilavuutena 2 mL: n ruskeassa lasisessa injektiopullossa. Yksi injektiopullo sisältää 1 mg Terbutaliinisulfaattia 1 mL: ssa liuosta; 0, 25 mL liuosta vastaa tavanomaista 0, 25 mg: n kliinistä annosta.
NDC 0143-9375-10 kotelo, jossa 10 injektiopulloa.
säilytä 20° C-25°C (68° – 77°F) .
suojaa valolta säilyttämällä injektiopulloja alkuperäispakkauksessa annosteluun asti.
älä käytä liuosta, jos se on värjäytynyt.
käyttämättä jäänyt annos on hävitettävä kerta-annoksen jälkeen.
valmistanut:
HIKMA FARMACÊUTICA (PORTUGAL), S. A..
Estrada do Rio da mó, nº 8, 8A e 8B-Fervença,
2705-906 Terrugem SNT,
Portugali
jakelija:
Hikma Pharmaceuticals USA Inc.
Eatontown, NJ 07724 USA
Novaplus on vizient, Inc: n rekisteröity tavaramerkki.
tarkistettu: Lokakuu 2020
PIN552-NOV/2
pääasiallinen näyttöpaneeli
NDC 0143-9375-01 RX ONLY
terbutaliini
sulfaatti
injektio, USP
1 mg/mL
ihon alle
Käytä vain

pääasiallinen näyttöpaneeli
NDC 0143-9375-10 RX vain
terbutaliini
sulfaatti
injektio, USP
1 mg/ml
ihon alle
Käytä vain
10 x 1 ml kerta-annoksen injektiopulloa
steriiliä, nonpyrogeenista, vesipitoista
liuosta ihon alle injektiota varten.
älä käytä liuosta, jos se on värjäytynyt.
Huomaa: tavallinen kerta-annos on neljäsosa
injektiopullon sisällöstä. SEE PRESCRIBING
INFORMATION.
SERIALIZATION IMAGE
| Terbutaline SULFATE Terbutaline sulfate injection |
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
Labeler – Hikma Pharmaceuticals USA Inc. (001230762)
Registrant – HIKMA FARMACEUTICA (PORTUGAL), S. A. (452742943)
Hikma Pharmaceuticals USA Inc.
lisää terbutaliinista
- haittavaikutukset
- annostustiedot
- Huumekuvat
- lääkkeiden yhteisvaikutukset
- hinnoittelu&kuponkeja
- huumeluokka: adrenergiset bronkodilataattorit
- FDA: n hälytykset (1)
raskauden tai imetyksen aikana
vertaa vaihtoehtoja
11 arvostelua
Consumer resources
- potilastiedot
- terbutaliini (Advanced Reading)
- terbutaliini ihonalainen (Advanced Reading)
Ammattiresurssit
terbutaliini (Professional Patient Advice)
hoito-ohjeet
- ennenaikainen synnytys
- allerginen astma
astma, akuutti
lääketieteellinen vastuuvapauslauseke