proteiinin primäärirakenne määritellään niiden aminohappojen jaksoksi, joista se koostuu. Tämä sekvenssi määrittää Viime kädessä muodon, jonka proteiini omaksuu, proteiinin atomien järjestelyn, aminohappojäämien kemiallisten ominaisuuksien ja proteiinin ympäristön maantieteellisten rajoitusten mukaan.
polypeptidin aminohappojäämiä yhdistävät peptidisidokset muodostuvat kondensaatioreaktiossa yhden aminohapon happaman karboksyyliryhmän ja toisen aminohapon emäksisen aminoryhmän välillä. Peptidin yhteydessä amidiryhmää (CO–NH) kutsutaan peptidiryhmäksi.
proteiinin rakenteen ymmärtämisen kannalta olennaista on peptidisidoksen rakenteen tuntemus. Linus Pauling tutki 1930-luvulla röntgendiffraktiolla kahden aminohapon välille muodostuneen peptidisidoksen luonnetta. Hän kertoi, että peptidiryhmällä (CO–NH) on jäykkä tasomainen rakenne. Tämä rakenne johtuu karbonyyliryhmän kaksoissidoksen elektronien ja C–N-sidoksen elektronien välisistä vuorovaikutuksista (kuva 2) siten, että jälkimmäinen saa osittaisia (noin 40%) kaksoissidoksen ominaisuuksia.

tämä efekti on esimerkki resonanssista, jonka voidaan ajatella jakavan elektroneja sidosten välillä. Koska kahden atomin väliset yksittäiset sidokset ovat pitempiä kuin samojen kahden atomin väliset kaksoissidokset, peptidiryhmän C–N-ja C=O-sidosten pituudet poikkeavat näiden sidosten pituuksista muissa yhteyksissä, joissa resonanssia ei esiinny. Näin C–n: n osittainen kaksoissidos peptidiryhmässä tarkoittaa, että tämä sidos on lyhyempi kuin mitä ennustettaisiin C–n: n yksittäiselle sidokselle, kun taas C=O-sidos, jolla on resonanssin vuoksi osittainen yksittäinen sidos, on pidempi kuin mitä ennustettaisiin c=O-kaksoissidokselle. Sidoksen pituudet peptidiryhmässä on esitetty kuvassa 3. Vertaa peptidiryhmän C-N-sidosta N: n ja Ca: n väliseen sidokseen (C-atomi, johon aminoryhmä ja karboksyyliryhmä ovat kiinnittyneet).

planaarisella peptidisidoksella on kaksi mahdollista konformaatiota: transpeptidiryhmässä Ca-atomit ovat peptidisidoksen vastakkaisilla puolilla (Kuva 3a) ja cis-peptidiryhmässä Ca-atomit ovat peptidisidoksen samalla puolella (kuva 3b).
-
kun otetaan huomioon peptidisidoksen cis-ja trans-konformaatioiden atomien avaruudellinen järjestely ja läheisyys, kumpaa konformaatiota mielestänne suosittaisiin?
-
trans-konformaatio olisi energeettisesti suotuisampi kuin cis-konformaatio, koska se minimoi steerisen esteen.
yleisesti ottaen peptidisidokset ovat trans-konformaatiossa. CIS-muotoja voi kuitenkin esiintyä proliinijäämää edeltävissä peptidisidoksissa. Tällöin cis-muoto on tavallista vakaampi, koska proliinisivuketju tarjoaa vähemmän estettä. CIS-peptidisidoksia esiintyy kuitenkin vain noin 10 prosentissa proliinijäämiä edeltävistä peptidisidoksista.
kun otetaan huomioon peptidiryhmän tasomainen luonne, polypeptidiketjulla voidaan nähdä olevan selkäranka, joka koostuu sarjasta jäykkiä tasomaisia peptidiryhmiä, joita Ca-atomit yhdistävät toisiinsa. Kuvassa 4 on osa polypeptidistä, jossa on kaksi planaarista peptidiryhmää trans-konformaatiossa. Huomaa, että vaikka pyöriminen ei ole sallittua peptidisidosten suhteen, on mahdollista kiertyä Ca–N–ja Ca-C-sidosten ympärillä. Näiden sidosten kiertokulmat, joita kutsutaan torsiokulmiksi , määrittelevät polypeptidin selkärangan konformaation. Ca–N–ja Ca-C-sidosten välisiä vääntökulmia kutsutaan nimillä ɸ (phi) ja ψ. (psi), ja ne määritellään 180°, kun polypeptidi on laajennetussa planaarisessa konformaatiossa, kuten kuvassa 4 esitetään.
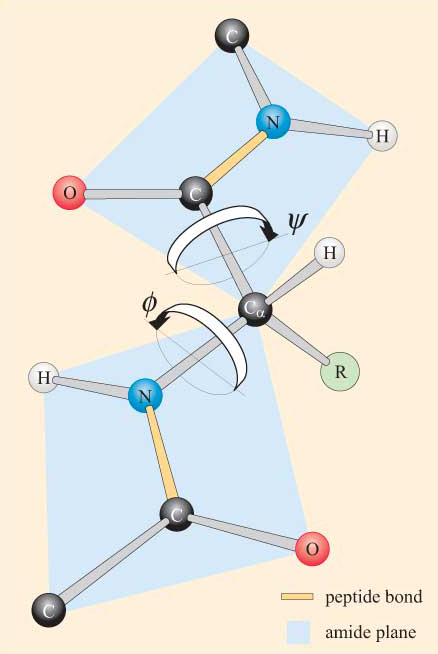
et ylläty kuullessasi, että steeriset rajoitteet koskevat ɸ Ja ψ.
näiden steeristen rajoitteiden seurauksena vain tietyt arvot ɸ Ja ψ ja siten peptidin konformaatiot ovat sallittuja, kun taas toiset eivät.
on mahdollista laskea nämä sallitut arvot tietylle jäämälle polypeptidin yhteydessä. Tämä laskenta suoritetaan määrittämällä ensin kahden vierekkäisen peptidiryhmän (kuten kuvan 4) kaikkien sitoutumattomien atomien väliset etäisyydet kaikilla mahdollisilla arvoilla ɸ ja ψ. Se tehdään helpoimmin polypeptidille, joka sisältää vain yhdenlaista aminohappoa. Konformatiivinen juoni ɸ vastaan ψ tietylle jäännökselle tunnetaan Ramachandranin juonena (sen keksijän G. N. Ramachandranin mukaan). Tällaisen kaavion avulla voidaan tunnistaa ne konformaatiot (eli tietyn arvon ɸ Ja ψ), jotka ovat sterikaalisesti suotuisia tai epäedullisia (kuten kuvassa 5) seuraavien kriteerien mukaan:
-
Jos ei ole ristiriitaa sitoutumattomien atomien van der Waalsin säteiden välillä, konformaatio on ”sallittu”. Nämä konformaatiot sijaitsevat kuvan 5 sinisillä alueilla.
-
Konformaatiot, jotka vaativat atomien välisiä etäisyyksiä sallitulla rajalla, määritellään ”ulkorajojen konformaatioiksi”. Ne sijaitsevat viheralueilla Kuvassa 5.
-
teoreettiset konformaatiot, jotka edellyttävät minkä tahansa kahden sitoutumattoman atomin olevan lähempänä toisiaan kuin niiden van der Waalsin säteet sallivat, ovat sterikaalisesti ”kiellettyjä”. Nämä sijaitsevat valkoisilla alueilla Kuvassa 5.
huomaa, että ɸ: n ja ψ: n arvot Kuvassa 5 vaihtelevat −180º: sta +180º: een. Peptidiryhmän kääntäminen 360º: n läpi tuo tietenkin sen takaisin lähtöasentoonsa, ja −180º ja +180º vastaavat samaa asentoa. Näin vihreä kaistale vasemmassa alakulmassa tontin Kuvassa 5 on vierekkäin kentän vasemmassa yläkulmassa.

-
käytä kuviota 5 määrittääksesi, ovatko seuraavat ɸ: ɸ = 90º ja ψ = 90º; b) ɸ = −90º ja ψ = 90º.
-
(a) kielteinen; B) myönteinen.
Ramachandranin käyrät voidaan konstruoida kunkin 20 aminohapon polymeereille. On huomattava, että monien aminohappojäämien ramachandranin käyrät ovat yleensä hyvin samankaltaisia, sillä niillä on vain kolme aluetta, joilla on suotuisat tai siedetyt konformaatiot (merkitty 1-3 kuviossa poly-l-alaniinille). Eroja kuitenkin esiintyy. Jos esimerkiksi sivuketju (Kuvassa 4 R) haarautuu lähellä Ca: ta, kuten treoniinin tapauksessa, se vie enemmän tilaa peptidin selkärangan lähellä ja rajoittaa viereisten peptidiryhmien atomien lähestymistä. Tämän vuoksi haarautuneiden aminohappojen polypeptideillä sallitut konformaatiot (ɸ Ja ψ-kulmat) ovat rajoitetumpia.
-
proliini eroaa muista aminohapoista myös sallittujen konformaatioiden suhteen ja polyproliinille vain ɸ arvot −85º − – 35º ovat siedettyjä. Kun ajatellaan proliinin rakennetta, miten voidaan selittää tämä suhteellisen kapea sallittujen ɸ arvojen alue?
-
proliinin sivuketju on kovalenttisesti sitoutunut aminoryhmän N: ään, joten polyproliinissa on vähemmän kiertovapautta Ca-N–sidoksen ympärillä kuin muilla aminohapoilla. Näin ollen sallitut ɸ-arvot ovat suhteellisen vähäisiä verrattuna muihin aminohappoihin.
-
kuvassa 6 esitetään Ramachandranin kuvaaja glysiinijäämille polypeptidiketjussa. Alueet on värikoodattu kuten kuvassa 5. Mitä voit sanoa konformaatioista, jotka glysiini hyväksyy? Tarkastellaan glysiinin rakennetta. Miksi glysiini eroaa muista jäämistä konformaatioidensa suhteen?
-
glysiinillä on paljon suurempi konformaatiovapaus kuin muilla aminohappotähteillä, koska se on vähemmän steerisesti estynyt.

kuvien 5 ja 6 Ramachandranin käyrät on luotu l-alaniinille ja L-glysiinille atomien välisten kontaktien sallittujen ja ulkorajojen etäisyyksien perusteella, jotka on määritetty atomien van der Waalsin säteiden tunnetuista arvoista (Taulukko 1).
Taulukko 1 Van der Waalsin etäisyydet atomien välisille kontakteille.
| kontaktityyppi | normaalisti sallittu/Å | ulkoraja/Å | |
|---|---|---|---|
| H···H | 2,0 | 1.9 |
3, 0 |
ne ovat siis ennemminkin ennustavia kuin varsinaisia konformaatiokokeiluja. Röntgendiffraktiolla voidaan tietenkin määrittää kokeellisesti polyp: n ja ψ: n ”todelliset” arvot polypeptidin jäämille. Kuvassa 7 kaikkien jäämien (glysiiniä ja proliinia lukuun ottamatta) ɸ-Ja ψ-arvot useissa eri rakenteissa on määritetty korkean resoluution röntgendiffraktiolla ja piirretty Ramachandranin kuvioon. Voimme nähdä, että ennustettujen ja todellisten konformaatioiden välillä on silmiinpistävä vastaavuus. Huomaa kuitenkin, että on olemassa joitakin jäämiä, joiden konformaatiot kartoittavat ’kielletyt’ alueet. Suurin osa näistä jäämistä sijoittuu ”sallittujen” alueiden 2 ja 3 väliselle alueelle, noin ψ = 0.

-
katso uudelleen kuvaa 4 ja kuvittele, että voit vääntää ylimmän peptidiryhmän 180°: n kautta niin, että ψ = 0. Mitkä ryhmät ovat todennäköisesti ristiriidassa tässä konformaatiossa?
-
vierekkäisten peptidiryhmien N–H-ryhmät ovat ristiriidassa keskenään, koska ne pakotetaan läheisyyteen.
näihin konformaatioihin liittyvä ristiriita mahtuu peptidisidoksen pieneen kiertymiseen. Näin tällaisissa konformaatioissa peptidiryhmä kiertyy pois tavanomaisesta planaarisesta konformaatiostaan.
rajoitettu määrä tiettyjen jäämien ”kiellettyjä” konformaatioita voidaan suvaita polypeptidissä, jos hyväksytty konformaatio on kokonaisuudessaan energeettisesti suotuisa. Polypeptidi pyrkii taittumaan siten, että se hyväksyy vakaimman konformaation. Tässä konformaatiossa polypeptidi minimoi vapaan energiansa. Seuraavissa jaksoissa tarkastelemme tätä korkeampaa valkuaisainerakennetta.