
lämpötila ja paine. Se on yhtä suuri kuin aineen molekyylimassa (M) jaettuna sen tiheydellä (ρ) annetussa lämpötilassa ja paineessa: 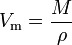
sen SI-yksikkö on kuutiometriä moolia kohti (m3/mol). Moolimäärät ilmoitetaan kuitenkin usein kuutiometreinä 1 000 moolia kohti (m3/kmol) tai kuutiodesimetrinä molia kohti (dm3/mol) kaasujen osalta ja senttimetreinä moolia kohti (cm3/mol) nesteiden ja kiinteiden aineiden osalta.
Jos aine on seos, joka sisältää N-komponentteja, moolitilavuus lasketaan käyttämällä:
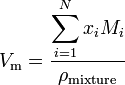
missä x I on i: nnen komponentin mooliosuus, M i on i: nnen komponentin molekyylimassa ja pmixture on seoksen tiheys annetussa lämpötilassa ja paineessa.
ilmoitettaessa moolitilavuuksien numeerisia arvoja on tärkeää ilmoittaa myös annetut lämpötilan ja paineen olosuhteet. Muuten numeeriset arvot ovat merkityksettömiä.
Ideaalikaasut
ideaalikaasun lain yhtälö voidaan järjestää uudelleen siten, että ideaalikaasun moolitilavuudelle saadaan tämä lauseke:
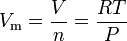
missä SI-yksiköissä:
= kaasu absoluuttinen paine, in pa
= mooliluku, mol
= kaasun moolitilavuus, in m3/mol
= kaasun absoluuttinen lämpötila, in K
= yleinen kaasulakivakio 8,314472 m3·pa·mol-1·K-1
missä Yhdysvaltain tavanomaisissa yksiköissä:
= kaasun absoluuttinen paine psiassa
= mooliluku lb-molissa
= kaasun moolitilavuus ft3/lb-mol
= kaasun absoluuttinen lämpötila, asteina Rankiini (°R)
= yleinen kaasulakivakio 10,7316 ft3·PSIA·lb-mol-l·°r-1
esimerkkilaskelmat ideaalikaasun moolimääristä:
- si-metrisinä yksikköinä:
VM = 8,314472 × 273,15 / 101,325 = 0,022414 m3/mol 0 °C: ssa ja 101,325 pa: n absoluuttinen paine = 22,414 m3/kmol 0 °C: ssa (273,15 K) ja 101.325 kPa absoluuttinen paine Vm = 8.314472 × 273.15 / 100,000 = 0.022711 m3/kmol 0 °C: ssa ja 100,000 Pa absoluuttinen paine = 22.711 m3/kmol 0 °C: ssa (273.15 K) ja 100 kPa absoluuttinen paine
- tavanomaisissa USA: n yksiköissä:
vm = 10.7316 × 519.67 / 14.696 = 379.48 ft3/lb-mol at 60 °f (519.67 °R) ja 14.696 PSIA
Huom:
- lb-mol on lyhenne sanoista Pound-Mol
- °r on astetta Rankine (absoluuttinen lämpötila-asteikko) ja °F on astetta Fahrenheit (lämpötila-asteikko).
- °R = °F + 459.67
- tekninen kirjallisuus voi olla hämmentävää, koska jotkut kirjoittajat eivät useinkaan pysty selittämään, käyttävätkö he yleistä kaasulain vakiota R, joka koskee mitä tahansa ideaalikaasua, vai käyttävätkö he erityistä kaasulain vakiota Rs, joka koskee vain tiettyä yksittäistä kaasua. Kahden vakion välinen suhde on RS = R / M, jossa M on kaasun molekyylimassa.
Reaalikaasut
Reaalikaasut ovat niitä kaasuja, joilla ei ole ideaalikaasukäyttäytymistä. Tällaisille kaasuille yksinkertaisin tapa määrittää moolitilavuudet on käyttää puristuvuuskertoimia kuten seuraavassa lausekkeessa:
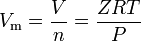
missä Z on kaasun puristuvuuskerroin, joka on käyttökelpoinen termodynaaminen ominaisuus ideaalikaasulain muuttamisessa reaalikaasujen käyttäytymisen huomioon ottamiseksi. Yllä oleva yhtälö on periaatteessa yksinkertainen valtion yhtälö (EOS). Tämän tilayhtälön suurin rajoitus on se, että kaasun kokoonpuristuvuuskerroin Z ei ole vakio, vaan se vaihtelee kaasusta toiseen sekä tarkasteltavan kaasun lämpötilan ja paineen mukaan.
tarkemmat arvot reaalikaasun moolimäärille voidaan saada käyttämällä tilan yhtälöitä, kuten vuonna 1873 kehitettyä van der Waalsin yhtälöä, vuonna 1949 kehitettyä Redlichin-Kwongin yhtälöä, vuonna 1972 kehitettyä Soave-Redlichin-Kwongin yhtälöä ja vuonna 1976 kehitettyä Peng-Robinsonin yhtälöä.
- 1, 0 1.1 International Union of Pure and Applied chemistry (IUPAC): Quantities, Units and Symbols in Physical Chemistry 2nd Edition, 1993
- 2.0 2.1 NIST Guide to SI kohta 8.6.3 in Section 8
- 3.0 3.1 Determination of gas compressibility values Information on how to determinate gas compressibility factors and Mool volumes.
| |
Osa tämän sivun sisällöstä on saattanut aiemmin ilmestyä Citizendium-sivustolla. |