Jos olet joskus tutkinut alkuaineiden jaksollista järjestelmää (Katso alla), olet luultavasti jo tietoinen siitä, että tämä taulukko paljastaa paljon maailmamme muodostavien atomien kemiallisista ominaisuuksista.
mutta et ehkä ymmärrä, että jokainen jaksollisen järjestelmän neliö edustaa todellisuudessa isotooppiperhettä — atomeja, joilla on sama nimi ja kemialliset ominaisuudet, mutta eri massat.
ymmärtääksemme, mitä isotoopit ovat ja miten niitä voidaan käyttää, meidän on tarkasteltava lähemmin atomin sisusta.

aineen rakennuspalikat
atomi koostuu protoneista ja neutroneista koostuvasta uskomattoman tiheästä ytimestä, jota ympäröi diffuusi elektronipilvi.
protonit ja neutronit voidaan ajatella samanlaisiksi hiukkasiksi, joilla on yksi keskeinen ero: protonit ovat positiivisesti varautuneita, kun taas neutronit eivät kanna varausta. Tämä tarkoittaa, että protonit voivat” tuntea ” sähkö-tai magneettikentän, kun taas neutronit eivät.
elektronit, jotka ovat paljon kevyempiä kuin protonit tai neutronit, kantavat saman suuruista varausta kuin protoni, mutta vastakkaisella merkillä, eli jokainen atomi, jolla on yhtä monta protonia ja elektronia, on sähköisesti neutraali.
elektronit määräävät tietyn alkuaineen kemiallisen käyttäytymisen.

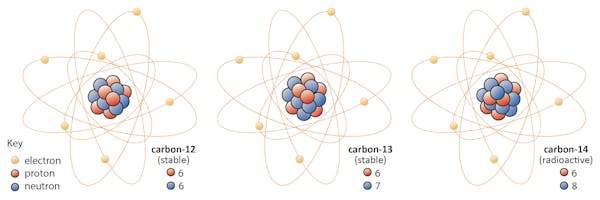
alkuaineen isotoopeilla on sama määrä protoneja, mutta niillä on eri määrä neutroneja. Käytetään esimerkiksi hiiltä.
luonnossa esiintyy kolme hiilen isotooppia: hiili – 12, hiili-13 ja hiili-14. Kaikilla kolmella on kuusi protonia, mutta niiden neutroniluvut – 6, 7 ja 8 – eroavat toisistaan. Tämä tarkoittaa, että kaikilla kolmella isotoopilla on eri atomimassat (hiili-14 on raskain), mutta niillä on sama järjestysluku (Z=6).
kemiallisesti kaikki kolme ovat erittelemättömiä, koska elektronien lukumäärä näissä kolmessa isotoopissa on sama.
saman alkuaineen eri isotoopit ovat siis identtisiä, kemiallisesti puhuen. Joillakin isotoopeilla on kuitenkin kyky kiertää tämä sääntö muuntumalla kokonaan toiseksi alkuaineeksi.
Marssi kohti vakautta
tämä eräiden isotooppien muuntautumiskyky liittyy siihen, että kaikki isotoopit eivät ole stabiileja, ja juuri tämä johti Frederick Soddyn Nobel-palkittuun isotooppilöytöön vuonna 1913.
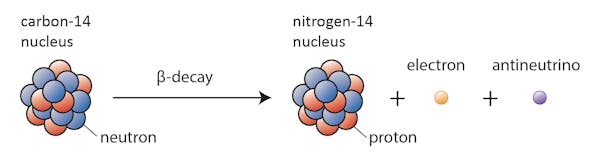
jotkin isotoopit – kuten hiili-12 – jatkavat onnellisesti olemassaoloaan hiilenä, ellei jotain poikkeuksellista tapahdu. Toiset-sanotaan hiili-14-hajoavat jossain vaiheessa lähellä olevaksi pysyväksi isotoopiksi.
tällöin yksi hiili-14: n neutroneista muuttuu protoniksi, jolloin muodostuu typpi-14. Tämän beetahajoamisena tunnetun prosessin aikana ydin säteilee elektronin ja antineutriinin muodossa.
on monia tekijöitä, jotka voivat aiheuttaa tuman hajoamisen. Yksi tärkeimmistä on protonien ja neutronien suhde tiettyyn ytimeen. Jos ytimessä on liikaa neutroneja (”liian monta” määritelmä riippuu siitä, kuinka raskas ydin on), on mahdollista, että se hajoaa kohti vakautta.
sama pätee, jos ytimessä on liikaa protoneja. Tämä on yksi syy siihen, miksi jotkut tietyn alkuaineen isotoopit ovat radioaktiivisia, kun taas toiset eivät.
tähtien vatsoista
voi jo ihmetellä, miten kaikki nämä isotoopit ylipäätään syntyivät. Kuten on käynyt ilmi, tämä kysymys on monimutkainen, mutta lainaa jonkin verran totuutta sanontaan, että olemme kaikki tehty tähtipölystä.
osa kevyemmistä isotoopeista muodostui hyvin varhain maailmankaikkeuden historiassa, alkuräjähdyksen aikana. Toiset ovat seurausta tähtien sisällä tapahtuvista prosesseista tai ilmakehässämme tapahtuvista erittäin energisten ytimien – joita kutsutaan kosmisiksi säteiksi – sattumanvaraisista törmäyksistä.
useimmat luonnossa esiintyvät isotoopit ovat pitkän ydinreaktioiden ja hajoamisten sarjan tuloksena syntyvä lopullinen (stabiili tai pitkäikäinen) tuote.
useimmissa näistä tapauksista kevyiden ytimien on täytynyt iskeä yhteen riittävän suurella energialla, jotta vahva voima – liimamainen sidos, joka muodostuu protonien ja neutronien päästessä tarpeeksi lähelle kosketusta-voittaa sähkömagneettisen voiman – joka työntää protoneja erilleen. Jos vahva voima voittaa, törmäävät ytimet sitoutuvat yhteen eli sulautuvat muodostaen raskaamman ytimen.
aurinkomme on tästä hyvä esimerkki. Yksi sen tärkeimmistä voimanlähteistä on sarja fuusioreaktioita ja beetahajoamisprosesseja, jotka muuttavat vedyn heliumiksi.

tiedon muuttaminen työkaluiksi
1900-luvun alusta lähtien, jolloin isotooppien olemassaolo huomattiin ensimmäisen kerran, ydinfyysikot ja kemistit ovat etsineet tapoja tutkia, miten isotooppeja voidaan muodostaa, miten ne hajoavat ja miten niitä voitaisiin käyttää.
on käynyt ilmi, että isotooppien luonne – niiden kemiallinen yhdenmukaisuus, niiden ydinominaisuus – tekee niistä hyödyllisiä monenlaisissa sovelluksissa niinkin erilaisilla aloilla kuin lääketieteessä, arkeologiassa, maataloudessa, sähköntuotannossa ja kaivostoiminnassa.
Jos sinulle on joskus tehty PET-kuvaus, olet hyötynyt tiettyjen isotooppien (joita usein kutsutaan lääketieteellisiksi isotoopeiksi) radioaktiivisen hajoamisen sivutuotteesta. Tuotamme näitä lääketieteellisiä isotooppeja käyttämällä tietoamme ydinreaktioiden etenemisestä, käyttäen apuna ydinreaktoreita tai kiihdyttimiä, joita kutsutaan syklotroneiksi.
mutta olemme myös löytäneet tapoja hyödyntää luonnossa esiintyviä radioaktiivisia isotooppeja. Esimerkiksi hiili-iänmäärityksessä käytetään pitkäikäistä hiili-14-isotooppia sen määrittämiseksi, kuinka vanhoja esineet ovat.
normaalioloissa ilmakehässämme syntyy hiili-14: ää kosmisissa sätereaktioissa typpi-14: n kanssa. Sen puoliintumisaika on noin 5 700 vuotta, mikä tarkoittaa, että puolet hiili-14: n määrästä on hajonnut pois tuossa ajassa.

eliön eläessä se ottaa noin yhden hiili-14-isotoopin jokaista biljoonaa stabiilia hiili-12-isotooppia kohti ja hiili-12-hiili-14-suhde pysyy suunnilleen samana eliön eläessä. Kun se kuolee, Uusi hiilen saanti pysähtyy.
tämä tarkoittaa hiili-14: n ja hiili-12: n muutosten suhdetta tämän eliön jäännöksissä ajan kuluessa.
Jos otamme näytteestä hiiltä kemiallisin menetelmin, Voimme käyttää AMS-menetelmää (accelerator mass spectrometry) yksittäisten hiilen isotooppien erottamiseksi toisistaan painon mukaan.
AMS käyttää hyväkseen sitä, että kiihdytetyt hiukkaset, joilla on sama varaus mutta eri massat, seuraavat erillisiä polkuja magneettikenttien läpi. Käyttämällä näitä erillisiä polkuja voimme määrittää isotooppisuhteet uskomattomalla tarkkuudella.
kuten näistä esimerkeistä näkyy, sovellamme isotooppitietoamme monin eri tavoin. Me tuotamme niitä, havaitsemme ne, erotamme ne ja tutkimme niitä kaksitahoisena tarkoituksenamme ymmärtää, miksi atomiydin käyttäytyy niin ja miten voimme valjastaa sen voiman hyödyksemme.