lihasjännitys
Luustolihas on kehon suurin kudos. Se on erittäin muovia ja voi käydä läpi dramaattisia ei-patologisia heilahteluja sekä massassa että lujuudessa vastauksena lukemattomiin ympäristövaikutuksiin. Resistenssiharjoituksen tai anabolisille steroideille altistumisen jälkeen lihakset käyvät läpi hypertrofian ja lisäävät sen massaa, poikkipinta-alaa ja voimaa (Aagaard, 2004; Schiaffino ym., 2013). Nämä samat parametrit voivat vähentyä äkisti, kun lihakset aloittavat atrofian vastauksena mihin tahansa loukkauksiin, jotka sisältävät: nälkiintyminen, denervaatio, immobilisaatio, sepsis, syöpä kakeksia, sydämen vajaatoiminta, diabetes, munuaisten vajaatoiminta, krooninen obstruktiivinen keuhkosairaus ja hankittu immuunipuutos oireyhtymä (Schiaffino et al., 2013).
surkastumisen seurauksilla on ilmeisiä vaikutuksia terveyteen. Lihasheikkous vaikuttaa merkittävästi sekä kuolleisuuteen että sairastuvuuteen, ja se liittyy kaikkien kuolemansyiden suurentuneeseen riskiin (Metter ym., 2002). Itse asiassa vähentää lihasten atrofiaa syövän kakeksia voi merkittävästi pidentää elämää (Zhou et al., 2010). Myös monet vanhemmat yksilöt kärsivät sarkopeniasta, pitkittyneestä lihasten kuihtumishäiriöstä, joka alkaa tyypillisesti 50-vuotiaana ja johon liittyy noin 1%: n menetys lihasmassasta vuodessa (Woo, 2017). Tämä tarkoittaa sitä, että 80 ikävuoteen mennessä sarkopeeniset ihmiset ovat menettäneet noin 40% lihasmassastaan, mikä on keskeinen tekijä kaatumisten, heikkouden ja hoitokodin sisäänpääsyn kannalta. Näin ollen atrofian mekanismien ja mahdollisten terapeuttisten vasteiden ymmärtäminen on laajaa perus-ja kliinistä kiinnostusta (Ali and Garcia, 2014; Cohen et al., 2015; Ziaaldini et al., 2017).
Myonukleaarinen Domeenihypoteesi
luurankolihas on melko ainutlaatuinen siinä mielessä, että kypsät solut ovat syncytiaalisia ja voivat sisältää satoja tumia. Tämä on välttämätön sopeutuminen, koska yksittäiset lihassyyt voivat olla valtavia, saavuttaa pituudet jopa ~600 mm (23 in) (esim.sartorius lihas; Yang et al., 1998)ja tilavuudet, jotka voivat olla yli 100 000 kertaa suurempia kuin tyypillinen mononukleoitu solu (Bruusgaard et al., 2003). Useiden tumien myötävaikutusta tarvitaan tuottamaan suuria määriä mRNA: ta, jota tarvitaan supistumiskykyisen laitteen tuottamiseen ja ylläpitämiseen tarvittavan ihmeellisen proteiinisynteesin ohjaamiseen (Nevalainen ym., 2013).
sekä lihaksen muovisuus että sen syncytial—organisaatio ovat synnyttäneet kiistan, joka vasta äskettäin näyttää ratkenneen – ”myonuclear domain hypothesis” (Qaisar and Larsson, 2014; Gundersen, 2016; Schwartz et al., 2016). Tämä teoria juontaa juurensa Strassburgerin (1893) ehdottamaan käsitteeseen ”Wirkungssphäre” eli ”vaikutuspiiri”, jossa hän esitti, että Tuma voi tukea vain diskreettiä sytoplasman määrää, mikä määrittää solun koon ylärajat. Tätä periaatetta kehitti edelleen Gregory (2001), joka väitti, että solujen deoksiribonukleiinihappopitoisuus ja tilavuus ovat tiukasti sidoksissa toisiinsa. Luustolihaksen syncytial luonne auttaa näitä soluja voittamaan tämän rajoituksen. Myonukleaarinen domeeni-hypoteesi määrää, että oikean ydin-sytoplasmasuhteen ylläpitämiseksi uusia ytimiä lisätään hypertrofian aikana ja menetetään atrofian myötä.
on olemassa merkittäviä tietoja, jotka osoittavat, että ydinvoiman määrä kasvaa lihasten liikakasvun myötä (Moss, 1968; Cabric and James, 1983; Egner et al., 2016), vaikka joitakin ristiriitoja on edelleen (Murach et al., 2018). Tämä prosessi on ollut intensiivisen tutkimuksen alue ja jotkut taustalla olevat molekyylimekanismit, jotka säätelevät uusien ytimien hankintaa hypertrofian aikana, on määritelty äskettäin (Guerci et al., 2012; Bentzinger ym., 2014; Ross et al., 2018). Nämä supernumeraariset ytimet hankitaan, kun sukujuuriltaan rajoitetut kantasolut, tyypillisesti satelliittisolut, sulautuvat lihassyiden kanssa ja edistävät niiden ytimiä (Brack and Rando, 2012; Bachman et al., 2018). Satelliittisolut sijaitsevat kellarikalvon alla ja sarkolemmassa (Katz, 1961; Mauro, 1961). Ne pysyvät rauhallisina, kunnes joko anaboliset steroidit, kuten testosteroni tai fokaalinen vamma resistenssiharjoituksen jälkeen, jolloin ne palaavat solusykliin ja lisääntyvät (Joubert and Tobin, 1995; Abreu et al., 2017). Osa tytärsoluista sulautuu lihassyyn ja helpottaa sekä korjaamista että kasvua, kun taas toiset pidättävät ja ennallistavat satelliittialtaan (Dumont et al., 2015; Goh and Millay, 2017). Loput ylijäämäsolut läpikäyvät apoptoosin (Schwartz, 2008).
myonukleaaristen domeenihypoteesien kiistanalainen aspekti on väite, että myonukleit häviävät atrofian aikana. On monia interventioita, jotka aiheuttavat atrofiaa eläinmalleissa, mukaan lukien: immobilisaatio, denervaatio ja sepsis (Fitts et al., 1986; Minnaard et al., 2005; O ’ Leary ym., 2012). Kussakin tapauksessa sekä lihaksen poikkipinta-ala (primaarinen määritys) että apoptoottisten solujen esiintyminen kudoksessa (McCall et al., 1998; Smith ym., 2000; Strasser ym., 2000; Alway et al., 2003; McClung ym., 2007; Andrianjafiniony et al., 2010; Guo et al., 2012; Palumbo et al., 2012; Barnes et al., 2015; Cheema et al., 2015; Li et al., 2016; Kletzien et al., 2018). Näissä tutkimuksissa apoptoosia mitataan useilla eri menetelmillä, kuten kaspaasiaktivaatiolla, mitokondrion Endogin vapautumisella tai DNA: n pirstoutumisella . Nämä tutkimukset tarjoavat vakuuttavia tietoja siitä, että apoptoosi kasvaa dramaattisesti atrofian alkuvaiheessa. Esimerkiksi tuoreessa kattavassa tutkimuksessa (Guo et al., 2012), Guo et al. altistettiin hiirille 14 päivän takaruumiin suspensio, hoito, joka johti ~69%: n laskuun lihaksen märkäpainossa ja ~43.8%: n pienenemiseen poikkipinta-alalla suhteessa hallitsemattomaan kontralateraaliseen lihakseen. Kirjoittajat myös kvantifioivat useita apoptoosin markkereita, kuten TUNEL-värjäyksen, kaspaasi – 3-pilkkoutumisen/aktivaation ja DNA: n korjaukseen osallistuvan proteiinin poly(adenosiinidifosfaatti riboosi) polymeraasin (PARP) pilkkoutumisen. Jokainen näistä apoptoosimittareista suureni merkitsevästi takajalka-suspension jälkeen. Vaikka tämän paperin ensisijainen painopiste oli arvioida sähköisen stimulaation positiivista vaikutusta rajoittamalla atrofiaa loukkauksen jälkeen, he ja monet muut tutkijat tulkitsevat tällaisia tietoja, jotka tarjoavat vahvan tuen myonukleaariselle domain-hypoteesille.
solubiologisesta näkökulmasta tumien oletettu häviäminen synkytiaalisessa kudoksessa, kuten luurankolihaksessa, on merkittävä käytännön ongelma. Miten yksittäinen Tuma voi vaarantua niin, että sen perimä tiivistyy nopeasti ja pirstoutuu samalla, kun sen naapurit sinnittelevät ja auttavat ylläpitämään lihassyyn elinkelpoisuutta? Koska apoptoosi välittyy tyypillisesti kaspaasi-nimisen kysteiiniproteaasin aktivaation välityksellä, ei ole selvää, millä mekanismilla voidaan rajoittaa diffusoituvan proteaasin toimintaa tavallisessa sytoplasmassa.
tätä kysymystä on käsitelty epäsuorasti toisessa syncytial solutyypissä, ihmisen syncytiotrofoblastissa, istukkaa ympäröivässä kudoksessa, joka sisältää noin 5 × 1010 tumaa (Mayhew et al., 1999). Kun apoptoosi indusoituu syncytiotrofoblastissa, se etenee aaltona noin 5 mikronia minuutissa, kunnes koko kudos on mukana (Longtine et al., 2012). Synkytiaalisen sytoplasman sisällä ei siis ole ”etuoikeutettuja” alueita ja kaikki ytimet tuhoutuvat lopulta.
yksi keskeisistä haasteista luurankolihaksen apoptoosin analysoinnissa on se, että se on hyvin heterogeeninen kudos, jossa noin puolet sen tumista on lihassyiden ulkopuolella (Schmalbruch and Hellhammer, 1977). Näitä mononukleoituja soluja ovat satelliittisolut, endoteelisolut, fibroblastit, perisyytit ja makrofagit (Tedesco et al., 2010). Näin ollen on hyvin vaikea määrittää, millä puolella sarkolemmaa, ydin sijaitsee, ja siten, onko se todellinen myonukleus.
In Vivo Time-Lapse Imaging of labelled Mouse Muscides
huolimatta suuresta määrästä papereita, jotka osoittavat apoptoosin lihasatrofian aikana, useat kirjoittajat ovat kyseenalaistaneet nämä tulokset (Wada et al., 2002; Zhong et al., 2005; Aravamudan et al., 2006; Gundersen and Bruusgaard, 2008; Duddy et al., 2011; Qaisar and Larsson, 2014). Esimerkiksi käyttämällä eristettyjä lihassyitä in vitro, Duddy et al. totesi, että vaikka lihassyyn määrä väheni ajan myötä, heijastava atrofinen prosessi, määrä myonuklei näytti olevan vakaa (Duddy et al., 2011).
tyylikkäissä kokeissa Gundersen-laboratorio ruiskutti yksittäisiä extensor digitorum longus (EDL) – tai soleus-lihaksia lihassäikeisiin väriaineita, jotka merkitsivät nukutettujen hiirten tumakkeet ja sytoplasman itsenäisesti (Bruusgaard and Gundersen, 2008; Bruusgaard et al., 2010). Näin he pystyivät tunnistamaan jokaisen tuman yksittäisten lihassyiden sisällä In vivo ajan kuluessa ja arvioimaan sen kohtalon. Esimerkiksi EDL-lihakset indusoituivat hypertrofiaan niiden tärkeimpien synergistien ablaatiolla (Bruusgaard et al., 2010). Päivien 6 ja 11 välillä myonukleiin määrä kasvoi noin 54% ja päivien 9 ja 14 välillä poikkipinta-ala kasvoi 35% (kuva 1). Nämä tiedot ovat yhtäpitäviä sen hypoteesin kanssa, että lihakset hankkivat supernumeraarisia ytimiä ennen kuidun merkittävää kasvua hypertrofian aikana.

kuva 1. Myonuklei hankitaan hypertrofian aikana, mutta ei häviä atrofian aikana hiirellä. Micrographs saman EDL lihassyyn ajan jälkeen induktio hypertrofia (ylärivi) ja sitä seuraava induktio atrofia (alarivi). Fluoresenssilla merkittyjä oligonukleotideja käytettiin tumien visualisointiin in vivo. Pisteviivat edustavat sarkolemmaa. Mittakaava = 50 µm. (Mukautettu bruusgaard et al., 2010. Käytetään luvalla Proceedings of the National Academy of Sciences.)
he sitten tutkivat näiden yksilöllisesti tunnistettavien myonukleien kohtaloa samoissa lihassyissä, kun ne indusoitiin atrofiaan. Denervaatio johti noin 50%: n vähenemiseen lihassyyn tilavuudessa, mutta ei myonukleiin menetystä (Kuva 1; Bruusgaard et al., 2010). Atrofisen ärsykkeen puuttuminen ei johtunut atrofisesta ärsykkeestä, koska ne saivat samat tulokset, kun lihakset atrofisoituivat tetrodotoksiinin aiheuttaman hermosalpauksen, takaruumiin suspension, syövän kakeksian tai detrainingin seurauksena (Bruusgaard and Gundersen, 2008; Bruusgaard et al., 2010; Winje et al., 2018a). Itse asiassa tutkimuksensa aikana he tutkivat yli 200 000 yksittäistä myonukleia atrofisissa lihaksissa ja havaitsivat vain 4 TUNEL-positiivista (apoptoottista) ydintä, mikä merkitsee vain ~0,002%: n menetystä tumista (Bruusgaard et al., 2012). Nämä tiedot tukevat vahvasti hypoteesia, jonka mukaan luurankolihasten surkastumiseen ei liity myonukleaarista kuolemaa.
hyönteisten lihas mallina
niin voimakkaita kuin nämä tutkimukset ovat, nisäkäsmallien käyttöön liittyy joitakin rajoituksia. Ensinnäkin ne turvautuvat poikkeuksetta kokeellisiin interventioihin, kuten denervaatioon, lihasten surkastumisen aikaansaamiseksi. Toiseksi kontralateraalista lihasta käytetään tyypillisesti sisäisenä kontrollina, vaikka sekin altistuu joillekin samoille ympäristösignaaleille, kuten stressihormoneille (Bonaldo and Sandri, 2013). Lopuksi luurankolihakset voivat myös käydä läpi ohjelmoidun solukuoleman (PCD) kehityksen aikana, ja nämä mallit harvoin käsittelevät apoptoosin roolia näissä soluissa.
vaihtoehtoinen malli, joka ei kärsi mistään näistä rajoituksista ja joka mahdollistaa lihasytimien tutkimisen sekä atrofian että luonnollisesti esiintyvän PCD: n aikana, on tupakka hawkmoth Manduca sextan intersegmentaalinen lihas (ISM). Ismit koostuvat jättiläismäisistä lihassäikeistä koostuvista levyistä, joissa jokainen solu on noin 5 mm pitkä ja halkaisijaltaan jopa 1 mm (Kuva 2a). Ismit kiinnittyvät vatsan sisäisiin segmentaalisiin rajoihin ja tuottavat sekä toukkien ryömimiskäyttäytymisen että aikuisen koiran eclosionin (syntymisen) käyttäytymisen, kun se pakenee kotelokynsilästä metamorfoosin lopussa.
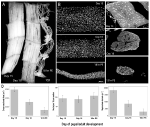
kuva 2. Myonuklein säilyttäminen Manduca sexta-koiran intersegmentaalisten lihasten (ismien) surkastumisen ja kuoleman aikana. (A) ISM: t kolmesta kehitysvaiheesta: homeostaattinen (poikasten ja aikuisten kehitys 15. päivä; vasen); atrofinen (18. päivä; keskimmäinen); ja kuolee (18 h Post-eclosion; oik.). Scale bar vastaa ~1 mm (mukautettu Schwartz et al., 2016). (B) näistä samoista kehitysvaiheista peräisin olevat ismit puhdistettiin ja värjättiin ydinvärillä DAPI ja visualisoitiin konfokaalimikroskopialla (mukautettu Schwartz et al., 2016). C) ISM-kuitulohkot (10 µm) värjättiin ydinvärillä DAPI. Huomaa dramaattinen menetys lihasproteiinin (vaaleanharmaa alue) aikana surkastuminen ja kuolema, mutta säilyttäminen ytimet kaikissa vaiheissa (mukautettu Schwartz et al., 2016). (D) kvantifiointi ISM kuidun tilavuus (vasemmalla), ydin numero (keskellä), ja myonuclear domain koko (oikealla) aikana homeostaasin, atrofia, ja kuolema. (Keskiarvo ± keskivirhe.) (Mukailtu teoksesta Schwartz et al., 2016).
poikasten ja aikuisten normaalin 18 päivän kehityksen 15.päivänä ISM: t aloittavat hormonaalisesti käynnistyvän atrofiaohjelman, joka johtaa 40%: n massahäviöön eklosionin aikaan mennessä 3 päivää myöhemmin (kuva 2a; Schwartz ja Truman, 1983). Tämä dramaattinen menetys lihasmassaa vastaa nähdään 80-vuotias yksilöiden sarkopenia, mutta tapahtuu yli 3 päivää eikä 30 vuotta. Vaikka ismit menettävät massaa, niillä on normaalit fysiologiset ominaisuudet, kuten lepopotentiaali ja voima/poikkipinta-ala (Schwartz and Ruff, 2002). ISM: ää käytetään eklosionikäyttäytymisen tuottamiseen päivän 18 lopussa ja sen jälkeen käynnistämään PCD: tä, jotka molemmat laukaisee peptidihormoni (Schwartz and Truman, 1982, 1983). .
toisin kuin nisäkkäiden lihaksissa ISM: t eivät sisällä hiussuonia, satelliittisoluja, endoteelisoluja tai perisyyttejä, eli käytännössä kaikki kudoksen tumat sijaitsevat itse lihassyiden sisällä (Beaulaton and Lockshin, 1977). Käytimme kaksi riippumatonta menetelmää seurata ydinvoiman kohtaloa sekä atrofian että kuoleman aikana tässä mallissa (Schwartz et al., 2016). Ensimmäinen oli normaali anatominen lähestymistapa. Kun ISM: t surkastuvat ja kuolevat, kuitujen tilavuus ja poikkipinta-ala pienenevät dramaattisesti, mutta ydinluku pysyi muuttumattomana (Kuva 2b). Käyttämällä osioituja kudoksia kvantitatiivisissa tutkimuksissa havaitsimme,että kuidun poikkipinta-ala väheni ~49% atrofian aikana ja edelleen 30% kuoleman alkuvaiheessa (luvut 2C, D; Schwartz et al., 2016). Ydinten määrä ei kuitenkaan muuttunut samana aikana, mikä tarkoitti sitä, että myonukleaarisessa domeenissa oli toiminnallisesti 84% vähennys.
toinen käyttämämme menetelmä oli mitata yksittäisten lihassyiden DNA-pitoisuus eläimistä päivänä 13, jolloin lihakset ovat homeostaattisia, kunnes 18 h eklosionin jälkeen, jolloin lihakset ovat erittäin rappeutuneita (Schwartz et al., 2016). Määritimme 420 yksittäisen solun DNA-pitoisuuden ja totesimme, ettei merkittävää häviötä tapahtunut kehityksen aikana. Nämä biokemialliset analyysit sopivat hyvin yhteen anatomisten tietojen kanssa ja viittaavat siihen, että sekä tumien että genomisen DNA: n suhteellinen pitoisuus kasvoi toiminnallisesti lihasten surkastuessa ja kuollessa. Näin ollen sekä hiiriltä että yöperhosilta saadut tiedot viittaavat siihen, että lihasytimet eivät käy läpi apoptoosia atrofian (tai PCD: n) aikana, ja johtavat johtopäätökseen, että myonukleaarinen domeenihypoteesi olisi hylättävä.
päätelmät
näillä havainnoilla on useita vaikutuksia sekä lihasten perusbiologian ymmärtämiseen että mahdollisten terapeuttisten interventioiden kehittämiseen. Vaikka on olemassa merkittäviä tietoja, jotka raportoivat apoptoottisten tumien esiintymisestä kudoksessa atrofisten loukkausten jälkeen, viimeaikaiset tiedot viittaavat siihen, että nämä eivät ole totta myonuklei, vaan tuomitut mononukleaariset solut, jotka asuvat lihassyyn ulkopuolella. Ensisijainen syy tähän ristiriitaan on se, että apoptoosin havaitsemiseen käytetyillä perinteisillä työkaluilla ei ole tarvittavaa resoluutiota, jotta voitaisiin riittävästi määrittää, millä puolella sarkolemmaa kuoleva solu asuu. Menetelmät, joilla myonuklei merkitään erityisesti, joko fluoresoivien väriaineiden in vivo-injektioilla (Bruusgaard ja Gundersen, 2008)tai geenimanipulaatioilla merkkiproteiinien ilmaisemiseksi (Duddy et al., 2011), paljastaa muutamia jos mitään apoptoottisia ytimiä sisällä merkitty kuidut. Äskettäinen osoitus siitä, että vasta-aineet suunnattu proteiinin Pericentriolar Material 1 (PCM1) etiketti vain aito myonuklei tarjoaa lupaavan työkalun, jota voidaan soveltaa perinteisiin histologisiin materiaaleihin, joita rutiininomaisesti analysoidaan alalla (Winje et al., 2018b).
luustolihasten kykenemättömyys käyttää apoptoosia mekanismina myonukleiin eliminoimiseksi ei ole yllättävää. Näyttää siltä, että kypsä luurankolihas on suurelta osin estetty aloittamasta apoptoosia, koska se lisää voimakkaiden eloonjäämisproteiinien ilmentymistä, kuten X-linkitetty apoptoosiproteiinin estäjä (XIAP) (Smith et al., 2009) ja apoptosis repressor caspase recruitment domainin (Arc) (Xiao et al., 2011), ilmaisten samanaikaisesti apoptoosin välittäjäaineiden, kuten apoptoottisen proteaasin aktivoivan tekijän 1 (Apaf-1), alhaisia pitoisuuksia (Burgess et al., 1999). Tämä on järkevää teleologisesti, koska lihakset ovat alttiita äärimmäisiä häiriöitä, mukaan lukien häiriöitä sarkolemma jälkeen intensiivistä liikuntaa, joten se olisi katastrofaalista, jos ne laukaisevat solukuoleman sijaan aloitettu kudoksen korjaus ja mahdollisesti hypertrofia. Kuten muutkin terminaalisesti erilaistuneet solut, lihakset pyrkivät käyttämään ei-apoptoottisia mekanismeja, erityisesti autofagista PCD: tä (tunnetaan myös nimellä tyypin II degeneraatio) (Clarke, 1990; Schwartz et al., 1993; Kole et al., 2013; Ginet et al., 2014) kun ne kuolevat kehityksen aikana.
vaikka olisikin olemassa mekanismi, jolla lihakset voisivat valikoivasti kohdistaa yksittäisiä tumia, ei ole selvää, että tästä olisi hyötyä. Itse asiassa ”ylijäämäisten” tumien säilyminen atrofian aikana antaa yksilölle selkeän edun, koska luurankolihakset käyvät usein läpi atrofian ja hypertrofian syklejä vastauksena ympäristöolosuhteisiin, kuten ravinnon saatavuuteen. Kyky toipua nopeasti hyödyntämällä ennestään myonuklei voi palvella tärkeää roolia sopeutumisessa (Jackson et al., 2012)ja auttaa selittämään ilmiötä ”lihasmuisti” (Staron et al., 1991; Gundersen, 2016). Liikuntafysiologian alalla on hyvin dokumentoitua, että on paljon helpompaa palauttaa tietty lihaskuntotaso liikunnan avulla kuin saavuttaa se ensimmäinen paikka, vaikka välissä on ollut pitkä irtiotto. Toisissa sanoissa lause ” käytä sitä tai menetä se ”voisi olla täsmällisemmin artikuloitu muotoon” käytä sitä tai menetä se, kunnes työstät sitä uudelleen.”Tämä on osoitettu suoraan toisessa kokeessa Gundersenin laboratoriosta, joka osoitti, että kun lihas on saanut uusia tumia, se säilyttää ne kauan sen jälkeen, kun hypertrofinen ärsyke on poistettu. He indusoivat lihasten liikakasvua naarashiirissä hoitamalla niitä 2 viikon ajan testosteronilla ja tutkivat sitten lihakset 3 viikon kuluttua steroidien vetäytymisestä (Egner et al., 2013). Lihasten tilavuus oli palautunut lähtötasolle, mutta vasta hankitut tumat säilyivät vielä 3 kuukautta myöhemmin. Kun lihakset joutuivat ylikuormitus aloittaa uudelleen hypertrofia, steroidi-käsitellyt niistä nopeasti tehtiin 36% kasvu kuidun tilavuus, kun ohjaus lihakset vain kasvoi 6%. Nämä tiedot viittaavat siihen, että” ylijäämä ” ytimet voitaisiin mobilisoida nopeasti uudelleenkoulutuksen helpottamiseksi.
näillä havainnoilla voi olla vaikutuksia kansanterveyspolitiikkaan. On osoitettu, että lihasten kasvu, fysiologinen toiminta ja regeneratiivinen kapasiteetti kaikki heikkenevät iän myötä, mikä johtuu suurelta osin vähentyneestä satelliittisolujen proliferaatiosta (Blau et al., 2015). Näin ollen, liikunta murrosiässä, kun lihasten kasvua tehostetaan hormonit, ravitsemus ja vankka satelliittiallas, voisi toiminnallisesti palvella yksilöiden ”pankki” myonuklei että voitaisiin käyttää myöhemmin elämässä hidastaa ikääntymisen vaikutuksia ja mahdollisesti estää sarkopenian.
lisäksi näillä tiedoilla on vaikutuksia kilpaurheiluun. Anabolisten steroidien käyttö on voimakas ärsyke lihasten liikakasvuun ja uuden myonuklein lisäämiseen (Egner et al., 2013). Koska nämä ytimet säilyvät pitkään steroidien käytön päättymisen jälkeen, urheilijat todennäköisesti hyötyvät laittomasta huumeiden käytöstä ilman paljastumisriskiä.
yhteenvetona voidaan todeta, että vaikka uusien tumien lisääminen lihaskasvuun on laajalti hyväksytty, atrofiaa sairastavien tumien apoptoottista häviämistä ei voida tukea, mikä viittaa siihen, ettei myonukleaarisen domeenin hypoteesin tiukkaa tulkintaa voida tukea. Sen sijaan näyttää siltä, että kun myonuklei on saatu, se säilyy silloinkin, kun lihas muuttuu atrofiseksi tai aiheuttaa solukuoleman.
Tekijäosuudet
kirjoittaja vahvistaa olevansa teoksen ainoa rahoittaja ja on hyväksynyt sen julkaistavaksi.
Rahoitus
tämän julkaisun hyväksi tehtävää työtä tuettiin Eugene M.: n ja Ronnie Isenbergin Professorirahaston varoilla. Tekijälle ei annettu yritystukea, eikä kaupallisia tuotteita mainita tai vahvisteta.
Eturistiriitalausunto
kirjoittaja vakuuttaa, että tutkimus tehtiin ilman kaupallisia tai taloudellisia suhteita, jotka voitaisiin tulkita mahdollisiksi eturistiriidoiksi.
kiitokset
kirjoittaja haluaa kiittää Christine Brownia avusta tämän käsikirjoituksen laatimisessa ja Eugene M. ja Ronnie Isenbergin Professorilahjoitusta tuesta.
Aagaard, P. (2004). Lihasten tekeminen ”vahvemmiksi”: liikunta, ravitsemus, lääkkeet. J. Musculoskelet. Hermosolu. Vuorovaikutuksessa. 4, 165–174.
PubMed Abstract/Google Scholar
Abreu, P., Mendes, S. V., Ceccatto, V. M., and Hirabara, S. M. (2017). Satelliittisoluaktivaatio, jonka aiheuttaa aerobinen lihassopeutus vastauksena kestävyysliikuntaan ihmisillä ja jyrsijöillä. Life Sci. 170, 33–40. doi: 10.1016 / j.lfs.2016.11.016
PubMed Abstract | CrossRef Full Text/Google Scholar
Ali, S., and Garcia, J. M. (2014). Sarkopenia, kakeksia ja ikääntyminen: diagnoosi, mekanismit ja terapeuttiset vaihtoehdot—mini-katsaus. Gerontologia 60, 294-305. doi: 10.1159 / 000356760
PubMed Abstract / CrossRef Full Text/Google Scholar
Alway, S. E., Martyn, J. K., Ouyang, J., Chaudhrai, A., and Murlasits, Z. S. (2003). Id2 expression during apoptosis and satellite cell activation in unloaded and loaded quail skeletal muscles. Am. J. Physiol. Regul. Integr. Comp. Physiol. 284, R540–R549. doi: 10.1152/ajpregu.00550.2002
PubMed Abstract | CrossRef Full Text | Google Scholar
Andrianjafiniony, T., Dupre-Aucouturier, S., Letexier, D., Couchoux, H., and Desplanches, D. (2010). Oxidative stress, apoptosis, and proteolysis in skeletal muscle repair after unloading. Am. J. Phys. Cell Physiol. 299, C307–C315. doi: 10.1152/ajpcell.00069.2010
PubMed Abstract | CrossRef Full Text/Google Scholar
Aravamudan, B., Mantilla, C. B., Zhan, W. Z., and Sieck, G. C. (2006). Denervaatiovaikutukset rotan kalvokuitujen myonukleaariseen domeenikokoon. J. Appl. Fysiolia. 100, 1617–1622. doi: 10.1152 / japlfysioli.01277.2005
CrossRef Full Text/Google Scholar
Bachman, J. F., Klose, A., Liu, W., Paris, N. D., Blanc, R. S., Schmalz, M., et al. (2018). Prepubertaalinen luurankolihasten kasvu vaatii PAX 7: ää ilmentävän satelliittisoluista peräisin olevan myonukleaarisen osuuden. Kehitys 145:167197.
Google Scholar
Barnes, B. T., Confides, A. L., Rich, M. M., and Dupont-Versteegden, E. E. (2015). Erilliset lihasapoptoottiset reitit aktivoituvat lihaksissa, joissa on eri kuitutyyppejä kriittisen sairauden myopatian rotamallissa. J. Muscle Res. Cell Motil. 36, 243–253. doi: 10.1007 / s10974-015-9410-8
PubMed Abstract | CrossRef Full Text/Google Scholar
Beaulaton, J., and Lockshin, R. A. (1977). Ultrastructural study of the normal degeneration of the intersegmental muscles of Anthereae polyphemus and Manduca sexta (insecta, lepidoptera) with particular reference of cellular autophagy. J. Morphol. 154, 39–57. doi: 10.1002 / jmor.1051540104
PubMed Abstract | CrossRef Full Text/Google Scholar
Bentzinger, C. F., von Maltzahn, J., Dumont, N. A., Stark, D. A., Wang, Y. X., Nhan, K., et al. (2014). Wnt 7a stimuloi myogeenisen kantasolujen liikkuvuutta ja engraftment johtaa parantaa lihasvoimaa. J. Cell Biol. 205, 97–111. doi: 10.1083 / jcb.201310035
PubMed Abstract | CrossRef Full Text/Google Scholar
Blau, H. M., Cosgrove, B. D., and Ho, A. T. (2015). Lihasten kantasolujen keskeinen rooli regeneratiivisessa epäonnistumisessa ikääntymisen myötä. Nat. Med. 21, 854–862. doi: 10,1038/nm.3918
PubMed Abstract | CrossRef Full Text/Google Scholar
Bonaldo, P., and Sandri, M. (2013). Lihasten surkastumisen solu-ja molekyylimekanismit. Tämä. Malli. Mech. 6, 25–39. doi: 10.1242 / dmm.010389
CrossRef Full Text/Google Scholar
Brack, A. S., and Rando, T. A. (2012). Kudospesifiset kantasolut: luustolihassatelliittisolusta saadut kokemukset. Kantasolu 10, 504-514. doi: 10.1016 / J.stem.2012.04.001
PubMed Abstract | CrossRef Full Text/Google Scholar
Bruusgaard, J. C., Egner, I. M., Larsen, T. K., Dupre-Aucouturier, S., Desplanches, D., and Gundersen, K. (2012). Myonukleaarisessa määrässä ei ole muutosta lihasten purkamisen ja uudelleenlastauksen aikana. J. Appl. Fysiolia. 113, 290–296. doi: 10.1152 / japlfysioli.00436.2012
PubMed Abstract / CrossRef Full Text / Google Scholar
Bruusgaard, J. C., and Gundersen, K. (2008). In vivo time-lapse-mikroskoopissa ei havaittu hiiren myonuklein häviämistä viikkojen lihasatrofian aikana. J. Clin. Sijoittaa. 118, 1450–1457. doi: 10.1172/JCI34022
PubMed Abstract | CrossRef Full Text | Google Scholar
Bruusgaard, J. C., Johansen, I. B., Egner, I. M., Rana, Z. A., and Gundersen, K. (2010). Myonuklei hankittu ylikuormitus käyttää edeltää hypertrofiaa ja eivät menetä detraining. Proc. Natl. Acad. Sci. 107, 15111-15116. doi: 10.1073 / pnas.0913935107
CrossRef Full Text / Google Scholar
Bruusgaard, J. C., Liestol, K., Ekmark, M., Kollstad, K., and Gundersen, K. (2003). In vivo tutkittujen normaalien hiirten tumien lukumäärä ja alueellinen jakautuminen lihassäikeissä. J. Fysioli. 551, 467–478. doi: 10.1113 / jphysioli.2003.045328
PubMed Abstract | CrossRef Full Text/Google Scholar
Burgess, D. H., Svensson, M., Dandrea, T., Gronlund, K., Hammarquist, F., Orrenius, S., et al. (1999). Ihmisen luustolihasten sytosolit eivät reagoi sytokromi C: stä riippuvaiseen tyypin II kaspaasien aktivaatioon, ja niistä puuttuu APAF-1. Solukuolemat Vaihtelevat. 6, 256–261. doi: 10.1038 / sj.cdd.4400489
PubMed Abstract | CrossRef Full Text/Google Scholar
Cabric, M., and James, N. T. (1983). Morfometriset analyysit lihaksista harjoituksen koulutettu ja kouluttamaton koiria. On. J. Anat. 166, 359–368. doi: 10.1002 / aja.1001660309
PubMed Abstract | CrossRef Full Text/Google Scholar
Cheema, N., Herbst, A., McKenzie, D., and Aiken, J. M. (2015). Apoptoosi ja nekroosi välittävät luustolihaskudoksen kuidun menetystä iän aiheuttamissa mitokondrion entsymaattisissa poikkeavuuksissa. Vanheneva Solu 14, 1085-1093. doi: 10.1111 / acel.12399
PubMed Abstract | CrossRef Full Text/Google Scholar
Clarke, P. G. (1990). Developmental cell death: morfologinen monimuotoisuus ja useita mekanismeja. Anat. Embryol. 181, 195–213.
Google Scholar
Cohen, S., Nathan, J. A., and Goldberg, A. L. (2015). Lihasten kuihtuminen taudissa: molekyylimekanismit ja lupaavat hoidot. Nat. Rev. Drug Discov. 14, 58–74. doi: 10.1038/nrd4467
PubMed Abstract | CrossRef Full Text | Google Scholar
Duddy, W. J., Cohen, T., Duguez, S., and Partridge, T. A. (2011). Isolated muscle fibre as a model of disuse atrofy: characterization using PhAct, a method to quantifying f-actiin. Käyt.viim. Cell Res. 317, 1979-1993. doi: 10.1016 / j.yexcr.2011.05.013
PubMed Abstract | CrossRef Full Text/Google Scholar
Dumont, N. A., Wang, Y. X., and Rudnicki, M. A. (2015). Satelliittisolun toimintaa säätelevät sisäiset ja ulkoiset mekanismit. Kehitys 142, 1572-1581. doi: 10.1242 / dev.114223
PubMed Abstract | CrossRef Full Text/Google Scholar
Egner, I. M., Bruusgaard, J. C., Eftestol, E., and Gundersen, K. (2013). Solumuistimekanismi auttaa ylikuormituksen hypertrofiaa lihaksissa kauan sen jälkeen, kun episodinen altistuminen anabolisille steroideille. J. Fysioli. 591, 6221–6230. doi: 10.1113 / jphysioli.2013.264457
PubMed Abstract | CrossRef Full Text/Google Scholar
Egner, I. M., Bruusgaard, J. C., and Gundersen, K. (2016). Satelliittisoluvaje ehkäisee kuidun liikakasvua luurankolihaksissa. Kehitys 143, 2898-2906. doi: 10.1242 / dev.134411
PubMed Abstract | CrossRef Full Text | Google Scholar
Fitts, R. H., Metzger, J. M., Riley, D. A., and Unsworth, B. R. (1986). Käytöstä poistetut mallit: Takaluukun jousituksen ja immobilisaation vertailu. J. Appl. Fysiolia. 60, 1946–1953.
Google Scholar
Ginet, V., Pittet, M. P., Rummel, C., Osterheld, M. C., Meuli, R., Clarke, P. G., et al. (2014). Tukehtuneiden vastasyntyneiden ja rottien talamuksen kuolevat neuronit ovat autofagisia. Ann. Neurol. 76, 695–711. doi: 10.1002 / ana.24257
PubMed Abstract | CrossRef Full Text/Google Scholar
Goh, Q., and Millay, D. P. (2017). Myomaker-välitteisen kantasolujen fuusion vaatimus luustolihasten liikakasvussa. elife 6. doi: 10.7554/eLife.20007
PubMed Abstract | CrossRef Full Text/Google Scholar
Gregory, T. R. (2001). Sattuma, koevoluutio vai syy? DNA-pitoisuus, solun koko ja C-arvo arvoitus. Biol. Pastori Camb. Filos. Soc. 76, 65–101. doi: 10.1017 / s1464793100005595
PubMed Abstract | CrossRef Full Text/Google Scholar
Guerci, A., Lahoute, C., Hebrard, S., Collard, L., Grainorge, D., Favier, M., et al. (2012). Myofibereiden tuottamat SRF-riippuvaiset parakriinisignaalit säätelevät satelliitin soluvälitteistä luurankolihasten liikakasvua. Cell Metab. 15, 25–37. doi: 10.1016 / J. cmet.2011.12.001
PubMed Abstract | CrossRef Full Text/Google Scholar
Gundersen, K. (2016). Lihasmuisti ja uusi solumalli lihasten surkastumiseen ja hypertrofiaan. Käyt. Viim. Biol. 219, 235–242. doi: 10.1242 / jeb.124495
PubMed Abstract | CrossRef Full Text/Google Scholar
Gundersen, K., and Bruusgaard, J. C. (2008). Nuclear domains aikana lihasten surkastuminen: ytimet menetetty tai paradigma menetetty? J. Fysioli. 586, 2675–2681. doi: 10.1113 / jphysioli.2008.154369
PubMed Abstract | CrossRef Full Text/Google Scholar
Guo, B. S., Cheung, K. K., Yeung, S. S., Zhang, B. T., and Yeung, E. W. (2012). Sähköstimulaatio vaikuttaa satelliittisolujen proliferaatioon ja apoptoosiin purkamisen aiheuttamassa lihasatrofiassa hiirillä. PLoS yksi 7: e30348. doi: 10.1371 / lehti.pone.0053523
PubMed Abstract | CrossRef Full Text/Google Scholar
Jackson, J. R., Mula, J., Kirby, T. J., Fry, C. S., Lee, J. D., Ubele, M. F., et al. (2012). Satelliittisoluvaje ei estä aikuisen luurankolihaksen uusiutumista purkamisen aiheuttaman atrofian jälkeen. On. J. Phys. Solufysioli. 303, C854–C861. doi: 10.1152 / ajpcell.00207.2012
PubMed Abstract | CrossRef Full Text/Google Scholar
Joubert, Y., and Tobin, C. (1995). Testosteronihoito johtaa leposatelliittisolujen aktivoitumiseen ja värväämiseen solusykliin rotan levator ani-lihaksessa. Dev. Biol. 169, 286–294. doi: 10.1006 / dbio.1995.1144
PubMed Abstract | CrossRef Full Text/Google Scholar
Katz, B. (1961). Sammakon lihassäryssä olevan afferentin hermokuidun Päättyminen. Filos. Trans. R. Soc. Lond. B Biol. Sci. 243, 221–240.
PubMed Abstract/Google Scholar
Kletzien, H., Hare, A. J., Leverson, G., and Connor, N. P. (2018). Ikäsidonnainen solukuoleman vaikutus kuidun morfologiaan ja lukumäärään kielen lihaksissa. Lihashermo 57, E29-E37. doi: 10.1002 / mus.25671
PubMed Abstract | CrossRef Full Text/Google Scholar
Kole, A. J., Annis, R. P., and Deshmukh, M. (2013). Kypsät hermosolut: varustettu selviytymistä varten. Cell Death Dis. 4: e689. doi: 10.1038 / cddis.2013.220
PubMed Abstract | CrossRef Full Text/Google Scholar
Li, T. S., Shi, H., Wang, L., and Yan, C. (2016). Luuytimen mesenkymaalisten kantasolujen vaikutus satelliittisolujen proliferaatioon ja apoptoosiin immobilisaation aiheuttamassa lihasatrofiassa rotilla. Med. Sci. Monit. 22, 4651–4660. doi: 10.12659 / MSM.898137
PubMed Abstract | CrossRef Full Text/Google Scholar
Lockshin, R. A., and Williams, C. M. (1965). Programmed cell death – I. Cytology of degeneration in the intersegmental muscles of the pernyi silkmoth. J. Hyönteisfysioli. 11, 123–133. doi: 10.1016/0022-1910(65)90099-5
PubMed Abstract | CrossRef Full Text/Google Scholar
Longtine, M. S., Barton, A., Chen, B., and Nelson, D. M. (2012). Elävien solujen kuvantaminen osoittaa apoptoosin alkavan paikallisesti ja etenevän aaltona läpi syncytiotrofoblastien ihmisen istukkaviljelmien primaarisissa trofoblastiviljelmissä. Istukka 33, 971-976. doi: 10.1016 / j.istukka.2012.09.013
PubMed Abstract | CrossRef Full Text/Google Scholar
Mauro, A. (1961). Luustolihassyiden satelliittisolu. J. Biophys. Biochem. Cytol. 9, 493–495.
Google Scholar
Mayhew, T. M., Leach, L., McGee, R., Ismail, W. W., Myklebust, R., and Lammiman, M. J. (1999). Proliferaatio, erilaistuminen ja apoptoosi villous trofoblastissa 13-41 raskausviikolla (mukaan lukien havainnot annulate lamellae-ja nuclear huokoskomplekseista). Istukka 20, 407-422. doi: 10.1053 / sija.1999.0399.
PubMed Abstract | CrossRef Full Text/Google Scholar
McCall, G. E., Allen, D. L., Linderman, J. K., Grindeland, R. E., Roy, R. R., Mukku, V. R., et al. (1998). Myonukleaarisen domeenin koon ylläpitäminen soleus-Rotalla ylikuormituksen ja kasvuhormoni/IGF-I-hoidon jälkeen. J. Appl. Fysiolia. 84, 1407–1412.
Google Scholar
McClung, J. M., Kavazis, A. N., DeRuisseau, K. C., Falk, D. J., Deering, M. A., Lee, Y., et al. (2007). Kaspaasi – 3: n säätely pallean myonukleaarisessa domeenissa mekaanisen ilmanvaihdon aiheuttaman atrofian aikana. On. J. Respir. Crit. Care Med. 175, 150–159. doi: 10.1164 / rccm.200601-142oc
PubMed Abstract | CrossRef Full Text | Google Scholar
Metter, E. J., Talbot, L. A., Schrager, M., ja Conwit, R. (2002). Luustolihasvoima kaikkien syiden kuolleisuuden ennustajana terveillä miehillä. J. Gerontol. Biol. Sci. Med. Sci. 57, B359-B365. doi: 10.1093 / gerona / 57.10.B359
PubMed Abstract | CrossRef Full Text/Google Scholar
Minnaard, R., Drost, M. R., Wagenmakers, A. J., van Kranenburg, G. P., Kuipers, H., and Hesselink, M. K. (2005). Luustolihasten kuihtumista ja supistumiskykyinen suorituskykyä septinen rotilla. Lihashermo 31, 339-348. doi: 10.1002 / mus.20268
PubMed Abstract / CrossRef Full Text/Google Scholar
Moss, F. P. (1968). Kuitujen mittojen ja tumien lukumäärän välinen suhde kotieläiminä pidettävien kanojen luurankolihasten normaalin kasvun aikana. On. J. Anat. 122, 555–563. doi: 10.1002 / aja.1001220308
PubMed Abstract | CrossRef Full Text/Google Scholar
Murach, K. A., Englund, D. A., Dupont-Versteegden, E. E., McCarthy, J. J., and Peterson, C. A. (2018). Myonukleaarinen domeeni joustavuus haastaa jäykät oletukset satelliittisolujen osuudesta luurankolihaskuitujen liikakasvuun. Edessä. Fysiolia. 9:635. doi: 10.3389 / fphys.2018.00635
CrossRef Full Text/Google Scholar
Nevalainen, M., Kaakinen, M., and Metsikko, K. (2013). MRNA: n transkriptien jakelu ja käännöstoiminta luurankomyofibereissä. Cell Tissue Res. 353, 539-548. doi: 10.1007 / s00441-013-1659-x
PubMed Abstract | CrossRef Full Text/Google Scholar
O ’ Leary, M. F., Vainshtein, A., Carter, H. N., Zhang, Y., and Hood, D. A. (2012). Denervaation aiheuttama mitokondrioiden toimintahäiriö ja autofagia apoptoosin puutteesta kärsivien eläinten luustolihaksissa. On. J. Phys. Solufysioli. 303, C447-C454. doi: 10.1152/ajpcell.00451.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
Palumbo, C., Rovesta, C., and Ferretti, M. (2012). Striated muscle fiber apoptosis after experimental tendon lesion in a rat model. J. Anat. 221, 358–363. doi: 10.1111/j.1469-7580.2012.01554.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Qaisar, R., and Larsson, L. (2014). What determines myonuclear domain size? Indian J. Physiol. Pharmacol. 58, 1–12.
PubMed Abstract | Google Scholar
Ross, J. A., Levy, Y., Svensson, K., Philp, A., Schenk, S., and Ochala, J. (2018). SIRT1 säätelee luustolihassyiden ydinlukua ja domeenin kokoa. J. Cell. Fysiolia. 233, 7157–7163. doi: 10.1002 / jcp.26542
PubMed Abstract | CrossRef Full Text/Google Scholar
Schiaffino, S., Dyar, K. A., Ciciliot, S., Blaauw, B., and Sandri, M. (2013). Luurankolihasten kasvua ja atrofiaa säätelevät mekanismit. FEBS J. 280, 4294-4314. doi: 10.1111 / febs.12253
PubMed Abstract | CrossRef Full Text/Google Scholar
Schmalbruch, H., and Hellhammer, U. (1977). Tumien määrä aikuisten rotan lihaksissa erityisesti satelliittisoluissa. Anat. Rec. 189, 169–175. doi: 10.1002 / ar.1091890204
PubMed Abstract | CrossRef Full Text/Google Scholar
Schwartz, L. M. (2008). Luustolihaksen surkastuminen ja ohjelmoitu solukuolema. Solukuolemat Vaihtelevat. 15, 1163–1169. doi: 10.1038 / cdd.2008.68
PubMed Abstract | CrossRef Full Text/Google Scholar
Schwartz, L. M., Brown, C., McLaughlin, K., Smith, W., and Bigelow, C. (2016). Myonukleaarinen domeeni ei säily luurankolihaksissa surkastumisen tai ohjelmoidun solukuoleman aikana. On. J. Phys. Solufysioli. 311, C607-C615. doi: 10.1152 / ajpcell.00176.2016
PubMed Abstract | CrossRef Full Text/Google Scholar
Schwartz, L. M., and Ruff, R. L. (2002). Luustolihasten supistumiskykyisten ominaisuuksien muutokset kehitysohjelmoidun atrofian ja kuoleman aikana. On. J. Phys. Solufysioli. 282, C1270-C1277. doi: 10.1152 / ajpcell.01275.2000
CrossRef Full Text / Google Scholar
Schwartz, L. M., Smith, S. W., Jones, M. E., ja Osborne, B. A. (1993). Tapahtuvatko kaikki ohjelmoidut solukuolemat apoptoosin kautta? Proc. Natl. Acad. Sci. USA 90, 980-984.
Google Scholar
Schwartz, L. M., and Truman, J. W. (1983). Hormonaalista säätelyä metamorfisen kehityksen nopeuksista tupakan sarvimadossa Manduca sexta. Dev. Biol. 99, 103–114. doi: 10.1016/0012-1606(83)90257-9
PubMed Abstract | CrossRef Full Text/Google Scholar
Schwartz, L. M., and Truman, J. W. (1982). Peptidi ja steroidi säätely lihasten rappeutumista hyönteisessä. Science 215, 1420-1421. doi: 10.1126 / tiede.6278594
PubMed Abstract | CrossRef Full Text/Google Scholar
Smith, H. K., Maxwell, L., Martyn, J. A., and Bass, J. J. (2000). Nuclear DNA fragmentaatio ja morfologiset muutokset aikuisen kanin luurankolihaksessa lyhytaikaisen immobilisaation jälkeen. Cell Tissue Res. 302, 235-241. doi: 10.1007/s004410000280
PubMed Abstract | CrossRef Full Text | Google Scholar
Smith, M. I., Huang, Y. Y., and Deshmukh, M. (2009). Luustolihasten erilaistuminen herättää endogeenisen XIAPIN rajoittamaan apoptoottista reittiä. PLoS yksi 4: e5097. doi: 10.1371 / lehti.pone.0005097
CrossRef Full Text/Google Scholar
Staron, R. S., Leonardi, M. J., Karapondo, D. L., Malicky, E. S., Falkel, J. E., Hagerman, F. C., et al. (1991). Vahvuus-ja luustolihassopeutukset raskaskestävyyskoulutetuilla naisilla detrainingin ja uudelleenkoulutuksen jälkeen. J. Appl. Fysiolia. 70, 631-640.
Google Scholar
Strassburger, E. (1893). Tumien vaikutuspiiri ja solun koko. Histo Beitr. 5, 97-124.
Google Scholar
Strasser, H., Tiefenthaler, M., Steinlechner, M., Eder, I., Bartsch, G., and Konwalinka, G. (2000). Iästä riippuvainen apoptoosi ja rabdosfincter solujen menetys. J. Urol. 164, 1781–1785. doi: 10.1016/S0022-5347(05)67106-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Tedesco, F. S., Dellavalle, A., Diaz-Manera, J., Messina, G., and Cossu, G. (2010). Luustolihaksen korjaus: luustolihaksen kantasolujen regeneratiivinen potentiaali. J. Clin. Sijoittaa. 120, 11–19. doi: 10.1172 / JCI40373
PubMed Abstract | CrossRef Full Text/Google Scholar
Wada, K. I., Takahashi, H., Katsuta, S., and Soya, H. (2002). Myonukleaarisessa määrässä ei ole laskua pitkän aikavälin denervaation jälkeen täysikasvuisilla hiirillä. On. J. Phys. Solufysioli. 283, C484-C488. doi: 10.1152 / ajpcell.00025.2002
CrossRef Full Text/Google Scholar
Winje, I. M., Sheng, X., Hansson, K. A., Solbrå, A., Tennøe, S., Saatcioglu, F., et al. (2018a). Kakeksia ei aiheuta myonuklei-tai lihassolujen menetystä ksenograftatun eturauhassyövän aikana hiirillä. Acta Physiol. e13204. doi: 10.1111 / apha.13204
CrossRef Full Text | Google Scholar
Winje, I. M., Bengtsen, M., Eftestol, E., Juvkam, I., Bruusgaard, J. C., and Gundersen, K. (2018b). Myonukleiin spesifinen merkitseminen vasta-aineella perikentriolaarista materiaalia 1 vastaan luustolihaskudososissa. Acta Physiol. 223: e13034. doi: 10.1111 / apha.13034
CrossRef Full Text/Google Scholar
Woo, J. (2017). Sarkopenia. Clin. Geriatr. Med. 33, 305–314. doi: 10.1016 / j.cger.2010.02.012
CrossRef Full Text/Google Scholar
Xiao, R., Ferry, A. L., and Dupont-Versteegden, E. E. (2011). Erilaistuneiden myotuubien solukuolemaresistenssi liittyy myoblasteihin verrattuna parempiin anti-apoptoottisiin mekanismeihin. Apoptoosi 16, 221-234. doi: 10.1007 / s10495-010-0566-9
PubMed Abstract | CrossRef Full Text/Google Scholar
Yang, D., Morris, S. F., and Sigurdson, L. (1998). Sartorius lihas: anatomic considerations for reconstructive surgeons. Surg Radiol. Anat. 20, 307–310. doi: 10.1007
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhong, H., Roy, R. R., Siengthai, B., and Edgerton, V. R. (2005). Inaktiivisuuden vaikutukset kuidun kokoon ja myonukleaariseen lukumäärään rotan soleus-lihaksessa. J. Appl. Fysiolia. 99, 1494–1499. doi: 10.1152 / japlfysioli.00394.2005
CrossRef Full Text/Google Scholar
Zhou, X., Wang, J. L., Lu, J., Song, Y., Kwak, K. S., Jiao, Q., et al. (2010). Syövän kakeksian ja lihasten kuihtumisen kääntäminen Act RIIB-antagonismilla johtaa pitkittyneeseen eloonjäämiseen. Selli 142, 531-543. doi: 10.1016 / J.solu.2010.07.011
PubMed Abstract | CrossRef Full Text/Google Scholar
Ziaaldini, M. M., Marzetti, E., Picca, A., and Murlasits, Z. (2017). Biochemical pathways of sarcopenia and their modulation by physical exercise: a narrative review. Edessä. Med. 4:167. doi: 10.3389 / fmed.2017.00167
CrossRef kokoteksti / Google Scholar