
El volumen molar (símbolo Vm) de una sustancia es el volumen ocupado por un mol de la sustancia a una determinada temperatura y presión. Es igual a la masa molecular (M) de la sustancia dividida por su densidad (ρ) a la temperatura y presión dadas:
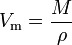
Tiene una unidad SI de metros cúbicos por mol (m3/mol). Sin embargo, los volúmenes molares a menudo se expresan en metros cúbicos por 1.000 moles (m3/kmol) o decímetros cúbicos por mol (dm3/mol) para gases y en centímetros por mol (cm3/mol) para líquidos y sólidos.
Si una sustancia es una mezcla que contiene N componentes, el volumen molar se calcula utilizando:
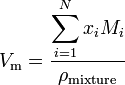
donde x i es la fracción molar del i-ésimo componente, M i es la masa molecular del i-ésimo componente y pmixtura es la densidad de la mezcla a la temperatura y presión dadas.
Al indicar valores numéricos de volumen molar, es importante también indicar las condiciones dadas de temperatura y presión. De lo contrario, los valores numéricos no tienen sentido.
Gases ideales
La ecuación de la ley del gas ideal se puede reordenar para dar esta expresión para el volumen molar de un gas ideal:
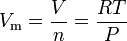
Donde en unidades SI:
= el presión absoluta de gas, en Pa
= número de moles, en mol
= el volumen molar de gas, en m3/mol
= la temperatura absoluta de gas, en K
= la constante universal de la ley de gas de 8.314472 m3·Pa·mol-1·K-1
En las unidades habituales de EE.:
= la presión absoluta del gas, en psia
= número de moles, en lb-mol
= el volumen molar del gas, en ft3/lb-mol
= la temperatura absoluta del gas, en grados Rankine (°R)
= la constante de ley de gas universal de 10.7316 ft3·psia·lb-mol-l·°R-1
Cálculos de ejemplo de volúmenes molares de gas ideales:
- En unidades métricas SI:
Vm = 8.314472 × 273.15 / 101,325 = 0.022414 m3/mol a 0 °C y 101.325 Pa presión absoluta = 22,414 m3/kmol a 0 °C (273,15 K) y 101.325 kPa de presión absoluta Vm = 8.314472 × 273.15 / 100,000 = 0.022711 m3/kmol a 0 °C y 100.000 Pa de presión absoluta = 22.711 m3/kmol a 0 °C (273.15 K) y 100 kPa de presión absoluta
- En las unidades USA:
Vm = 10.7316 × 519.67 / 14.696 = 379.48 ft3/lb-mol a 60 °F (519.67 °R) y 14.696 psia
Notas:
- lb-mol es una abreviatura para libra-mol
- °R grados Rankine (de una escala de temperatura absoluta) y °F grados Fahrenheit (de una escala de temperatura).
- ° R = °F + 459.67
- La literatura técnica puede ser confusa porque algunos autores a menudo no explican si están utilizando la constante de ley de gas universal R, que se aplica a cualquier gas ideal, o si están utilizando la constante de ley de gas específica Rs, que solo se aplica a un gas individual específico. La relación entre las dos constantes es Rs = R / M donde M es la masa molecular del gas.
Gases reales
Los gases reales son aquellos gases que no exhiben un comportamiento de gas ideal. Para tales gases, el método más simple de determinar volúmenes molares es mediante el uso de factores de compresibilidad como en la siguiente expresión:
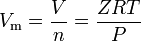
donde Z es el factor de compresibilidad del gas, que es una propiedad termodinámica útil para modificar la ley del gas ideal para tener en cuenta el comportamiento de los gases reales. La ecuación anterior es básicamente una simple ecuación de estado (EOS). La principal limitación de esta ecuación de estado es que el factor de compresibilidad del gas, Z, no es una constante, sino que varía de un gas a otro, así como con la temperatura y la presión del gas considerado.
Se pueden obtener valores más precisos de volúmenes molares de gas reales utilizando ecuaciones de estado como la ecuación de van der Waals desarrollada en 1873, la ecuación de Redlich-Kwong desarrollada en 1949, la ecuación de Soave-Redlich-Kwong desarrollada en 1972 y la ecuación de Peng-Robinson desarrollada en 1976.
- 1.0 1.1 Unión Internacional de Química Pura y Aplicada (IUPAC): Cantidades, Unidades y Símbolos en Química Física 2a Edición, 1993
- 2.0 2.1 Guía del NIST para el Artículo 8.6.3 del SI en la Sección 8
- 3.0 3.1 Determinación de valores de compresibilidad de gas Información sobre cómo determinar los factores de compresibilidad de gas y los volúmenes molares.
| |
Es posible que algunos contenidos de esta página hayan aparecido anteriormente en Citizendium. |