9.5 Violaciones de la Regla de Octetos
Objetivo de aprendizaje
- Reconozca los tres tipos principales de violaciones de la regla de octetos.
Por importante y útil que sea la regla de octetos en la unión química, hay algunas violaciones bien conocidas. Esto no significa que la regla del octeto sea inútil, sino todo lo contrario. Al igual que con muchas reglas, hay excepciones o violaciones.
Hay tres violaciones a la regla de octeto. Moléculas de electrones impares Una molécula con un número impar de electrones en la capa de valencia de un átomo. representa la primera violación de la regla de octetos. Aunque son pocos, algunos compuestos estables tienen un número impar de electrones en sus capas de valencia. Con un número impar de electrones, al menos un átomo en la molécula tendrá que violar la regla del octeto. Ejemplos de moléculas estables de electrones impares son NO, NO2 y ClO2. El diagrama de puntos de electrones de Lewis para NO es el siguiente:
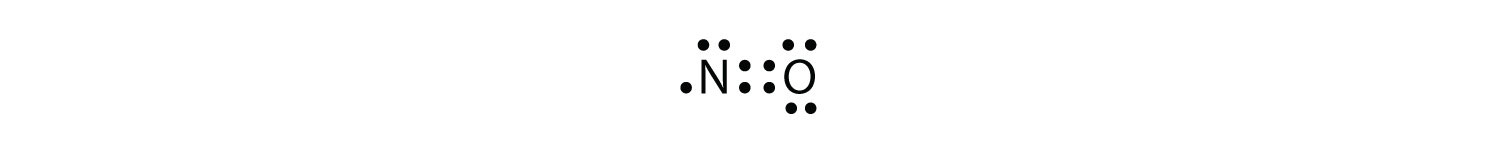
Aunque el átomo O tiene un octeto de electrones, el átomo N tiene solo siete electrones en su envoltura de valencia. Aunque el NO es un compuesto estable, es muy reactivo químicamente, al igual que la mayoría de los otros compuestos de electrones impares.
Moléculas con deficiencia de electrónuna molécula con menos de ocho electrones en la capa de valencia de un átomo. representa la segunda violación de la regla de octetos. Estos compuestos estables tienen menos de ocho electrones alrededor de un átomo en la molécula. Los ejemplos más comunes son los compuestos covalentes de berilio y boro. Por ejemplo, el berilio puede formar dos enlaces covalentes, dando como resultado solo cuatro electrones en su envoltura de valencia:
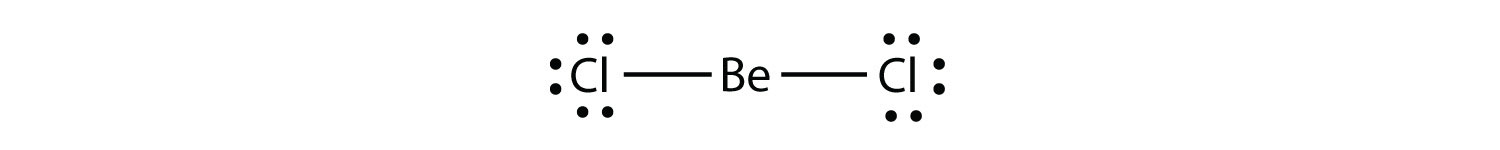
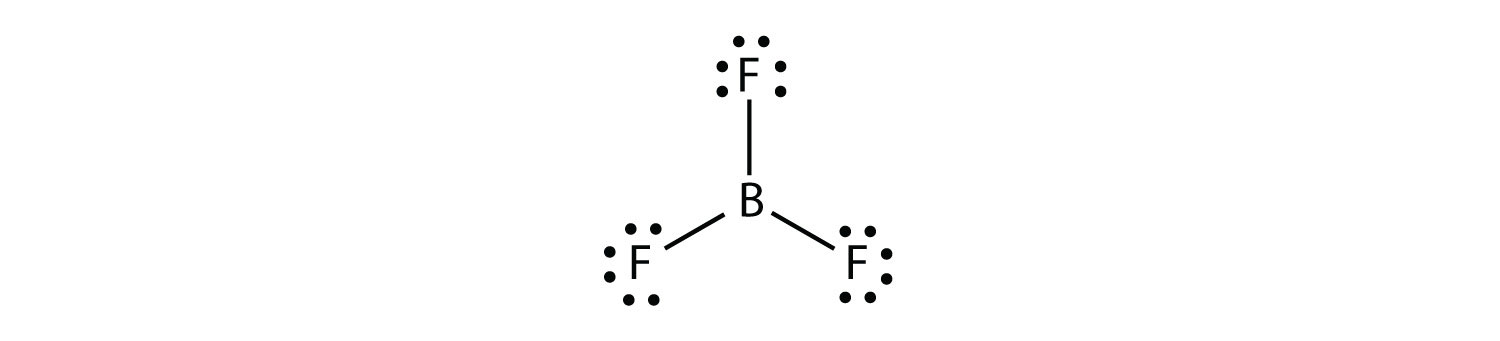
El boro comúnmente hace solo tres enlaces covalentes, lo que resulta en solo seis electrones de valencia alrededor del átomo B. Un ejemplo bien conocido es BF3:
La tercera violación de la regla de octetos se encuentra en aquellos compuestos con más de ocho electrones asignados a su envoltura de valencia. Estos se denominan moléculas de cáscara de valencia expandida Una molécula con más de ocho electrones en la cáscara de valencia de un átomo.. Tales compuestos están formados solo por átomos centrales en la tercera fila de la tabla periódica o más allá que tienen orbitales d vacíos en sus capas de valencia que pueden participar en la unión covalente. Uno de estos compuestos es PF5. La única razonable Lewis electrones punto diagrama para este compuesto tiene la P átomo de hacer cinco enlaces covalentes:
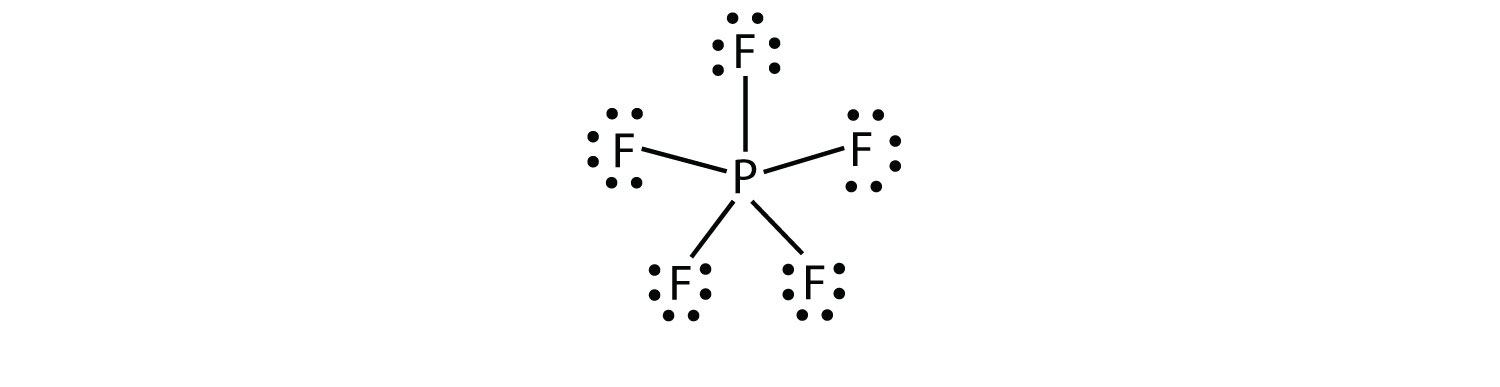
Formalmente, el P átomo tiene 10 electrones en su valencia shell.
Ejemplo 9
Identifique cada violación de la regla de octeto dibujando un diagrama de puntos de electrones de Lewis.
- ClO
- SF6
Solución
-
Con un átomo Cl y un átomo O, esta molécula tiene 6 + 7 = 13 electrones de valencia, por lo que es una molécula de electrones impares. Un diagrama de puntos de electrones de Lewis para esta molécula es el siguiente:

-
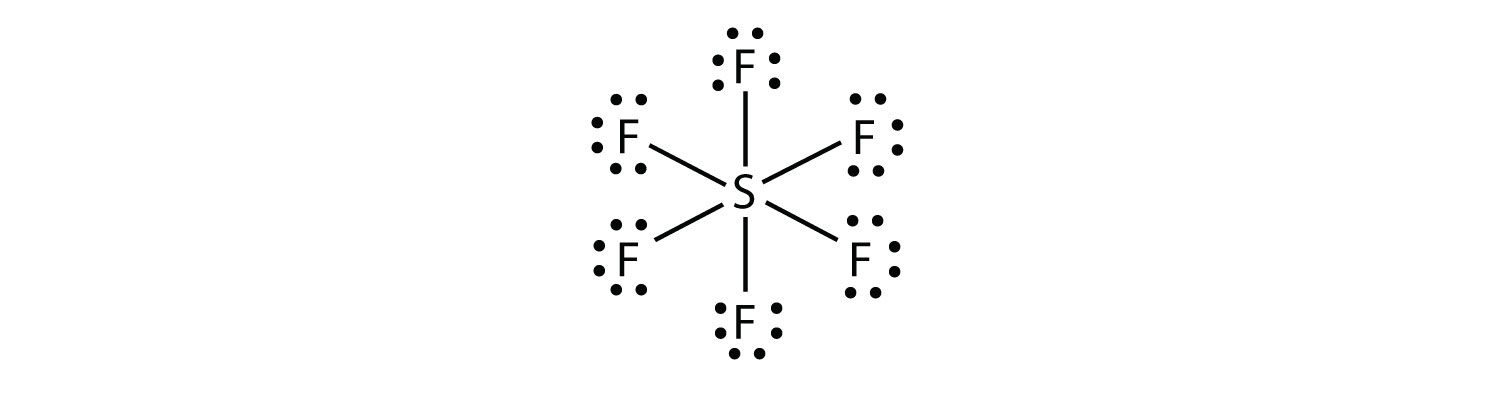
En SF6, el átomo central S hace seis enlaces covalentes a los seis átomos F circundantes, por lo que es una molécula de cáscara de valencia expandida. Su diagrama de puntos de electrones de Lewis es el siguiente:
Pruébese a sí mismo
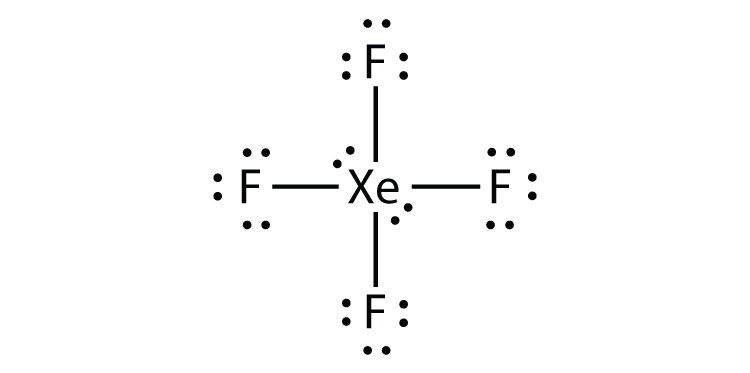
Identifique la violación de la regla de octetos en XeF2 dibujando un diagrama de puntos de electrones de Lewis.
Respuesta
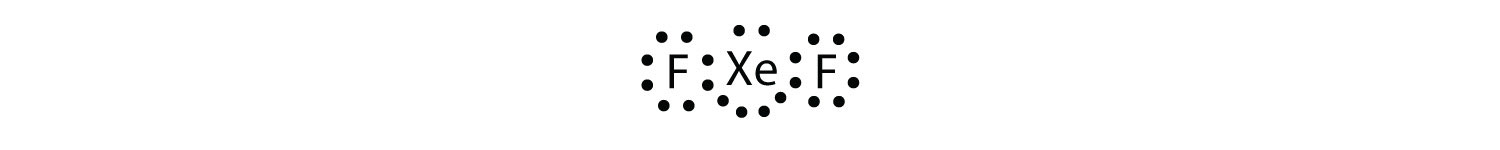
El Xe átomo tiene una amplia valencia shell con más de ocho electrones a su alrededor.
Conclusión clave
- Hay tres violaciones de la regla de octetos: moléculas de electrones impares, moléculas deficientes de electrones y moléculas de cáscara de valencia expandida.
Ejercicios
-
¿Por qué una molécula de electrones impares no puede satisfacer la regla del octeto?
-
¿Por qué un átomo de la segunda fila de la tabla periódica no puede formar moléculas de cáscara de valencia expandida?
-
Dibujar una aceptable Lewis electrones punto diagrama de estas moléculas que violan la regla de octeto.
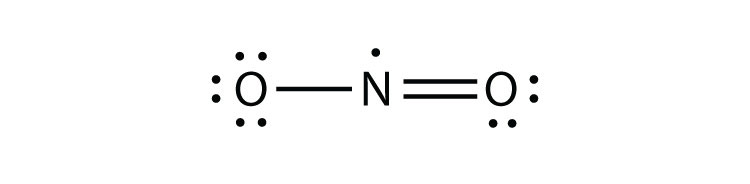
- NO2
- XeF4
-
Dibujar una aceptable Lewis electrones punto diagrama de estas moléculas que violan la regla de octeto.
- BCl3
- ClO2
-
Dibujar una aceptable Lewis electrones punto diagrama de estas moléculas que violan la regla de octeto.
- POF3
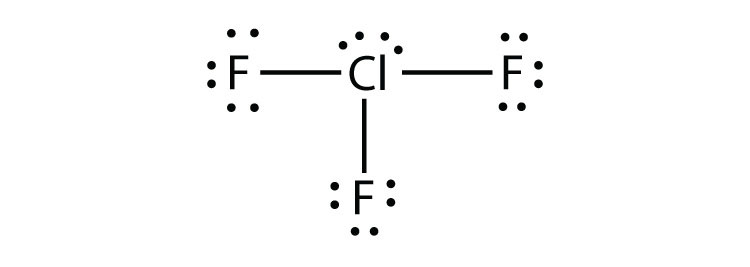
- ClF3
-
Dibujar una aceptable Lewis electrones punto diagrama de estas moléculas que violan la regla de octeto.
- SF4
- BeH2
Respuestas
-
no Hay manera de que los electrones pueden ser emparejados si hay un número impar de ellos.
-
-
-
-