Para que sepas, Dmitri Mendeleev es el padre de la tabla periódica. ¿Pero sabías que la Tabla Periódica Moderna que usamos fue desarrollada por un científico llamado Henry Moseley? Aprendamos la fascinante historia detrás de la tabla periódica.
Suggested Videos
la Moderna Tabla Periódica
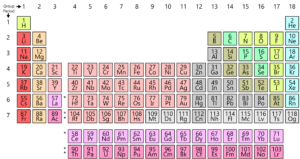
Como ustedes saben, todos los elementos que se encuentran en la tierra están organizados en una cuadrícula o en la matriz se llama la Moderna Tabla Periódica. La disposición de estos elementos está de acuerdo con un patrón. La tabla periódica fue realmente desarrollada y por Mendeleev a principios de 1800. Sin embargo, fue perfeccionado por Henry Moseley, un físico inglés en 1913. Al hacer ajustes a la ley periódica, mejoró todos los defectos de la tabla de Mendeleev. Echemos un vistazo a esta evolución.
Explore más Temas en Clasificación Periódica de Elementos
- Intentos anteriores de Clasificación de Elementos
- Posición de los Elementos en la Tabla Periódica Moderna
- Tendencias en la Tabla Periódica Moderna
Usando el Número Atómico
Primero, echemos un vistazo a la estructura de un átomo. Cada átomo está formado por un núcleo que consta de protones y neutrones. Aquí los protones tienen una carga positiva y un neutrón no tiene carga. Ahora los electrones (que llevan una carga negativa) rodean el núcleo. Ahora el número de masa atómica es el número total de protones y neutrones en un átomo. Y el número atómico es el número de protones en un átomo. Este número atómico es completamente único para cada elemento, lo que significa que cada elemento en el planeta tiene su propio número atómico único.Fue Henry Moseley quien sugirió un arreglo mejor que Mendeleev. Organizó los elementos de acuerdo con su Número Atómico en lugar de su masa atómica. Al hacerlo, mejoró la tabla anterior y eliminó algunas de sus dificultades y anomalías.
Posición del hidrógeno
Mendeleev nunca pudo averiguar la posición correcta del Hidrógeno en su tabla. Dado que el hidrógeno puede ganar o perder un electrón, puede encontrar un lugar en el Grupo 1 o 17. Su configuración electrónica se asemeja a la de los metales alcalinos. Aunque también puede combinarse con metales y no metales formando enlaces covalentes como halógenos.
Pero en la tabla periódica moderna, no hay dilema. Dado que el Número Atómico del hidrógeno es 1, ahí es donde encuentra su lugar apropiado al comienzo de la tabla.
Isótopos
Los isótopos son átomos diferentes de un elemento, cada uno de los cuales tiene el mismo número de protones, pero un número diferente de neutrones en sus núcleos. Esto implica que aunque su masa atómica varía, su número atómico es el mismo. Como por ejemplo, el Carbono-14 es un isótopo radiactivo del átomo de carbono que tiene ocho neutrones.
Mientras que esto presentó un problema para Mendeleev, ya que la tabla dependía de la masa atómica, no es un problema con la tabla Periódica Moderna. Todos los isótopos de los elementos no tienen lugares separados en la mesa.
El orden de ciertos elementos
Mendeleev al usar masa atómica para organizar elementos se enfrentó a otro problema. Hubo ciertos casos en los que se rompió esta disposición, por lo que los elementos con propiedades similares se agruparon en un grupo. Tomemos el ejemplo del yodo y el Telurio. Ahora la masa atómica del yodo es menor que el telurio. Y sin embargo Mendeleev lo puso después del telurio para que pudiera estar en el mismo grupo que el flúor y el cloro.
En la tabla periódica moderna, la masa atómica se vuelve irrelevante y los elementos se agrupan con elementos similares basados en su número atómico.
Elementos de Tierras Raras
La tabla periódica moderna resolvió otro problema colocando los elementos de tierras raras como Cerio, Lantano, Erbio, etc. en una tabla separada en la parte inferior de la tabla Periódica, para no interferir con la Ley Periódica.
Ejemplo resuelto para Usted
Q: De todos los 118 elementos que conocemos, ¿cuántos elementos ocurren naturalmente?