Términos clave
Asegúrese de que puede definir y usar en contexto los términos clave a continuación.
- Catalizador de Adams
- hidrogenación
Notas del estudio
Las reacciones químicas heterogéneas tienen reactivos que se encuentran en al menos dos fases diferentes (por ejemplo, gas con un sólido), mientras que las reacciones homogéneas ocurren en una sola fase (por ejemplo, gas con otro gas).
La descripción del catalizador utilizado en la reacción entre alquenos e hidrógeno puede dar lugar a cierta confusión. Se usan comúnmente tres metales—níquel, platino y paladio—, pero un químico no puede simplemente colocar un pedazo de uno de estos metales en una mezcla de alqueno e hidrógeno y obtener una reacción. Cada catalizador de metal debe prepararse de una manera especial:
- el níquel se usa generalmente en una forma finamente dividida llamada «níquel Raney».»Se prepara reaccionando una aleación de Ni-Al con NaOH.
- el paladio se obtiene comercialmente «apoyado» en una sustancia inerte, como el carbón vegetal (Pd/C). El alqueno generalmente se disuelve en etanol cuando se usa Pd/C como catalizador.
- el platino se utiliza como PtO2, el catalizador de Adams, aunque en realidad es el metal de platino el catalizador. El hidrógeno utilizado para agregar al doble enlace carbono-carbono también reduce el óxido de platino (IV) a metal de platino finamente dividido. El etanol o ácido acético se utiliza como disolvente para el alqueno.
Otros tipos de compuestos que contienen enlaces múltiples, como cetonas, ésteres y nitrilos, no reaccionan con el hidrógeno en las condiciones utilizadas para hidrogenar alquenos. Los ejemplos a continuación muestran la reducción de un alqueno, pero los grupos cetona y nitrilo presentes permanecen intactos y no se reducen.

Los anillos aromáticos tampoco se reducen en las condiciones utilizadas para reducir los alquenos, aunque estos anillos parecen contener tres enlaces dobles carbono-carbono. Como verá más adelante, los anillos aromáticos en realidad no contienen enlaces dobles, y muchos químicos prefieren representar el anillo de benceno como un hexágono con un círculo dentro

en lugar de un hexágono con tres enlaces dobles alternos.
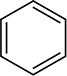
La representación del anillo de benceno se analizará más a fondo en la sección 15.2.
La reacción entre enlaces dobles carbono-carbono e hidrógeno proporciona un método para determinar el número de enlaces dobles presentes en un compuesto. Por ejemplo, un mol de ciclohexeno reacciona con un mol de hidrógeno para producir un mol de ciclohexano:

pero un mol de 1,4-ciclohexadieno reacciona con dos moles de hidrógeno para formar un mol de ciclohexano:
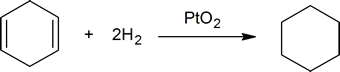
Un químico diría que el ciclohexeno reacciona con un equivalente de hidrógeno, y el 1,4-ciclohexadieno reacciona con dos equivalentes de hidrógeno. Si toma una cantidad conocida de un hidrocarburo insaturado desconocido y determina cuánto hidrógeno absorberá, puede determinar fácilmente el número de enlaces dobles presentes en el hidrocarburo (vea la pregunta 2 a continuación).
La adición de hidrógeno a un doble enlace carbono-carbono se denomina hidrogenación. El efecto general de tal adición es la eliminación reductiva del grupo funcional de doble enlace. La regioselectividad no es un problema, ya que el mismo grupo (un átomo de hidrógeno) está unido a cada uno de los carbonos de doble enlace. La fuente más simple de dos átomos de hidrógeno es el hidrógeno molecular (H2), pero la mezcla de alquenos con hidrógeno no da lugar a ninguna reacción discernible. Aunque la reacción de hidrogenación general es exotérmica, una alta energía de activación impide que tenga lugar en condiciones normales. Esta restricción puede eludirse mediante el uso de un catalizador, como se muestra en el siguiente diagrama.
Un ejemplo de reacción de adición de alquenos es un proceso llamado hydrogenation.In una reacción de hidrogenación, se agregan dos átomos de hidrógeno a través del doble enlace de un alqueno, lo que resulta en un alcano saturado. La hidrogenación de un doble enlace es una reacción termodinámicamente favorable porque forma un producto más estable (de menor energía). En otras palabras, la energía del producto es menor que la energía del reactivo; por lo tanto, es exotérmica (se libera calor). El calor liberado se denomina calor de hidrogenación, que es un indicador de la estabilidad de una molécula.


son sustancias que cambian la velocidad de una reacción química sin consumirse ni aparecer como parte del producto. Los catalizadores actúan reduciendo la energía de activación de las reacciones, pero no cambian la energía potencial relativa de los reactivos y productos. Los metales finamente divididos, como el platino, el paladio y el níquel, se encuentran entre los catalizadores de hidrogenación más utilizados. La hidrogenación catalítica se lleva a cabo en al menos dos etapas, como se muestra en el diagrama. En primer lugar, el alqueno debe ser adsorbido en la superficie del catalizador junto con parte del hidrógeno. A continuación, dos hidrógenos se desplazan de la superficie metálica a los carbonos del doble enlace, y el hidrocarburo saturado resultante, que es más débilmente adsorbido, abandona la superficie del catalizador. La naturaleza exacta y el momento de los últimos eventos no se entienden bien.

Como se muestra en el diagrama de energía, la hidrogenación de alquenos es exotérmica y se libera calor correspondiente al ΔE (color verde) en el diagrama. Este calor de reacción se puede utilizar para evaluar la estabilidad termodinámica de alquenos que tienen diferentes números de sustituyentes alquilos en el doble enlace. Por ejemplo, en el cuadro siguiente se enumeran los calores de hidrogenación de tres alquenos C5H10 que dan el mismo producto alcano (2-metilbutano). Dado que un gran calor de reacción indica un reactivo de alta energía, estos calores son inversamente proporcionales a las estabilidades de los isómeros de alqueno. Para una aproximación aproximada, vemos que cada sustituyente alquilo en un enlace doble estabiliza este grupo funcional en un poco más de 1 kcal / mol.
| Alkene Isomer | (CH3)2CHCH=CH2 3-methyl-1-butene |
CH2=C(CH3)CH2CH3 2-methyl-1-butene |
(CH3)2C=CHCH3 2-methyl-2-butene |
|---|---|---|---|
| Heat of Reaction ( ΔHº ) |
–30.3 kcal/mole | –28.5 kcal/mole | –26.9 kcal/mole |

Del mecanismo que se muestra aquí, esperaríamos que la adición de hidrógeno se produjera con syn-estereoselectividad. Esto es a menudo cierto, pero los catalizadores de hidrogenación también pueden causar isomerización del doble enlace antes de la adición de hidrógeno, en cuyo caso la estereoselectividad puede ser incierta.

Ejercicios
- En la reacción
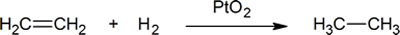
- 0.500 mol de etileno reacciona con _______ moles de hidrógeno. Por lo tanto, un químico podría decir que el eteno reacciona con un _______ de hidrógeno.
- el eteno está siendo _______; mientras que el _______ se está oxidando.
- el número de oxidación del carbono en el eteno es _______; en el etano es _______.
- Cuando 1.000 g de un determinado triglicérido (grasa) se trata con gas hidrógeno en presencia del catalizador de Adams, se encuentra que el volumen de gas hidrógeno consumido a 99,8 kPa y 25,0°C es de 162 ml. Un experimento separado indica que la masa molar de la grasa es de 914 g mol-1. ¿Cuántos enlaces dobles carbono-carbono contiene el compuesto?
Respuesta:
-
-
Mostrar Respuesta
-
Mostrar Respuesta
-
Mostrar Respuesta
-
-
Mostrar Respuesta
Examples
Question
Predict the products if the following alkenes were reacted with catalytic hydrogen.

Solution

Contributors
- Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
- Prof. Steven Farmer (Universidad Estatal de Sonoma)
- Química Orgánica con Énfasis Biológico por Tim Soderberg (Universidad de Minnesota, Morris)