Una enfermedad transmitida por vectores (específicamente una transferencia biológica en lugar de mecánica) es aquella en la que la transmisión de la infección en una población (la población huésped) ocurre solo a través de una segunda población (vectores). Los vectores suelen ser artrópodos hematófagos (que se alimentan de sangre), como mosquitos, flebótomos o garrapatas. Hay muchas de estas enfermedades, cuya dinámica es de gran interés desde el punto de vista del control de la infección. La malaria, la leishmaniasis, la fiebre del dengue y el virus del Nilo occidental son solo algunos de los que actualmente tienen un enorme impacto social en las poblaciones humanas.
Cada año, en la región, 225 millones de personas se infectan con el parásito de la malaria y, en 2009, alrededor de 781.000 de ellas provocaron mortalidad inducida por la enfermedad. La historia es similar para la leishmaniasis, donde hay alrededor de 12 millones de personas en todo el mundo que se cree que están infectadas en un momento dado y alrededor de 80,000 personas mueren anualmente de la forma más grave, la leishmaniasis visceral. Tales enfermedades son comunes en el mundo en desarrollo; una combinación de hábitat óptimo para los vectores en las regiones tropicales y la falta de ayuda médica conducen a endemias a gran escala allí.
Las enfermedades humanas no son la única preocupación; hay muchas otras que infectan a otras clases de huéspedes que también son de interés, particularmente desde el punto de vista de la preservación de especies en peligro de extinción.
El curso típico de infección para la transmisión por vectores, ignorando la enfermedad, el huésped o los vectores específicos, comienza con un vector infectado (un artrópodo adulto que se alimenta de sangre o succiona) que toma una comida de sangre de un miembro susceptible de la población huésped. Una vez mordido, el huésped tiene la posibilidad de infectarse con la enfermedad. En esta etapa, si está infectado, el huésped se considera expuesto, pero no presenta efectos adversos de la infección y no puede transmitir la enfermedad. El tiempo después de infectarse pero antes de infectarse se conoce como período de latencia. Cuando el parásito ha alcanzado una cierta etapa en su ciclo reproductivo, el huésped se vuelve infeccioso después de lo cual, si es mordido, puede transmitir la enfermedad a un vector susceptible a través de su sangre infectada por parásitos y completar el ciclo de transmisión (se muestra en la figura siguiente).
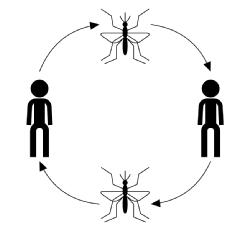
La transmisión de enfermedades generalmente se caracteriza por:
- abundancia y propagación espacial de huéspedes y vectores
- demografía
- una tasa de alimentación o deseo vectorial de morder
- éxito o fracaso de la transmisión
Los modelos matemáticos típicos de enfermedades transmitidas por vectores se basan en un modelo SI(R) de dos poblaciones que muestra términos de infección «cruzada», donde y
son la fuerza de infección de términos para anfitriones y vectores respectivamente:
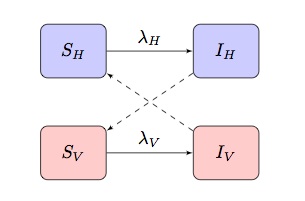
Dependiendo de la enfermedad y la población que se modele, esto puede adaptarse para incorporar otras características más específicas.
Modelización de la Dinámica de las Enfermedades Transmitidas por Vectores
Existen muchos tipos diferentes de modelos matemáticos para la transmisión de enfermedades transmitidas por vectores; lo ideal es que estos modelos se mantengan matemáticamente manejables y lo más simples posible, manteniendo al mismo tiempo la dinámica general del sistema biológico. Como era de esperar, los modelos de la gama de literatura en gran medida; de determinista a estocástico, endémico (incluidas las tasas de natalidad y mortalidad) o epidémico (un brote de duración limitada), que incorpora diseminación espacial, heterogeneidad espacial, períodos de latencia, estructura de edad, adquisición y pérdida de inmunidad, cepas múltiples y muchos otros. Incluso cuando se considera solo una enfermedad específica, las variaciones en la enfermedad dentro de diferentes poblaciones pueden conducir a cambios no solo en la parametrización, sino también en la forma en que uno puede desear adoptar el enfoque de modelado.
Parte del trabajo de Kat se centra en las simplificaciones que a menudo se hacen para reducir la complejidad de los modelos. Este trabajo considera los efectos del uso de modelos de transmisión «solo para el huésped», como la suposición de cuasi equilibrio sobre la dinámica de la enfermedad y también el efecto de omitir el período de latencia sobre las predicciones epidémicas.
Leishmaniasis
A completar por Erin
Tripanosomiasis Africana Humana (HAT)
La tripanosomiasis africana humana (HAT), más conocida coloquialmente como enfermedad del sueño, es una enfermedad mortal que es endémica en gran parte del África subsahariana. 70 millones de personas viven en zonas de riesgo que abarcan más de un millón y medio de kilómetros cuadrados. Si bien la prevalencia de HAT no es tan alta como la de otras enfermedades transmitidas por vectores, como la malaria o el dengue (hubo poco más de 7000 casos reportados de HAT, pero se estimaron 207 millones de casos de malaria en 2012), la falta de profilaxis química, el tratamiento extremadamente desagradable (y a menudo mortal) y la escasez de investigación científica sustancial han colocado a HAT en la lista de enfermedades tropicales desatendidas de la OMS.
El vector de HAT es la tsetsé; su necesidad de alimentarse de sangre para evitar la inanición y una interacción vector-parásito única (que causa un «fenómeno de susceptibilidad teneral») significan que el modelado de SOMBRERO es claramente diferente a otras enfermedades transmitidas por vectores como la malaria.
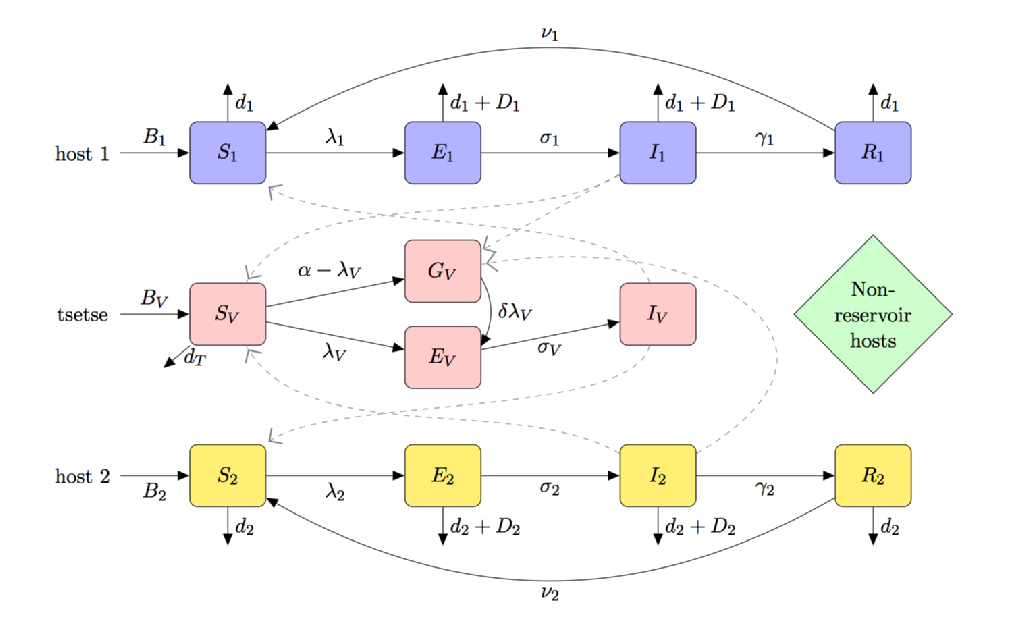
La siguiente figura es una caricatura compartimental de un modelo para SOMBRERO que incluye:
- susceptibilidad teneral(parcial) a la mosca
- especies de huéspedes múltiples (incluidos huéspedes reservorios y no reservorios)
- preferencia de alimentación de tsetsé
- hambre de tsetsé sin alimentar
Enfermedad de la lengua azul (TVB)
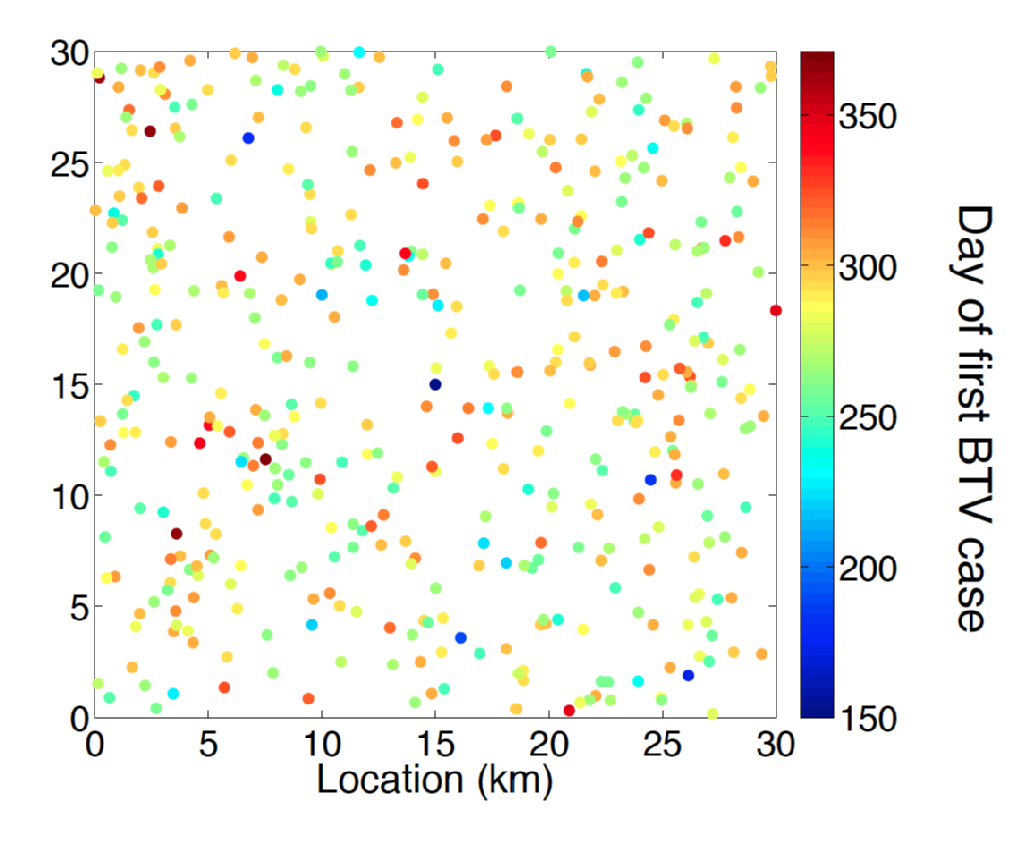
La lengua azul es una enfermedad vírica de los rumiantes transmitida por varias especies de mosquitos picadores del género Culicoides. Los síntomas para el ganado enfermo con TVB incluyeron malestar, fiebre alta y cianosis de la lengua, lo que le da nombre a la enfermedad. Entre las ovejas, la enfermedad de la TVB tiene una alta mortalidad asociada. Hasta finales de la década de 1990, el rango europeo de BTV estaba completamente asociado con el rango del vector de mosquito C. Imicola. A finales de los años 90 y principios de los años 2000, se ha producido una expansión sin precedentes de BTV en áreas de Europa que forman parte del rango de otras especies de mosquitos, como las del complejo C. Obsoletus y especies de mosquitos estrechamente relacionadas. En particular, un brote originario de los Países Bajos en 2006 es el primer ejemplo registrado de una incursión de BTV a los 50 grados de latitud norte. En los veranos posteriores se descubrieron casos de fiebre catarral ovina en el norte de Europa, incluidos Bélgica, Alemania, el Reino Unido y Dinamarca, lo que demuestra la capacidad de la lengua azul para pasar el invierno en el medio ambiente del norte de Europa. Una característica desconcertante de la serología de la lengua azul del norte de Europa es que la enfermedad fue causada por una cepa distinta (BTV-8) de los responsables de las incursiones en el sur de Europa, es decir, España (BTV-4) e Italia (BTV-2).
Predecir el impacto de la incursión de BTV y el mejor diseño de manejo ganadero y control de enfermedades requiere una metodología de modelado de vanguardia. Se entiende mucho sobre la epidemiología de la BTV, como una comprensión sólida del período esperado de viremia para los huéspedes de ganado bovino y ovino y el efecto de la temperatura climática sobre el período de incubación de la lengua Azul dentro de su vector de mosquito. Sin embargo, la estimación del riesgo espacio-temporal que plantea la dispersión de vectores lejos del ganado huésped infectado sigue siendo un reto importante. El problema de inferencia aquí es multifactorial que requiere no solo inferencia de parámetros, sino también selección de modelos con principios estadísticos.
Malaria
La malaria sigue el ciclo de transmisión genérico descrito anteriormente; el vector es el mosquito hembra que toma su comida de sangre como parte del proceso reproductivo; los machos de la especie son nectávoros y, como tales, no participan en el ciclo de transmisión. La frecuencia de alimentación está determinada por esta necesidad biológica, por lo que la tasa promedio de alimentación suele ser de alrededor de una vez cada cuatro días y generalmente se asume que la saciedad de un lote de huevos se logra dentro de esta comida. Hay muchos tipos diferentes de malaria, algunos afectan a los seres humanos (esto puede ser causado por uno de los cuatro tipos diferentes de Plasmodium) y otros afectan a los animales. El género Anopheles es responsable de la transmisión a los seres humanos, de los cuales aproximadamente solo 30 de cada 400 especies causan predominantemente la propagación de la infección.
Una característica clave que afecta a la malaria es la temperatura; incluso si el mosquito reside dentro del área dada, las temperaturas externas son inferiores a aproximadamente 16 ° C (la temperatura exacta depende de la especie del parásito), no es lo suficientemente cálida como para permitir el desarrollo. En general, a medida que la temperatura aumenta de 16C el más corto es el período de incubación con un repentino fin arriba acerca de la 32C ya que el parásito no es capaz de sobrevivir más allá de esta temperatura.
La malaria aviar y el nido de abeja hawaiano
Algunos sistemas, sin embargo, pueden ser mucho más complejos que el ejemplo general dado anteriormente. Un ejemplo de ello es el nido de abeja hawaiano (Drepanididae); sufre no solo los efectos adversos de la Malaria aviar (Plasmodium relictum) que se transmite a través del mosquito (Culex quinquefasciatus), sino también los del cambio climático y la depredación. La interacción entre estos factores dominantes es grande, con temperaturas y abundancia de depredadores que afectan el curso de la enfermedad y la capacidad (o incapacidad) de las aves para resistir la extinción. Además, algunas especies de mielero exhiben la capacidad de conferir resistencia a la malaria, sin sufrir efectos nocivos de la enfermedad mientras permanecen infecciosas (se les conoce más comúnmente como portadores y causan inadvertidamente un reservorio de infección al sobrevivir a la esperanza de vida normal «libre de enfermedad» pero aún propagando la infección.
Este trabajo ha sido publicado como:
K. S. Rock et al. «Modelling the Future of the Hawaiian Honeycreeper: An Ecological and Epidemiological Problem». Modelización ecológica (junio de 2012)