- Introducción
- Materiales y métodos
- Cepas
- Extracción de ADN
- Amplificaciones de PCR stx1 y stx2
- Secuenciación de ADN
- Preparaciones de células Vero de microplacas
- Preparaciones bacterianas libres de células
- Ensayo citotóxico y Determinación de LD50
- Ensayo de Bloqueo y Neutralización de toxinas
- La obtención de OMV y la extracción de ADN de OMV
- Resultados
- Amplificaciones de PCR de los genes stx1 y stx2
- Secuenciación de ADN
- Ensayo Citotóxico y Determinación de LD50
- Neutralización de toxinas
- Las amplificaciones de PCR del gen stx1 de OMVs
- Discusión
- Contribuciones de los autores
- Funding
- Declaración de Conflicto de Intereses
- Agradecimientos
- Abreviaturas
Introducción
Durante varios años, la importancia de Aeromonas spp., como agente causante de diarrea en humanos, fue controvertido; varios estudios demostraron que el mecanismo patógeno de las Aeromonas es multifactorial porque están involucrados muchos factores de virulencia, incluida la producción de citotoxinas (Castro-Escarpulli et al., 2002, 2003). Estas toxinas pueden causar diarrea o colitis hemorrágica, y pueden desempeñar un papel importante en el síndrome hemolítico urémico (SUH) y el desarrollo de PTT (Bogdanović et al., 1991; Fang et al., 1999; Monforte-Cirac et al., 2010).
Las citotoxinas implicadas en estas enfermedades incluyen la toxina Shiga y la estrechamente relacionada Stx. Las variantes Stx se expresan en especies bacterianas de Shigella, Enterobacter, Citrobacter, Acinetobacter, Campylobacter y Hamiltonella (Mauro y Koudelka, 2011). Alperi y Figueras (2010) describieron la presencia de Stx1 y Stx2 en aislados clínicos de Aeromonas spp., asociado con gastroenteritis, colitis hemorrágica y SUH. Los genes que codifican estas toxinas se encuentran en diferentes bacteriófagos lambdoides que lisogenizan esta cepa. Además, el género Aeromonas tiene un sistema de secreción cero llamado OMVs. Las VMO podrían ser un medio por el cual algunas proteínas, ARN, componentes espaciales periplásmicos y otros componentes asociados con la virulencia, pueden transferirse horizontalmente a otros géneros; por lo tanto, se cree que las VMO juegan un papel importante en la patogenicidad (Guerrero-Mandujano et al., 2015a, b).
Por esta razón, el objetivo de este estudio fue evaluar el daño causado por la producción de Stx por cepas aisladas de niños de la Ciudad de México en cultivos celulares Vero.
Materiales y métodos
Cepas
Este estudio incluyó 66 aislados clínicos del INP, 54 obtenidos de infecciones intestinales y 12 de infecciones extra intestinales. Se aislaron cepas de muestras obtenidas para pruebas de rutina en el hospital mencionado; por lo tanto, no se requirió el consentimiento informado de los padres o tutores legales de los niños. Todas las cepas fueron identificadas genéticamente por 16S rDNA-RFLP (Hernández-Cortez et al., 2011). Se utilizó la cepa tipificada para Escherichia coli O157:H7 CECT 4076 como control positivo y la cepa E. coli K12 (5512 ENCB) de la colección del Laboratorio de Bacteriología Médica (Escuela Nacional de Ciencias Biológicas, IPN) como control negativo para la producción de toxinas. Las cepas se mantuvieron por períodos cortos a temperatura ambiente en inclinaciones a base de agar sanguíneo; para un almacenamiento más prolongado, se congelaron a -70°C en caldo de glicerol-Todd-Hewitt al 20% (p/v) (Oxoid, México) o se liofilizaron en 7.suero de glucosa de caballo al 5%.
Extracción de ADN
Todos los cultivos se cultivaron en agar triptico de soja a 30°C durante 18 h. El ADN genómico de cada cepa se obtuvo a través de la Matriz InstaGene (BioRad®, México) de acuerdo con las instrucciones proporcionadas por el fabricante. La pureza y la cantidad de ADN se determinaron utilizando el espectrofotómetro Ampli Quant AQ-07. El ADN se almacenó a -20°C hasta su uso.
Amplificaciones de PCR stx1 y stx2
La presencia de stx1 y stx2 a partir de ADN de VMB y ADN genómico se detectó mediante reacciones de PCR únicas utilizando cebadores STX1F/STX1R y STXF / STXR con un producto de 144 y 217 pb, respectivamente, estos cebadores se diseñaron en base a la secuencia de la subunidad A. Los cebadores, la reacción y las condiciones de amplificación se procesaron como se describió anteriormente por Hernández-Cortez et al.. (2013), con controles positivos (E. coli O157:H7) y negativos (E. coli K12).
Secuenciación de ADN
Los productos de reacción en cadena de polimerasa se purificaron utilizando un Kit de Extracción Rápida de Gel PureLink (Invitrogen®, México) de acuerdo con las instrucciones del fabricante. Los productos se secuenciaron directamente en un analizador genético ABI-PRISM 310 (Applied Biosystems, Foster City, CA, EE.UU.) utilizando los cebadores de avance y retroceso utilizados para PCR, de acuerdo con las instrucciones del fabricante. La secuenciación se realizó en el Instituto de Biología, UNAM (México). El análisis de secuencias se realizó con la Herramienta Básica de Búsqueda de Alineación Local (BLAST) proporcionada por el Centro Nacional de Información Biotecnológica (NCBI).
Preparaciones de células Vero de microplacas
Este procedimiento se realizó en microplacas de 96 pocillos con monocapa de células Vero (ATCC CCL81) con una confluencia del 80%, agregando medio esencial mínimo (MEM; Invitro®, México) complementado con suero fetal bovino al 10% v/v (FBS; Invitro®, México).
La suspensión celular fue homogeneizada y ajustada a 105-106 células / ml utilizando una cámara de Neubauer. Después del ajuste, la suspensión se depositó en un pocillo de 200 µL. Las microplacas se incubaron a 37°C bajo el 5% de CO2 durante 24 h (Incubadora de CO2, VWR Scientific, EE. UU.) (Giono-Cerezo et al., 1994).
Preparaciones bacterianas libres de células
Se inocularon cinco colonias de cada placa de agar sanguíneo en 3 ml de medio Craig (extracto de levadura al 0,4%, ácidos casamino al 3%, K2HPO4 al 0,05%). Estos se incubaron durante 24 h a 37 ° C y la densidad óptica del cultivo bacteriano utilizado fue de 0,25 a 600 nm. Las preparaciones sin células se hicieron centrifugando los cultivos a 14.000 g durante 10 minutos a 4 ° C, seguido de la filtración del sobrenadante a través de un filtro de membrana (tamaño de poro 0,45 pm, Sartorius Minisart NML). Los sobrenadantes libres de células se almacenaron a -20°C. De esta manera se obtuvieron un total de 66 preparados bacterianos libres de células; el control positivo (E. coli O157:H7) y el control negativo (E. coli K12) también se obtuvieron de la misma manera (Giono-Cerezo et al., 1994).
Ensayo citotóxico y Determinación de LD50
El filtrado libre de células (20 µL) se inoculó en pocillos que contenían células y el medio de crecimiento respectivo sin antibióticos. Las células inoculadas se incubaron durante 96 h a 37 ° C con 5% de CO2 y se observaron cada 24 h en el microscopio invertido. Se esperaba que el efecto citotóxico apareciera como redondeo y contracción de las células con granulación gruesa y, finalmente, destrucción progresiva e irreversible de la monocapa. Todas las pruebas se realizaron por duplicado; también se realizaron controles de viabilidad con medios MEM y Craig(Giono-Cerezo et al., 1994).
La LD50 se determinó en cepas de Aeromonas detectadas como positivas para causar daño citotóxico en células Vero. Se preparó una microplaca estándar de 96 pocillos con células Vero, como se indica en 2.6, pero el medio se cambió a 100 µL de MEM con 1% de SBC. Esta preparación se expuso a 100 µL de preparación bacteriana libre de células, y se realizaron diluciones en serie en toda la fila de placas. Después de 24 h de incubación a 37 ° C con 5% de CO2, se determinó la LD50, bajo el microscopio invertido. La LD50 se asignó al pozo en el que el 50% de las células Vero estaban dañadas y el 50% no dañadas (Marques et al., 1986).
Ensayo de Bloqueo y Neutralización de toxinas
El ensayo de neutralización de toxinas se realizó en las cepas que indujeron daño citotóxico en células Vero porque este daño es indicativo de Stx. Para esta prueba, se preparó una microplaca con células Vero cultivadas a una confluencia del 90-100% con la LD50 de cada preparación bacteriana libre de células. Para realizar el ensayo de neutralización para mostrar el daño celular producido como consecuencia de la acción Stx, se utilizaron dos anticuerpos monoclonales (Universidad Nacional Autónoma de México) obtenidos de E. coli O157:H7.
Para cada Ab se realizó una cuantificación de proteína Bradford de acuerdo con las instrucciones del fabricante (Biorad), con un resultado de 78,2 y 74,8 µg/µL, respectivamente, de anti-Stx1 y anti-Stx2 A. Se trabajó el Ab concentrado y se realizó una doble dilución del Ab. A continuación, se incubaron 10 µL de Ab (anti-STX1 o anti-STX2) con 190 µL del sobrenadante libre de células a una concentración de LD50 durante 1 h a 37°C. A continuación, se inocularon 200 µL de este último en células Vero al 90% de la confluencia y se incubaron durante 24 h a 37°C con 5% de CO2 (Marques et al., 1986).
La obtención de OMV y la extracción de ADN de OMV
se obtuvieron vesículas de membrana externa de Aeromonas hydrophila F-0050. El protocolo se realizó como se describió previamente por Guerrero-Mandujano et al. (2015a).
El ADN del OMV se obtuvo a través de la Matriz InstaGene (BioRad®, México) de acuerdo con las instrucciones proporcionadas por el fabricante. Luego, el ADN del OMV se purificó con la técnica de extracción de ADN fenol-cloroformo(Guerrero-Mandujano et al., 2015b).
Resultados
Amplificaciones de PCR de los genes stx1 y stx2
El cribado de reacción en cadena de la polimerasa de 66 cepas clínicas de Aeromonas mostró que 22/66 (33,3%) cepas contenían el gen stx1, 42/66 (63,6%) cepas contenían ambos genes, ninguna cepa contenía solo el gen stx2 y 2/66 (3%) cepas eran negativas para ambos genes.
Secuenciación de ADN
El análisis de BLASTn mostró una similitud de 79 a 99% y un valor esperado de 3e-16/2e-97 entre los genes stx-1 / stx-2 de E. coli O157:H7 y el amplicón de Aeromonas spp., cepa.
Ensayo Citotóxico y Determinación de LD50
La prueba de citotoxicidad realizada en cultivos celulares Vero mostró que 17/66 (25,7%) preparaciones bacterianas libres de células causaron daño citotóxico, lo que sugiere la producción de un Stx activo (Figura 1), revelado por el daño característico causado por el Stx.
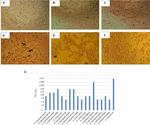
la FIGURA 1. Ensayo de citotoxicidad y determinación de LD50 realizados en cultivos celulares Vero. A) Cultivo de células Vero con un Medio Esencial Mínimo (prueba de viabilidad). B) Cultivo celular Vero con medio Craig (prueba de viabilidad). C) Control negativo con E. coli K12. D) Control positivo con E. coli O157: H7, se muestra daño citotóxico (flechas) por destrucción de la monocapa celular y efecto de «encaje viejo». E) Daño citotóxico de la cepa A. hydrophila F-0050. F) Daño citotóxico de la cepa A. caviae 421423. G) Representación gráfica del título LD50 de todas las cepas.
Los resultados para determinar el título de LD50 fueron los siguientes: 6/17 (35,2%) preparaciones bacterianas libres de células presentaron un título de 1:16; 5/17 (29,4%) preparaciones bacterianas libres de células mostraron un título de 1:8; 3/17 (17,6%) preparaciones bacterianas libres de células tuvieron un título de 1:64; 2/17 (11,7%) preparaciones bacterianas libres de células con un título de 1:32; y 1/17 (5,8%) preparaciones bacterianas libres de células con un título de 1:256 (Figura 1G).
Neutralización de toxinas
La aplicación de anti-STX1 Ab en 11/17 (64.7%), el daño a las células en el sobrenadante se inhibió completamente a una concentración Ab de 39,1 µg/µL; en 4/17 (23,5%) preparaciones bacterianas libres de células, se observó una reducción del daño celular a la misma concentración; y en 2/17 (11,7%) preparaciones bacterianas libres de células, el daño celular se inhibió completamente a una concentración de 78,2 µg/µL. El uso de Ab anti-STX2 mostró que en 9/17 (52,9%) preparaciones bacterianas libres de células, el daño celular se inhibió totalmente a 37,4 µg/µL, y en 6/17 (35,2%) preparaciones bacterianas libres de células mostraron un daño celular reducido a la misma concentración; y en 2/17 (11).7%) preparaciones bacterianas libres de células, el daño celular se inhibió completamente con una concentración de Ab de 74,8 µg / µL (Figuras 2 y 3).

la FIGURA 2. Inhibición del efecto citotóxico inducido en cultivos de células Vero por preparados bacterianos libres de células de Aeromonas spp. cepas con el gen stx1 o stx2.
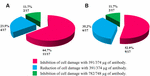
la FIGURA 3. Porcentaje de cepas que mostraron inhibición o reducción del daño celular. A) Neutralización con el anti-Stx1 Ab. B) Neutralización con el anti-Stx2 Ab.
Las amplificaciones de PCR del gen stx1 de OMVs
La reacción en cadena de la polimerasa del ADN de OMVs de A. hydrophila F-0050 reveló que los OMV contenían el gen stx1; por lo tanto, los OMV podrían ser un vehículo potencial para la transferencia horizontal de genes de virulencia (Figura 4).
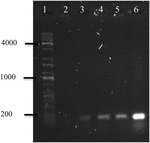
la FIGURA 4. Electropherograma de amplificación del gen stx1 a partir del ADN de OMVs. (1) Escalera universal Kapa, (2) Control negativo, (3) OMV de A. hydrophila F-0050, (4) A. hydrophila F-0050, (5) OMV de E. coli O157:H7, y (6) E. coli O157:H7.
Discusión
El género Aeromonas, como productor de Stx, podría ser un patógeno emergente que causa diarrea principalmente en pacientes pediátricos (Hernández-Cortez et al., 2011; Figueras y Báez-Hidalgo, 2014). Sin embargo, este género se ha vuelto más relevante en el área médica, ya que es un patógeno causante del SUH (San Joaquín y Pickett, 1988; Bogdanović et al., 1991; Robson et al., 1992; Fang et al., 1999; Monforte-Cirac et al., 2010).
En este estudio, encontramos, mediante amplificación por PCR de los genes stx1 y stx2, que 22/66 (33.3%) de las cepas de aeromonad contenían el gen stx1, 42/66 (63,6%) cepas contenían ambos genes, y no hubo cepas que contuvieran stx2 solo. Esto nos puede llevar a sugerir que este gen está ampliamente distribuido en las cepas de Aeromonas aisladas de pacientes pediátricos y que estos pacientes pueden estar en riesgo de desarrollar SUH.
Solo hay un informe previo en el que se estudiaron los genes stx en cepas de Aeromonas aisladas de diferentes hospitales de España; los resultados obtenidos fueron que 19/80 (23,7%) cepas tenían el gen stx1 y solo 1/80 (1).25%) la cepa fue positiva para ambos genes (Alperi y Figueras, 2010). Estos resultados indican que hay una mayor distribución del gen en cepas mexicanas; sin embargo, debemos tener en cuenta que, en España, el género Aeromonas es un patógeno gastrointestinal conocido aislado de forma rutinaria en pacientes con perfil gastrointestinal, por lo que se da un tratamiento adecuado para enfrentar este género.
En México, este género no está incluido en la lista de patógenos causantes de diarrea y no se aísla de forma rutinaria; como resultado, es difícil dar cualquier tratamiento y buena calidad de vida a los pacientes; además, no hay estadísticas sobre su prevalencia. Además, el género se vuelve más relevante debido a las condiciones socioeconómicas de la población mexicana, que incluyen la escasez de agua; esto facilita su transmisión y aumenta la posibilidad de que el SU se convierta en un problema de salud pública.
Se llevó a cabo la secuenciación de los amplicones y se realizó una búsqueda de Blast, que mostró una similitud del 79-99% y un valor de expectativa de 3e-16/2e-97 entre los genes stx1 / stx2 en comparación con E. coli O157:H7.
Se determinó la LD50 para evaluar el daño citotóxico en cultivos celulares Vero; con este parámetro y con base en Marques et al. (1986), las cepas se pueden agrupar en producción baja (2 × 101 a 6 × 102), moderada (103-104) y alta (105-108) (Figura 1G). Marques et al. (1986) realizaron un estudio en el que realizaron un ensayo similar al del presente estudio, pero con diferentes cepas de STEC, obtuvieron que 262/400 (63%) cepas se agruparon como productoras de Stx bajo, y el 48% produjeron daño citotóxico; sin embargo, en el 40% de estas cepas el daño citotóxico fue inhibido con anticuerpos anti-Stx.
En el presente estudio, el 25,7% de los preparados libres de bacterias causaron daño citotóxico característico de Stx en células Vero, lo que sugiere producción de Stx activo, todas las cepas de Aeromonas se agruparon como bajas productoras de Stx; sin embargo, en el 50-70% de los sobrenadantes libres de células se inhibió el daño celular y en el 20-30% de los sobrenadantes libres de células se redujo el daño celular (Figura 3). Los sobrenadantes libres de células en los que se redujo el daño celular esto podría haber sido debido a dos variantes en la toxina presente en el sobrenadante, en consecuencia, al ser diferentes inmunológicamente, el Stx no pudo inhibirse totalmente y el daño celular permaneció (Marques et al., 1986).
Dos estudios previos (Haque et al., 1996; Alperi y Figueras, 2010) obtuvieron el 10,2% y el 10,53% de cepas Aeromonas productoras de Stx1, respectivamente. La razón de un mayor porcentaje de cepas de Aeromonas que producen Stx activo podría deberse a la alta disponibilidad del bacteriófago Stx dentro del cultivo, ya que algunas cepas STEC portadoras del bacteriófago Stx se han aislado de aguas residuales urbanas de plantas de tratamiento, aguas residuales de mataderos y heces de ganado (García-Aljaro et al., 2004, 2009). De manera similar, se han realizado estudios de transducción in vivo con fagos Stx de E. coli, que pueden infectar bacterias de la microbiota intestinal, dando la característica toxígena a cepas que no estaban infectadas antes (Acheson et al., 1998; Schmidt et al., 1999; Gamage et al., 2003). Lo mismo podría suceder con el género Aeromonas al inducir un perfil gastrointestinal, seguido por el hecho de que el género Aeromonas tiene la capacidad de capturar e integrar factores de virulencia en su genoma, y uno de ellos es el gen codificador Stx.
El resto de cepas causaron daño citotónico en la célula, posiblemente sugiriendo producción de toxinas diferentes a Stx, ya que Aeromonas es un género capaz de producir dos enterotoxinas citotónicas, termoestables (AST) y termolábiles (ALT) (Figueras y Baez-Hidalgo, 2014), que pueden causar daño citotónico en células Vero; otra posibilidad es que las cepas de Aeromonas tengan más de un bacteriófago insertado en su genoma, ya que se ha demostrado que las cepas STEC con doble lisogenia son capaces de regular los bacteriófagos para inhibir la capacidad de inducción del ciclo lítico, lo que resulta en una disminución de la producción de Stx pero sin perder el gen (García-Aljaro et al., 2004; Imamovic y Muniesa, 2011). Por lo tanto, es necesario establecer cuántos bacteriófagos contienen las cepas de Aeromonas, incluso en el presente estudio, para poder correlacionar la presencia de bacteriófagos Stx y la cantidad producida de Stx.
Por otro lado, la presencia de bacteriófagos Stx en Aeromonas inducibles representa un mecanismo de transferencia horizontal del gen stx, pero no es el único. En estudios más recientes, se ha determinado que las Aeromonas son capaces de producir VMO(Guerrero-Mandujano et al., 2015a) y estos OMV son capaces de transportar ADN integrado (Guerrero-Mandujano et al., 2015b). En el presente estudio, amplificamos el gen stx1 a partir del ADN extraído de los VMO de una cepa de A. hydrophila de origen clínico, que indujo daño citotóxico en células Vero, y este daño se inhibió con anticuerpos anti-Stx. Esto indica que el bacteriófago Stx es el mecanismo de transporte del gen stx; además, el OMV y el recientemente llamado Sistema de Transporte Tipo 0 son capaces de propagar el gen stx entre especies o entre especies. Sin embargo, es necesario confirmar si el gen contenido en el OMV está completo. Los resultados obtenidos en este estudio apoyan la hipótesis de que el gen stx es otro factor de virulencia putativo de Aeromonas que podría transferirse a través de VMO. Podría representar otro mecanismo para el transporte horizontal del gen stx a otras cepas de Aeromonas y / u otros géneros bacterianos.
Por esta razón, este género debe ser incluido como posible agente causal de gastroenteritis cuando se trata de identificar agentes causales y debe ser reportado como parte de los procedimientos estándar de vigilancia de la salud.
Contribuciones de los autores
IP-M y AG-M realizaron los experimentos y MR-R realizó los análisis bioinformáticos y redactó el manuscrito; CH-C diseñó la cartilla; VB-G y JM-L comentaron críticamente y revisaron el manuscrito; GC-E concibió el estudio, participó en su diseño y coordinación, evaluó los datos y redactó el manuscrito. Todos los autores leyeron y aprobaron el manuscrito final. Nos gustaría agradecer a Sofia Marteli Mulia por corregir amablemente el estilo del manuscrito.
Funding
GC-E and VB-G received support from Estímulos al Desempeño en Investigación and Comisión y Fomento de Actividades Académicas (Instituto Politécnico Nacional) and Sistema Nacional de Investigadores (SNI, CONACyT). This study was funded by the Secretaría de Investigación y Posgrado del Instituto Politécnico Nacional (SIP 20160609). The SIP-IPN was not involved in the development of the study design, the collection, analysis, and interpretation of data, in the writing of the report nor in the decision to submit the paper for publication. IP-M y AG-M recibieron una beca de CONACyT y BEIFI.
Declaración de Conflicto de Intereses
Los autores declaran que la investigación se realizó en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Agradecimientos
Agradecemos a la Dra. Patricia Arzate Barbosa por proporcionar cepas aisladas y al Dr. Armando Navarro por proporcionar los anticuerpos monoclonales.
Abreviaturas
Ab, Anticuerpo; SUH, Síndrome urémico hemolítico; INP, Instituto Nacional de Pediatría México; LD50, Dosis letal media; OMVs, Outer membrane vesicles; PCR, Polymerase chain reaction; STEC, Shiga toxin-producing E. coli; Stx, Shiga-like toxin; TTP, Thrombotic thrombocytopenic purpura.
Acheson, D. W., Reidl, J., Zhang, X., Keusch, G. T., Mekalanos, J. J., and Waldor, M. K. (1998). In vivo transduction with shiga toxin 1-encoding phage. Infect. Immun. 66, 4496–4498.
Google Scholar
Alperi, A., and Figueras, M. J. (2010). Los aislados humanos de Aeromonas poseen genes de toxina shiga que son (stx1 y stx2) muy similares a las variantes de genes virulentos puente de Escherichia coli. Clin. Microbiol. Infectar. 16, 1563-1567. doi: 10.1111 / j. 1469-0691. 2010. 03203.x
CrossRef Texto Completo | Google Scholar
Bogdanovic, R., Čobeljić, M., Markovic, M., Nikolic, V., Ognjanović, M., Sarjanović, L., et al. (1991). Síndrome hemolítico-urémico asociado a enterocolitis por Aeromonas hydrophila. Pediatra. Nephrol. 5, 293-295. doi: 10.1007
CrossRef Full Text | Google Scholar
Castro-Escarpulli, G., Aguilera-Arreola, M. G., Giono-Cerezo, S., Hernández-Rodríguez, C. H., Rodríguez-Chacón, M., Soler, F. L., et al. (2002). El género Aeromonas> Un patógeno importante en México? Enf. Infec. Micro. 22, 206–216.
Google Scholar
Castro-Escarpulli, G., Figueras, M. J., Aguilera-Arreola, M. G., Soler, L., Fernández-Rendón, E., Aparicio, G. O., et al. (2003). Characterization of Aeromonas spp. aislado de pescado congelado destinado al consumo humano en México. Int. J. Microbiol de los alimentos. 84, 41–49. doi: 10.1016 / S0168-1605(02)00393-8
Texto completo cruzado | Google Scholar
Fang, J. S., Chen, J. B., Chen, W. J., and Hsu, K. T. (1999). Síndrome hemolítico-ureémico en un varón adulto con enterocolitis por Aeromonas hydrophila. Nephrol. Dial. Trasplante. 14, 439–440. doi: 10.1093 / ndt / 14.2.439
Texto completo cruzado / Google Scholar
Figueras, M. J., and Baez-Hidalgo, R. (2014). «Aeromonas,» in Encyclopedia of Food Microbiology, eds C. A. Batt and M. L. Tortorello (Cambridge, MA: Academic Press), 24-30.
Gamage, S. D., Strasser, J. E., Chalk, C. L., and Weiss, A. A. (2003). Escherichia coli no patógena puede contribuir a la producción de la toxina shiga. Infectar. Immun. 71, 3107–3115. doi: 10.1128 / IAI.71.6.3107-3115.2003
CrossRef Full Text | Google Scholar
García-Aljaro, C., Muniesa, M., Jofre, J., and Blanch, A. R. (2004). Prevalencia del gen stx2 en poblaciones de coliformes de ambientes acuáticos. Appl. Environ. Microbiol. 70, 3535–3540. doi: 10.1128 / AEM.70.6.3535-3540.2004
CrossRef Full Text | Google Scholar
García-Aljaro, C., Muniesa, M., Jofre, J., and Blanch, A. R. (2009). Diversidad genotípica y fenotípica entre bacteriófagos portadores de stx2 inducidos de cepas ambientales de Escherichia coli. Appl. Environ. Microbiol. 75, 329–336. doi: 10.1128 / AEM.01367-08
CrossRef Full Text | Google Scholar
Giono-Cerezo, S., Rodríguez-Ángeles, M. G., Rodríguez-Cadena, M. J., and Valdespino-Gómez, J. L. (1994). Identification of enterotoxins and cytotoxins of Escherichia coli by vero cell culture and solid-phase hybridization (colony blot). Rev. Latinoam. Microbiol. 36, 231–241.
Google Scholar
Guerrero-Mandujano, A., López-Villegas, E. O., Longa-Briseño, A., and Castro-Escarpulli, G. (2015a). Producción de vesículas de membrana externa en una cepa clínica de Aeromonas hydrophila. Microbiol CE. 1, 113–117.
Google Scholar
Guerrero-Mandujano, A., Palma-Martínez, I., and Castro-Escarpulli, G. (2015b). Transporte de ADN por vesículas de membrana externa de Aeromonas hydrophila. Microbiol CE. 2, 354–357.
Google Scholar
Haque, Q. M., Sugiyama, A., Iwade, Y., Midorikawa, Y., y Yamauchi, T. (1996). Aislados diarreicos y ambientales de Aeromonas spp. producir una toxina similar a la toxina 1 similar a shiga. Curr. Microbiol. 32, 239–245. doi: 10.1007/s002849900043
CrossRef Full Text | Google Scholar
Hernández-Cortez, C., Aguilera-Arreola, M. G., Chávez-Méndez, Y., Arzate-Barbosa, P., Lara-Hernández, A., and Castro-Escarpulli, G. (2011). Identificación genética de cepas de Aeromonas spp. aisladas en el instituto nacional de pediatría. Rev. Enfer. Infecc. Pediatr. 24, 157–165.
Google Scholar
Hernández-Cortez, C., Méndez-Tenorio, A., Aguilera-Arreola, M. G., and Castro-Escarpulli, G. (2013). Diseño y estandarización de cuatro reacciones en cadena de polimerasa múltiple para detectar bacterias que causan enfermedades gastrointestinales. Afr. J. Microbiol. Res. 7, 2673-2681. doi: 10.5897/AJMR2013.5452
CrossRef Texto Completo | Google Scholar
Imamovic, L., y Muniesa, M. (2011). Cuantificación y evaluación de la infectividad de bacteriófagos codificadores de toxinas shiga en carne de res y ensalada. Appl. Environ. Microbiol. 77, 3536–3540. doi: 10.1128 / AEM.02703-10
CrossRef Texto Completo | Google Scholar
Marques, L. R. M., Moore, M. A., Wells, J. G., Wachsmuth, I. K., y O’Brien, A. D. (1986). Producción de toxina similar a shiga por Escherichia coli. J. Infectar. Dis. 154, 338–341. doi: 10.1093 / infdis / 154.2.338
Texto completo cruzado/Google Scholar
Mauro, S.A., y Koudelka, G. B. (2011). Toxina Shiga: expresión, distribución y su papel en el medio ambiente. Toxinas 3, 608-625. doi: 10.3390/toxins3060608
CrossRef Texto Completo | Google Scholar
Monforte-Cirac, M. L., Palacian-Ruiz, M. P., Aisa-Iriarte, M. L., and Espuelas-Monge, M. (2010). Síndrome hemolítico urémico por Aeromonas: a propósito de un caso clínico. Rev. Clin. Esp. 210, 206–207. doi: 10.1016/j.rce.2009.08.002
CrossRef Full Text | Google Scholar
Robson, W. L. M., Leung, A. K. C., and Trevenen, C. L. (1992). Haemolytic-uraemic syndrome associated with Aeromonas hydrophila enterocolitis. Pediatr. Nephrol. 6, 221–222. doi: 10.1007
CrossRef Full Text | Google Scholar
San Joaquín, V. H., and Pickett, D. A. (1988). Gastroenteritis asociada a aeromonas en niños. Pediatra. Infectar. Dis. J. 7, 53-57. doi: 10.1097 / 00006454-198801000-00013
CrossRef Full Text | Google Scholar
Schmidt, H., Bielaszewska, M., and Karch, H. (1999). Transducción de aislados entéricos de Escherichia coli con un derivado del bacteriófago codificador de la toxina shiga f3538 aislado de Escherichia coli O157: H7. Appl. Environ. Microbiol. 65, 3855–3861.
Google Scholar