Plasticidad muscular
El músculo esquelético es el tejido más grande del cuerpo. Es altamente plástico y puede sufrir cambios dramáticos no patológicos tanto en masa como en fuerza en respuesta a una miríada de influencias ambientales. Después del ejercicio de resistencia o la exposición a esteroides anabólicos, los músculos se someten a hipertrofia y aumentan su masa, área de sección transversal y fuerza (Aagaard, 2004; Schiaffino et al., 2013). Estos mismos parámetros pueden declinar precipitadamente cuando los músculos inician atrofia en respuesta a cualquiera de la gama de insultos que incluyen: inanición, denervación, inmovilización, sepsis, caquexia por cáncer, insuficiencia cardíaca, diabetes, insuficiencia renal, trastorno pulmonar obstructivo crónico y síndrome de inmunodeficiencia adquirida (Schiaffino et al., 2013).
Las consecuencias de la atrofia tienen implicaciones obvias para la salud. La debilidad muscular es un importante contribuyente tanto a la mortalidad como a la morbilidad y se asocia con un mayor riesgo de todas las causas de muerte (Metter et al., 2002). De hecho, reducir la atrofia muscular en la caquexia del cáncer puede prolongar significativamente la vida (Zhou et al., 2010). Además, muchas personas mayores sufren de sarcopenia, un trastorno de desgaste muscular prolongado que generalmente comienza después de los 50 años e implica una pérdida de aproximadamente el 1% de la masa muscular al año (Woo, 2017). Esto significa que a la edad de 80 años, las personas sarcopénicas han perdido aproximadamente el 40% de su masa muscular, un factor clave en las caídas, la fragilidad y las admisiones en hogares de ancianos. En consecuencia, comprender los mecanismos y las posibles respuestas terapéuticas a la atrofia es de amplio interés básico y clínico (Ali y García, 2014; Cohen et al., 2015; Ziaaldini et al., 2017).
Hipótesis de dominio mionuclear
El músculo esquelético es bastante único en que las células maduras son sincitiales y pueden contener cientos de núcleos. Esta es una adaptación necesaria dado que las fibras musculares individuales pueden ser enormes, alcanzando longitudes de hasta ~600 mm (23 pulgadas) (por ejemplo, músculo sartorius; Yang et al., 1998) y volúmenes que pueden ser más de 100.000 veces mayores que una célula mononucleada típica (Bruusgaard et al., 2003). Se requieren las contribuciones de múltiples núcleos para producir grandes cantidades de ARNm necesarias para dirigir la prodigiosa síntesis de proteínas requerida para generar y mantener el aparato contráctil(Nevalainen et al., 2013).
Tanto la naturaleza plástica del músculo como su organización sincitial han dado lugar a una controversia que parece haberse resuelto recientemente: la «hipótesis del dominio mionuclear» (Qaisar y Larsson, 2014; Gundersen, 2016; Schwartz et al., 2016). Esta teoría tiene su origen en el concepto de «Wirkungssphäre» o «esfera de influencia» propuesto por Strassburger (1893), en el que argumentaba que un núcleo solo puede soportar un volumen discreto de citoplasma, definiendo así los límites superiores al tamaño de la célula. Este principio fue desarrollado por Gregory (2001) quien argumentó que el contenido y el volumen de ácido desoxirribonucleico celular están estrechamente acoplados. La naturaleza sincicial del músculo esquelético ayuda a estas células a superar esta limitación. La hipótesis del dominio mionuclear dicta que, para mantener la relación nuclear-citoplasmática adecuada, se agregan nuevos núcleos durante la hipertrofia y se pierden con la atrofia.
Hay datos sustanciales que demuestran que el número nuclear aumenta con la hipertrofia muscular (Moss, 1968; Cabric y James, 1983; Egner et al., 2016), aunque sigue habiendo cierta controversia (Murach et al., 2018). Este proceso ha sido un área de intensa investigación y recientemente se han definido algunos de los mecanismos moleculares subyacentes que regulan la adquisición de nuevos núcleos durante la hipertrofia(Guerci et al., 2012; Bentzinger et al., 2014; Ross et al., 2018). Estos núcleos supernumerarios se adquieren cuando las células madre restringidas por linaje, típicamente células satélite, se fusionan con fibras musculares y aportan sus núcleos (Brack y Rando, 2012; Bachman et al., 2018). Las células satélite residen debajo de la membrana basal y colindan con el sarcolema (Katz, 1961; Mauro, 1961). Permanecen quietos hasta que son estimulados por esteroides anabólicos como la testosterona o por una lesión focal después del ejercicio de resistencia, momento en el que vuelven a entrar en el ciclo celular y proliferan (Joubert y Tobin, 1995; Abreu et al., 2017). Algunas de las células hijas se fusionan con la fibra muscular y facilitan la reparación y el crecimiento, mientras que otras detienen y reconstituyen la piscina satélite(Dumont et al., 2015; Goh y Millay, 2017). Las células sobrantes restantes sufren apoptosis (Schwartz, 2008).
El aspecto controvertido de la hipótesis del dominio mionuclear es la afirmación de que los mionucleos se pierden durante la atrofia. Hay muchas intervenciones que inducen atrofia en modelos animales, incluyendo: inmovilización, denervación y sepsis (Fitts et al., 1986; Minnaard et al., 2005; O’Leary et al., 2012). En cada caso, hay una pérdida neta de área de sección transversal muscular (el ensayo primario) y la aparición de células apoptóticas dentro del tejido (McCall et al., 1998; Smith et al., 2000; Strasser et al., 2000; Alway et al., 2003; McClung et al., 2007; Andrianjafiniony et al., 2010; Guo et al., 2012; Palumbo et al., 2012; Barnes et al., 2015; Cheema et al., 2015; Li et al., 2016; Kletzien et al., 2018). En estos estudios, la apoptosis se mide en una variedad de métodos, incluida la activación de caspasa, la liberación de EndoG mitocondrial o la fragmentación del ADN . Estos estudios proporcionan datos convincentes de que la apoptosis aumenta drásticamente durante la fase temprana de la atrofia. Por ejemplo, en un estudio exhaustivo reciente (Guo et al., 2012), Guo et al. se sometió a ratones a 14 días de suspensión de la extremidad posterior, un tratamiento que resultó en una reducción de ~69% en el peso húmedo muscular y una reducción de ~43,8% en el área de la sección transversal en relación con el músculo contralateral no manipulado. Los autores también cuantificaron una serie de marcadores de apoptosis, incluida la tinción de TÚNEL, la escisión/activación de caspasa-3 y la escisión de la poli (adenosina difosfato ribosa) polimerasa (PARP), una proteína involucrada en la reparación del ADN. Cada una de estas medidas de apoptosis aumentó significativamente después de la suspensión de la extremidad posterior. Si bien el objetivo principal de este artículo fue evaluar el impacto positivo de la estimulación eléctrica en la atrofia limitante después de un insulto, ellos y muchos otros investigadores interpretan este tipo de datos como un fuerte apoyo para la hipótesis del dominio mionuclear.
Desde una perspectiva biológica celular, la presunta pérdida de núcleos dentro de un tejido sincitial como el músculo esquelético presenta un problema práctico importante. ¿Cómo puede un núcleo individual estar tan comprometido que su genoma se condense y fragmente rápidamente mientras sus vecinos persisten y ayudan a mantener la viabilidad de la fibra muscular? Dado que la apoptosis suele estar mediada por la activación de la clase de proteasas cisteína conocidas como caspasas, no está claro qué mecanismo podría servir para restringir la actividad de una proteasa difusible dentro de un citoplasma común.
Esta pregunta se ha abordado indirectamente en otro tipo de células sincitiales, el sincitiotrofoblasto humano, un tejido que rodea la placenta y contiene aproximadamente 5 × 1010 núcleos (Mayhew et al., 1999). Cuando se induce la apoptosis en el sincitiotrofoblasto, se propaga como una onda a una velocidad de aproximadamente 5 micras por minuto hasta que todo el tejido está involucrado (Longtine et al., 2012). En consecuencia, no hay regiones «privilegiadas» dentro del citoplasma sincicial y todos los núcleos son finalmente destruidos.
Uno de los desafíos clave para analizar la apoptosis en el músculo esquelético es que es un tejido muy heterogéneo, donde aproximadamente la mitad de sus núcleos residen fuera de las fibras musculares (Schmalbruch y Hellhammer, 1977). Estas células mononucleadas incluyen células satélite, células endoteliales, fibroblastos, pericitos y macrófagos (Tedesco et al., 2010). En consecuencia, es muy difícil determinar de qué lado del sarcolema reside un núcleo y, por lo tanto, si es un verdadero mionucleo.
Imágenes In Vivo a Intervalos de Tiempo de Fibras Musculares de Ratón Marcadas
A pesar del gran número de artículos que demuestran apoptosis durante la atrofia muscular, varios autores han cuestionado estos resultados (Wada et al., 2002; Zhong et al., 2005; Aravamudan et al., 2006; Gundersen y Bruusgaard, 2008; Duddy et al., 2011; Qaisar y Larsson, 2014). Por ejemplo, utilizando fibras musculares aisladas in vitro, Duddy et al. se observó que, si bien el volumen de fibra muscular disminuyó con el tiempo, reflejando un proceso atrófico, el número de mionucleos parecía ser estable (Duddy et al., 2011).
En una serie de experimentos elegantes, el laboratorio de Gundersen inyectó fibras musculares del extensor digital largo (EDL) o del músculo sóleo con tintes que marcaban de forma independiente los núcleos y el citoplasma en ratones anestesiados (Bruusgaard y Gundersen, 2008; Bruusgaard et al., 2010). Esto les permitió identificar cada núcleo dentro de las fibras musculares individuales in vivo a lo largo del tiempo y luego evaluar su destino. Por ejemplo, los músculos EDL fueron inducidos a hipertrofia por la ablación de sus principales sinergistas (Bruusgaard et al., 2010). Entre los días 6 y 11, el número de mionucleos aumentó en aproximadamente un 54% y entre los días 9 y 14 hubo un aumento del 35% en el área de la sección transversal (Figura 1). Estos datos son consistentes con la hipótesis de que los músculos adquieren núcleos supernumerarios antes del crecimiento mayor de la fibra durante la hipertrofia.

la Figura 1. Los mionucleos se adquieren durante la hipertrofia, pero no se pierden durante la atrofia en ratones. Micrografías de la misma fibra muscular EDL a lo largo del tiempo después de la inducción de hipertrofia (fila superior) y la inducción posterior de atrofia (fila inferior). Se utilizaron oligonucleótidos marcados fluorescentemente para visualizar los núcleos in vivo. Las líneas punteadas representan el sarcolema. Barra de escala = 50 µm. (Adaptado de Bruusgaard et al., 2010. Utilizado con permiso de las Actas de la Academia Nacional de Ciencias.)
Luego examinaron el destino de estos mionuclei identificables de forma única en las mismas fibras musculares cuando fueron inducidos a sufrir atrofia. La denervación condujo a una reducción de aproximadamente el 50% en el volumen de fibra muscular, pero sin pérdida de mionucleos (Figura 1; Bruusgaard et al., 2010). La falta de observación de pérdida nuclear no se debió al estímulo atrófico empleado, ya que obtuvieron los mismos resultados cuando los músculos fueron inducidos a atrofia en respuesta al bloqueo nervioso inducido por tetrodotoxina, suspensión de las extremidades posteriores, caquexia por cáncer o desentrenamiento (Bruusgaard y Gundersen, 2008; Bruusgaard et al., 2010; Winje et al., 2018a). De hecho, durante el curso de sus estudios, examinaron más de 200,000 mionucleos individuales en músculos atróficos y observaron solo 4 núcleos TUNEL-positivos (apoptóticos), lo que representa una pérdida de solo ~0.002% de los núcleos (Bruusgaard et al., 2012). Estos datos apoyan firmemente la hipótesis de que la atrofia del músculo esquelético no va acompañada de muerte mionuclear.
Músculo de insecto como modelo
Por poderosos que sean estos estudios, existen algunas limitaciones inherentes al uso de modelos de mamíferos. En primer lugar, invariablemente se basan en intervenciones experimentales como la denervación para inducir atrofia muscular. En segundo lugar, el músculo contralateral se usa típicamente como control interno, aunque también está expuesto a algunas de las mismas señales ambientales, como las hormonas del estrés (Bonaldo y Sandri, 2013). Por último, los músculos esqueléticos también pueden sufrir muerte celular programada (PCD) durante el desarrollo, y estos modelos rara vez abordan el papel de la apoptosis en estas células.
Un modelo alternativo que no sufre de ninguna de estas limitaciones, y que permite el estudio de núcleos musculares tanto durante la atrofia como durante la CPD natural, es el músculo intersegmental (IS) de la Manduca sexta de la artemisa del tabaco. Los ISMOS están compuestos por láminas de fibras musculares gigantes, donde cada célula mide aproximadamente 5 mm de largo y hasta 1 mm de diámetro (Figura 2A). Los ismos se adhieren a los límites segmentarios dentro del abdomen y generan tanto el comportamiento de arrastre de las larvas como el comportamiento de eclosión (emergencia) de la polilla adulta cuando escapa de la cutícula de la pupa al final de la metamorfosis.
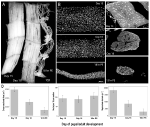
la Figura 2. Retención de mionucleos durante la atrofia y la muerte de los músculos intersegmentales (ISMOS) de la polilla Manduca sexta. A) ISMOS de tres etapas de desarrollo: homeostático (días 15 de desarrollo pupal-adulto; izquierda); atrófico (día 18; medio); y morir (18 h post-eclosión; derecha). La barra de escala es igual a ~1 mm (adaptado de Schwartz et al., 2016). (B) Los ISM de estas mismas etapas de desarrollo se limpiaron y teñieron con el tinte nuclear DAPI y se visualizaron mediante microscopía confocal (adaptado de Schwartz et al., 2016). C) Las secciones de fibra ISM (10 µm) se teñían con el tinte nuclear DAPI. Nótese la dramática pérdida de proteína muscular (área gris clara) durante la atrofia y la muerte, pero la retención de núcleos en todas las etapas (adaptado de Schwartz et al., 2016). (D) Cuantificación del volumen de fibra ISM (izquierda), el número nuclear (medio) y el tamaño del dominio mionuclear (derecha) durante la homeostasis, la atrofia y la muerte. (Media ± error estándar.) (Adaptado de Schwartz et al., 2016).
En el día 15 de los 18 días normales de desarrollo pupal-adulto, los ISMs inician un programa de atrofia desencadenado hormonalmente que resulta en una pérdida de masa del 40% en el momento de la eclosión 3 días después (Figura 2A; Schwartz y Truman, 1983). Esta pérdida dramática de masa muscular es equivalente a la observada en individuos de 80 años con sarcopenia, pero se produce durante 3 días en lugar de 30 años. Si bien los ISMOS pierden masa, conservan propiedades fisiológicas normales, como el potencial de reposo y el área de fuerza / sección transversal (Schwartz y Ruff, 2002). Los ISMs se utilizan para generar el comportamiento de eclosión al final del día 18 y luego iniciar PCD, ambos activados por una hormona peptídica (Schwartz y Truman, 1982, 1983). .
A diferencia de los músculos de los mamíferos, los ISMOS no contienen capilares, células satélite, células endoteliales o pericitos, lo que significa que prácticamente todos los núcleos del tejido residen dentro de las propias fibras musculares (Beaulaton y Lockshin, 1977). Utilizamos dos métodos independientes para monitorear el destino nuclear durante la atrofia y la muerte en este modelo(Schwartz et al., 2016). El primero fue un enfoque anatómico estándar. Cuando los ISMOS sufren atrofia y muerte, hay reducciones dramáticas tanto en el volumen como en el área de la sección transversal de las fibras, pero en gran medida, el número nuclear no se modificó (Figura 2B). Utilizando tejidos seccionados para estudios cuantitativos, encontramos que hubo una reducción de ~49% en el área de la sección transversal de la fibra durante la atrofia y una disminución adicional del 30% durante las primeras etapas de la muerte (Figuras 2C,D; Schwartz et al., 2016). Sin embargo, el número de núcleos no cambió durante este mismo período, lo que significa que funcionalmente hubo una reducción del 84% en el dominio mionuclear.
El segundo método que empleamos fue medir el contenido de ADN de fibras musculares individuales de animales en el día 13, cuando los músculos son homeostáticos, hasta 18 h después de la eclosión, cuando los músculos están altamente degenerados (Schwartz et al., 2016). Cuantificamos el contenido de ADN de 420 células individuales y encontramos que no hubo pérdida significativa durante el desarrollo. Estos análisis bioquímicos concuerdan bien con los datos anatómicos y sugieren que la concentración relativa de ambos núcleos y ADN genómico aumentó funcionalmente a medida que los músculos se atrofiaron y murieron. En consecuencia, los datos de ratones y polillas sugieren que los núcleos musculares no experimentan apoptosis durante la atrofia (o PCD) y llevan a la conclusión de que la hipótesis del dominio mionuclear debe rechazarse.
Conclusiones
Estas observaciones tienen una serie de implicaciones tanto para comprender la biología básica del músculo como para desarrollar posibles intervenciones terapéuticas. Si bien hay datos sustanciales que reportan la presencia de núcleos apoptóticos dentro del tejido después de insultos atróficos, datos recientes sugieren que estos no son verdaderos mionucleos, sino más bien, células mononucleares condenadas que residen fuera de la fibra muscular. La razón principal de esta discrepancia es que las herramientas tradicionales utilizadas para detectar la apoptosis carecen de la resolución necesaria para determinar adecuadamente de qué lado del sarcolema reside una célula moribunda. Métodos que etiquetan específicamente a los mionuclei, ya sea a través de inyecciones in vivo de colorantes fluorescentes (Bruusgaard y Gundersen, 2008) o a través de manipulaciones genéticas para expresar proteínas marcadoras (Duddy et al., 2011), revelan pocos núcleos apoptóticos o ninguno dentro de las fibras marcadas. La reciente demostración de que los anticuerpos dirigidos contra el Material Pericentriolar proteico 1 (PCM1) solo el myonuclei auténtico de la etiqueta ofrece una herramienta prometedora que se puede aplicar a los materiales histológicos tradicionales que se analizan rutinariamente en el campo (Winje et al., 2018b).
El hecho de que los músculos esqueléticos no empleen la apoptosis como mecanismo para eliminar los mionucleos no es sorprendente. Parece que el músculo esquelético maduro está impedido en gran medida de iniciar la apoptosis, ya que regula al alza la expresión de proteínas de supervivencia potentes como el inhibidor de la proteína de apoptosis ligado al cromosoma X (XIAP) (Smith et al., 2009) y represor de apoptosis con dominio de reclutamiento de caspasa (ARC) (Xiao et al., 2011), expresando simultáneamente bajos niveles de mediadores de apoptosis como el factor activador de la proteasa apoptótica 1 (Apaf-1) (Burgess et al., 1999). Esto tiene sentido teleológicamente, ya que los músculos están sujetos a perturbaciones extremas, incluida la interrupción del sarcolema después de un ejercicio intenso, por lo que sería catastrófico si desencadenaran la muerte celular en lugar de iniciar la reparación de tejidos y posiblemente la hipertrofia. Al igual que otras células diferenciadas terminales, los músculos tienden a emplear mecanismos no apoptóticos, sobre todo PCD autofágica (también conocida como degeneración Tipo II) (Clarke, 1990; Schwartz et al., 1993; Kole et al., 2013; Ginet et al., 2014) cuando mueren durante el desarrollo.
Incluso si hubiera un mecanismo por el cual los músculos pudieran apuntar selectivamente a núcleos individuales, no está claro que esto sea beneficioso. De hecho, la retención de núcleos» excedentes » durante la atrofia confiere una clara ventaja para el individuo, ya que los músculos esqueléticos con frecuencia experimentan ciclos de atrofia e hipertrofia en respuesta a condiciones ambientales como la disponibilidad de alimentos. La capacidad de recuperarse rápidamente mediante la utilización de mionucleos preexistentes puede desempeñar un papel importante en la adaptación (Jackson et al., 2012) y ayudan a explicar el fenómeno de la «memoria muscular» (Staron et al., 1991; Gundersen, 2016). Está bien documentado en el campo de la fisiología del ejercicio que es mucho más fácil recuperar un cierto nivel de aptitud muscular a través del ejercicio que alcanzarlo en primer lugar, incluso si ha habido un largo período de desentrenamiento. En otras palabras, la frase «úsalo o piérdelo» podría articularse con mayor precisión como «úsalo o piérdelo, hasta que vuelva a trabajar en ello.»Esto ha sido demostrado directamente por otro experimento del laboratorio Gundersen que demostró que una vez que un músculo ha adquirido nuevos núcleos, los retiene mucho después de que se elimina el estímulo hipertrófico. Indujeron hipertrofia muscular en ratones hembra tratándolos durante 2 semanas con testosterona y luego examinaron los músculos 3 semanas después de la abstinencia de esteroides (Egner et al., 2013). El volumen muscular había vuelto a la línea de base, pero los núcleos recién adquiridos persistieron incluso 3 meses después. Cuando los músculos fueron sometidos a sobrecarga para reiniciar la hipertrofia, los tratados con esteroides experimentaron rápidamente un aumento del 36% en el volumen de fibra, mientras que los músculos de control solo crecieron un 6%. Estos datos sugieren que los núcleos» excedentes » podrían movilizarse rápidamente para facilitar el reciclaje.
Estas observaciones tienen implicaciones potenciales para las políticas de salud pública. Se ha demostrado que el crecimiento muscular, la función fisiológica y la capacidad regenerativa disminuyen con la edad, en gran parte debido a la reducción de la proliferación de células satélite (Blau et al., 2015). En consecuencia, el ejercicio durante la adolescencia, cuando el crecimiento muscular se ve mejorado por las hormonas, la nutrición y una sólida piscina satélite, podría servir funcionalmente para permitir a los individuos «almacenar» mionucleos que podrían ser utilizados más adelante en la vida para ralentizar los efectos del envejecimiento y posiblemente prevenir la sarcopenia.
además, estos datos tienen implicaciones en el área de los deportes competitivos. El uso de esteroides anabólicos es un estímulo potente para la hipertrofia muscular y la adición de nuevos mionucleos (Egner et al., 2013). Dado que estos núcleos persisten mucho después de que termina el uso de esteroides, es probable que los atletas obtengan los beneficios del uso de drogas ilegales sin el riesgo de detección.
En resumen, mientras que la adición de nuevos núcleos con crecimiento muscular es ampliamente aceptada, la pérdida apoptótica de núcleos con atrofia no puede ser apoyada, lo que sugiere que la interpretación estricta de la hipótesis del dominio mionuclear no puede ser apoyada. En cambio, parece que una vez adquiridos, los mionucleos persisten incluso cuando un músculo se atrófica o inicia la muerte celular.
Contribuciones del autor
El autor confirma ser el único contribuyente de este trabajo y lo ha aprobado para su publicación.
Financiación
El trabajo para esta publicación fue apoyado por fondos del Fondo de Cátedras Eugene M. y Ronnie Isenberg. No se proporcionó apoyo corporativo al autor y no se mencionan ni respaldan productos comerciales.
Declaración de conflicto de Intereses
El autor declara que la investigación se realizó en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Agradecimientos
El autor desea agradecer a la Sra. Christine Brown por su ayuda en la preparación de este manuscrito y a la Dotación de la Cátedra Eugene M. y Ronnie Isenberg por su apoyo.
Aagaard, P. (2004). Hacer que los músculos sean «más fuertes»: ejercicio, nutrición, medicamentos. J. Musculoskelet. Neuronal. Interactuar. 4, 165–174.
Resumen de PubMed/Google Scholar
Abreu, P., Mendes, S. V., Ceccatto, V. M., y Hirabara, S. M. (2017). Activación de células satélite inducida por adaptación muscular aeróbica en respuesta al ejercicio de resistencia en humanos y roedores. Ciencias de la Vida. 170, 33–40. doi: 10.1016 / j.eft.2016.11.016
Resumen de PubMed / Texto completo Cruzado/Google Scholar
Ali, S., and Garcia, J. M. (2014). Sarcopenia, caquexia y envejecimiento: diagnóstico, mecanismos y opciones terapéuticas-una mini revisión. Gerontology 60, 294-305. doi: 10.1159 / 000356760
Resumen de PubMed / Texto completo cruzado/Google Scholar
Alway, S. E., Martyn, J. K., Ouyang, J., Chaudhrai, A., and Murlasits, Z. S. (2003). Id2 expression during apoptosis and satellite cell activation in unloaded and loaded quail skeletal muscles. Am. J. Physiol. Regul. Integr. Comp. Physiol. 284, R540–R549. doi: 10.1152/ajpregu.00550.2002
PubMed Abstract | CrossRef Full Text | Google Scholar
Andrianjafiniony, T., Dupre-Aucouturier, S., Letexier, D., Couchoux, H., and Desplanches, D. (2010). Oxidative stress, apoptosis, and proteolysis in skeletal muscle repair after unloading. Am. J. Phys. Cell Physiol. 299, C307–C315. doi: 10.1152/ajpcell.00069.2010
Resumen de PubMed / Texto completo Cruzado / Google Scholar
Aravamudan, B., Mantilla, C. B., Zhan, W. Z., y Sieck, G. C. (2006). Efectos de denervación en el tamaño del dominio mionuclear de las fibras de diafragma de rata. J. Appl. Fisiol. 100, 1617–1622. doi: 10.1152 / japplfisiol.01277.2005
Texto completo de CrossRef | Google Scholar
Bachman, J. F., Klose, A., Liu, W., Paris, N. D., Blanc, R. S., Schmalz, M., et al. (2018). El crecimiento del músculo esquelético prepúbero requiere una contribución mionuclear derivada de células satélite de Pax 7. Desarrollo 145: 167197.
Google Scholar
Barnes, B. T., Confides, A. L., Rich, M. M., y Dupont-Versteegden, E. E. (2015). Distintas vías apoptóticas musculares se activan en músculos con diferentes tipos de fibra en un modelo de miopatía de enfermedad crítica en ratas. J. Muscle Res.Célula Móvil. 36, 243–253. doi: 10.1007 / s10974-015-9410-8
Resumen de PubMed / Texto completo cruzado/Google Scholar
Beaulaton, J., and Lockshin, R. A. (1977). Estudio ultraestructural de la degeneración normal de los músculos intersegmentales de Anthereae polyphemus y Manduca sexta (insecta, lepidoptera) con especial referencia a la autofagia celular. J. Morphol. 154, 39–57. doi: 10.1002 / jmor.1051540104
Resumen de PubMed | Texto completo Cruzado/Google Scholar
Bentzinger, C. F., von Maltzahn, J., Dumont, N. A., Stark, D. A., Wang, Y. X., Nhan, K., et al. (2014). Wnt 7a estimula la motilidad y el injerto de células madre miogénicas, lo que mejora la fuerza muscular. J. Cell Biol. 205, 97–111. doi: 10.1083 / jcb.201310035
Resumen de PubMed / Texto completo Cruzado / Google Scholar
Blau, H. M., Cosgrove, B. D., and Ho, A. T. (2015). El papel central de las células madre musculares en el fracaso regenerativo con el envejecimiento. NAT. Mediterráneo. 21, 854–862. doi: 10.1038/nm.3918
Resumen de PubMed | Texto completo cruzado | Google Scholar
Bonaldo, P., y Sandri, M. (2013). Mecanismos celulares y moleculares de atrofia muscular. Dis. Modelo. Mech. 6, 25–39. doi: 10.1242 / dmm.010389
CrossRef Full Text/Google Scholar
Brack, A. S., and Rando, T. A. (2012). Células madre específicas de tejidos: lecciones de la célula satélite del músculo esquelético. Célula Madre 10, 504-514. doi: 10.1016 / j.stem.2012.04.001
Resumen de PubMed / Texto completo Cruzado / Google Scholar
Bruusgaard, J.C., Egner, I. M., Larsen, T. K., Dupre-Aucouturier, S., Desplanches, D., and Gundersen, K. (2012). No hay cambio en el número mionuclear durante la descarga y recarga muscular. J. Appl. Fisiol. 113, 290–296. doi: 10.1152 / japplfisiol.00436.2012
Resumen de PubMed / Texto completo Cruzado / Google Scholar
Bruusgaard, J.C., and Gundersen, K. (2008). La microscopía de lapso de tiempo in vivo no revela pérdida de mionuclei murino durante semanas de atrofia muscular. J. Clin. Invertir. 118, 1450–1457. doi: 10.1172 / JCI34022
Resumen PubMed / Texto completo cruzado / Google Scholar
Bruusgaard, J.C., Johansen, I. B., Egner, I. M., Rana, Z. A., and Gundersen, K. (2010). Los mionucleos adquiridos por sobrecarga de ejercicio preceden a la hipertrofia y no se pierden en el desentrenamiento. Proc. Natl. Acad. Sci. U. S. A. 107, 15111-15116. doi: 10.1073 / pnas.0913935107
CrossRef Texto Completo | Google Scholar
Bruusgaard, J. C., Liestol, K., Ekmark, M., Kollstad, K., and Gundersen, K. (2003). Número y distribución espacial de núcleos en las fibras musculares de ratones normales estudiados in vivo. J. Physiol. 551, 467–478. doi: 10.1113 / jfisiol.2003.045328
PubMed Abstract | CrossRef Texto Completo | Google Scholar
Burgess, D. H., Svensson, M., Dandrea, T., Gronlund, K., Hammarquist, F., Orrenius, S., et al. (1999). Los citosoles del músculo esquelético humano son refractarios a la activación dependiente del citocromo c de las caspasas de tipo II y carecen de APAF-1. La Muerte Celular Difiere. 6, 256–261. doi: 10.1038 / sj.cdd.4400489
Resumen de PubMed | Texto completo cruzado/Google Scholar
Cabric, M., and James, N. T. (1983). Análisis morfométricos de los músculos de perros entrenados y no entrenados para hacer ejercicio. Ser. J. Anat. 166, 359–368. doi: 10.1002 / aja.1001660309
Resumen de PubMed | Texto completo cruzado/Google Scholar
Cheema, N., Herbst, A., McKenzie, D., and Aiken, J. M. (2015). La apoptosis y la necrosis median la pérdida de fibra del músculo esquelético en anomalías enzimáticas mitocondriales inducidas por la edad. Celda de envejecimiento 14, 1085-1093. doi: 10.1111 / acel.12399
Resumen de PubMed | Texto completo de CrossRef/Google Scholar
Clarke, P. G. (1990). Muerte celular del desarrollo: diversidad morfológica y múltiples mecanismos. Anat. Embryol. 181, 195–213.
Google Scholar
Cohen, S., Nathan, J. A., y Goldberg, A. L. (2015). Desgaste muscular en la enfermedad: mecanismos moleculares y terapias prometedoras. NAT. Modif. De La Droga Descubierta. 14, 58–74. doi: 10.1038 /nrd4467
Resumen de PubMed / Texto completo cruzado / Google Scholar
Duddy, W. J., Cohen, T., Duguez, S., and Partridge, T. A. (2011). La fibra muscular aislada como modelo de atrofia en desuso: caracterización mediante PhAct, un método para cuantificar la f-actina. Exp. Cell Res. 317, 1979-1993. doi: 10.1016 / j. yexcr.2011.05.013
Resumen de PubMed | Texto completo Cruzado | Google Scholar
Dumont, N. A., Wang, Y. X., and Rudnicki, M. A. (2015). Mecanismos intrínsecos y extrínsecos que regulan la función de las células satélite. Development 142, 1572-1581. doi: 10.1242/dev.114223
Resumen de PubMed / Texto completo cruzado / Google Scholar
Egner, I. M., Bruusgaard, J.C., Eftestol, E., and Gundersen, K. (2013). Un mecanismo de memoria celular ayuda a la hipertrofia muscular por sobrecarga mucho después de una exposición episódica a esteroides anabólicos. J. Physiol. 591, 6221–6230. doi: 10.1113 / jfisiol.2013.264457
Resumen de PubMed / Texto completo cruzado / Google Scholar
Egner, I. M., Bruusgaard, J.C., and Gundersen, K. (2016). El agotamiento de células satélite previene la hipertrofia de la fibra en el músculo esquelético. Development 143, 2898-2906. doi: 10.1242/dev.134411
Resumen de PubMed | Texto completo Cruzado/Google Scholar
Fitts, R. H., Metzger, J. M., Riley, D. A., and Unsworth, B. R. (1986). Modelos de desuso: una comparación de suspensión e inmovilización de las extremidades posteriores. J. Appl. Fisiol. 60, 1946–1953.
Google Scholar
Ginet, V., Pittet, M. P., Rummel, C., Osterheld, M. C., Meuli, R., Clarke, P. G., et al. (2014). Las neuronas moribundas en el tálamo de recién nacidos a término asfixiados y ratas son autofágicas. Ana. Neurol. 76, 695–711. doi: 10.1002 / ana.24257
Resumen de PubMed / Texto completo cruzado / Google Scholar
Goh, Q., and Millay, D. P. (2017). Requisito de fusión de células madre mediada por miómaker para la hipertrofia muscular esquelética. elife 6. doi: 10.7554 / eLife.20007
Resumen de PubMed | Texto completo de CrossRef/Google Scholar
Gregory, T. R. (2001). ¿Coincidencia, coevolución o causalidad? Contenido de ADN, tamaño de la célula, y el enigma del valor C. Biol. Apo. Camb. Philos. Soc. 76, 65–101. doi: 10.1017 / s1464793100005595
Resumen de PubMed | Texto completo cruzado/Google Scholar
Guerci, A., Lahute, C., Hebrard, S., Collard, L., Graindorge, D., Favier, M., et al. (2012). Las señales paracrinas dependientes de Srf producidas por miofibras controlan la hipertrofia muscular esquelética mediada por células satélite. Metab de Celulares. 15, 25–37. doi: 10.1016 / j.cmet.2011.12.001
Resumen de PubMed | Texto completo Cruzado/Google Scholar
Gundersen, K. (2016). Memoria muscular y un nuevo modelo celular para la atrofia e hipertrofia muscular. J. Exp. Biol. 219, 235–242. doi: 10.1242 / jeb.124495
Resumen de PubMed / Texto completo de CrossRef / Google Scholar
Gundersen, K., and Bruusgaard, J.C. (2008). Dominios nucleares durante la atrofia muscular: ¿núcleos perdidos o paradigma perdido? J. Physiol. 586, 2675–2681. doi: 10.1113 / jfisiol.2008.154369
Resumen de PubMed | Texto completo cruzado | Google Scholar
Guo, B. S., Cheung, K. K., Yeung, S. S., Zhang, B. T., and Yeung, E. W. (2012). La estimulación eléctrica influye en la proliferación de células satélite y la apoptosis en la atrofia muscular inducida por descarga en ratones. PLoS One 7: e30348. doi: 10.1371 / journal.ponga.0053523
Resumen de PubMed | Texto completo Cruzado/Google Scholar
Jackson, J. R., Mula, J., Kirby, T. J., Fry, C. S., Lee, J. D., Ubele, M. F., et al. (2012). El agotamiento de células satélite no inhibe el crecimiento del músculo esquelético adulto después de la atrofia inducida por la descarga. Ser. J. Phys. Fisiol Celular. 303, C854-C861. doi: 10.1152 / ajpcell.00207.2012
PubMed Abstract | CrossRef Texto Completo | Google Scholar
Joubert, Y., y Tobin, C. (1995). El tratamiento con testosterona hace que las células satélite quiescentes se activen y se recluten para el ciclo celular en el músculo elevador de anís de rata. Dev. Biol. 169, 286–294. doi: 10.1006 / dbio.1995.1144
Resumen de PubMed | Texto completo Cruzado/Google Scholar
Katz, B. (1961). Terminaciones de la fibra nerviosa aferente en el huso muscular de la rana. Philos. Trans. R. Soc. Lond. B Biol. Sci. 243, 221–240.
Resumen de PubMed/Google Scholar
Kletzien, H., Hare, A. J., Leverson, G. y Connor, N. P. (2018). Efecto relacionado con la edad de la muerte celular en la morfología de la fibra y el número en el músculo de la lengua. Nervio Muscular 57, E29-E37. doi: 10.1002 / mus.25671
Resumen de PubMed / Texto completo cruzado / Google Scholar
Kole, A. J., Annis, R. P., y Deshmukh, M. (2013). Neuronas maduras: equipadas para sobrevivir. Muerte Celular Dis. 4: e689. doi: 10.1038 / cddi.2013.220
Resumen de PubMed / Texto completo Cruzado / Google Scholar
Li, T. S., Shi, H., Wang, L., and Yan, C. (2016). Efecto de las células madre mesenquimales de la médula ósea sobre la proliferación de células satélite y la apoptosis en la atrofia muscular inducida por inmovilización en ratas. Mediterráneo. Sci. Monit. 22, 4651–4660. doi: 10.12659 / MSM.898137
Resumen de PubMed | Texto completo de CrossRef/Google Scholar
Lockshin, R. A., and Williams, C. M. (1965). Muerte celular programada-I. Citología de degeneración en los músculos intersegmentales de la seda Pernyi. J. Fisiol de Insectos. 11, 123–133. doi: 10.1016/0022-1910(65)90099-5
Resumen de PubMed / Texto completo cruzado/Google Scholar
Longtine, M. S., Barton, A., Chen, B. y Nelson, D. M. (2012). Las imágenes de células vivas muestran que la apoptosis se inicia localmente y se propaga en forma de onda a través de los sincitiotrofoblastos en cultivos primarios de trofoblastos vellosos placentarios humanos. Placenta 33, 971-976. doi: 10.1016 / j.placenta.2012.09.013
Resumen de PubMed | Texto completo Cruzado | Google Scholar
Mauro, A. (1961). Célula satélite de fibras musculares esqueléticas. J. Biophys. Bioquímica. Citol. 9, 493–495.
Google Scholar
Mayhew, T. M., Leach, L., McGee, R., Ismail, W. W., Myklebust, R., and Lammiman, M. J. (1999). Proliferación, diferenciación y apoptosis en trofoblastos vellosos a las 13-41 semanas de gestación (incluidas observaciones sobre laminillas anuladas y complejos de poros nucleares). Placenta 20, 407-422. doi: 10.1053 / lugar.1999.0399.
PubMed Abstract | CrossRef Texto Completo | Google Scholar
McCall, G. E., Allen, D. L., Linderman, J. K., Grindeland, R. E., Roy, R. R., Mukku, V. R., et al. (1998). Mantenimiento del tamaño del dominio mionuclear en el lenguado de rata después del tratamiento con sobrecarga y hormona de crecimiento/IGF-I. J. Appl. Fisiol. 84, 1407–1412.
Google Scholar
McClung, J. M., Kavazis, A. N., DeRuisseau, K. C., Falk, D. J., Deering, M. A., Lee, Y., et al. (2007). Regulación de la caspasa-3 del dominio mionuclear del diafragma durante la atrofia inducida por ventilación mecánica. Ser. J. Respir. Hematocrito. Care Med. 175, 150–159. doi: 10.1164 / rccm.200601-142OC
Resumen de PubMed | Texto completo Cruzado/Google Scholar
Metter, E. J., Talbot, L. A., Schrager, M., and Conwit, R. (2002). Fuerza muscular esquelética como predictor de mortalidad por cualquier causa en hombres sanos. J. Gerontol. Un Biol. Sci. Mediterráneo. Sci. 57, B359-B365. doi: 10.1093 / gerona / 57.10.B359
Resumen de PubMed / Texto completo cruzado / Google Scholar
Minnaard, R., Drost, M. R., Wagenmakers, A. J., van Kranenburg, G. P., Kuipers, H., y Hesselink, M. K. (2005). Pérdida de músculo esquelético y rendimiento contráctil en ratas sépticas. Nervio muscular 31, 339-348. doi: 10.1002 / mus.20268
Resumen de PubMed | Texto completo de CrossRef/Google Scholar
Moss, F. P. (1968). La relación entre las dimensiones de las fibras y el número de núcleos durante el crecimiento normal del músculo esquelético en las aves domésticas. Ser. J. Anat. 122, 555–563. doi: 10.1002 / aja.1001220308
Resumen de PubMed | Texto completo cruzado/Google Scholar
Murach, K. A., Englund, D. A., Dupont-Versteegden, E. E., McCarthy, J. J., and Peterson, C. A. (2018). La flexibilidad del dominio mionuclear desafía las suposiciones rígidas sobre la contribución de las células satélite a la hipertrofia de la fibra del músculo esquelético. Delantero. Fisiol. 9:635. doi: 10.3389 / fphys.2018.00635
CrossRef Full Text / Google Scholar
Nevalainen, M., Kaakinen, M., and Metsikko, K. (2013). Distribución de transcripciones de ARNm y actividad de traducción en miofibras esqueléticas. Cell Tissue Res. 353, 539-548. doi: 10.1007 / s00441-013-1659-x
Resumen de PubMed / Texto completo cruzado / Google Scholar
O’Leary, M. F., Vainshtein, A., Carter, H. N., Zhang, Y., and Hood, D. A. (2012). Disfunción mitocondrial inducida por denervación y autofagia en músculo esquelético de animales deficientes en apoptosis. Ser. J. Phys. Fisiol Celular. 303, C447-C454. doi: 10.1152/ajpcell.00451.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
Palumbo, C., Rovesta, C., and Ferretti, M. (2012). Striated muscle fiber apoptosis after experimental tendon lesion in a rat model. J. Anat. 221, 358–363. doi: 10.1111/j.1469-7580.2012.01554.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Qaisar, R., and Larsson, L. (2014). What determines myonuclear domain size? Indian J. Physiol. Pharmacol. 58, 1–12.
PubMed Abstract | Google Scholar
Ross, J. A., Levy, Y., Svensson, K., Philp, A., Schenk, S., and Ochala, J. (2018). SIRT1 regula el número nuclear y el tamaño del dominio en las fibras musculares esqueléticas. J. Cell. Fisiol. 233, 7157–7163. doi: 10.1002 / jcp.26542
Resumen de PubMed / Texto completo cruzado / Google Scholar
Schiaffino, S., Dyar, K. A., Ciciliot, S., Blaauw, B. y Sandri, M. (2013). Mecanismos que regulan el crecimiento y la atrofia del músculo esquelético. FEBS J. 280, 4294-4314. doi: 10.1111 / febs.12253
Resumen de PubMed | Texto completo de CrossRef/Google Scholar
Schmalbruch, H., and Hellhammer, U. (1977). El número de núcleos en los músculos de ratas adultas con especial referencia a las células satélite. Anat. Rec. 189, 169–175. doi: 10.1002 / ar.1091890204
Resumen de PubMed | Texto completo Cruzado/Google Scholar
Schwartz, L. M. (2008). Atrofia y muerte celular programada del músculo esquelético. La Muerte Celular Difiere. 15, 1163–1169. doi: 10.1038 / cdd.2008.68
Resumen de PubMed | Texto completo cruzado | Google Scholar
Schwartz, L. M., Brown, C., McLaughlin, K., Smith, W. y Bigelow, C. (2016). El dominio mionuclear no se mantiene en el músculo esquelético durante la atrofia o la muerte celular programada. Ser. J. Phys. Fisiol Celular. 311, C607-C615. doi: 10.1152 / ajpcell.00176.2016
Resumen de PubMed | Texto completo Cruzado/Google Scholar
Schwartz, L. M., and Ruff, R. L. (2002). Cambios en las propiedades contráctiles del músculo esquelético durante la atrofia programada del desarrollo y la muerte. Ser. J. Phys. Fisiol Celular. 282, C1270-C1277. doi: 10.1152 / ajpcell.01275.2000
CrossRef Texto Completo | Google Scholar
Schwartz, L. M., Smith, S. W., Jones, M. E. y Osborne, B. A. (1993). ¿Todas las muertes celulares programadas ocurren por apoptosis? Proc. Natl. Acad. Sci. U. S. A. 90, 980-984.
Google Scholar
Schwartz, L. M., and Truman, J. W. (1983). Control hormonal de las tasas de desarrollo metamórfico en el gusano cornudo del tabaco Manduca sexta. Dev. Biol. 99, 103–114. doi: 10.1016/0012-1606(83)90257-9
Resumen de PubMed | Texto completo cruzado | Google Scholar
Schwartz, L. M., and Truman, J. W. (1982). Regulación de péptidos y esteroides de la degeneración muscular en un insecto. Science 215, 1420-1421. doi: 10.1126/ciencia.6278594
PubMed Abstract | CrossRef Texto Completo | Google Scholar
Smith, H. K., Maxwell, L., Martyn, J. A., and Bass, J. J. (2000). Fragmentación nuclear del ADN y alteraciones morfológicas en el músculo esquelético de conejo adulto tras inmovilización a corto plazo. Cell Tissue Res. 302, 235-241. doi: 10.1007/s004410000280
PubMed Abstract | CrossRef Texto Completo | Google Scholar
Smith, M. I., Huang, Y. Y., y Deshmukh, M. (2009). La diferenciación del músculo esquelético evoca la XIAP endógena para restringir la vía apoptótica. PLoS One 4: e5097. doi: 10.1371/journal.ponga.0005097
Texto completo de CrossRef/Google Scholar
Staron, R. S., Leonardi, M. J., Karapondo, D. L., Malicky, E. S., Falkel, J. E., Hagerman, F. C., et al. (1991). Adaptaciones de la fuerza y del músculo esquelético en mujeres entrenadas con gran resistencia después del desentrenamiento y el reentrenamiento. J. Appl. Fisiol. 70, 631-640.
Google Scholar
Strassburger, E. (1893). La esfera de acción de los núcleos y el tamaño de la célula. Histol Beitr. 5, 97-124.
Google Scholar
Strasser, H., Tiefenthaler, M., Steinlechner, M., Eder, I., Bartsch, G., and Konwalinka, G. (2000). Apoptosis dependiente de la edad y pérdida de células rabdosfínter. J. Urol. 164, 1781–1785. doi: 10.1016 / S0022-5347 (05)67106-6
Resumen de PubMed | Texto completo cruzado | Google Scholar
Tedesco, F. S., Dellavalle, A., Diaz-Manera, J., Messina, G., and Cossu, G. (2010). Reparación del músculo esquelético: potencial regenerativo de las células madre del músculo esquelético. J. Clin. Invertir. 120, 11–19. doi: 10.1172 / JCI40373
Resumen de PubMed / Texto completo cruzado / Google Scholar
Wada, K. I., Takahashi, H., Katsuta, S. y Soya, H. (2002). No hay disminución en el número mionuclear después de la denervación a largo plazo en ratones maduros. Ser. J. Phys. Fisiol Celular. 283, C484-C488. doi: 10.1152 / ajpcell.00025.2002
Texto completo de CrossRef / Google Scholar
Winje, I. M., Sheng, X., Hansson, K. A., Solbrå, A., Tennøe, S., Saatcioglu, F., et al. (2018a). La caquexia no induce la pérdida de petequiales o fibras musculares durante xenotransplantes de cáncer de próstata en ratones. Acta Physiol. e13204. doi: 10.1111 / apha.13204
Texto completo de CrossRef | Google Scholar
Winje, I. M., Bengtsen, M., Eftestol, E., Juvkam, I., Bruusgaard, J.C., and Gundersen, K. (2018b). Etiquetado específico de mionucleos por un anticuerpo contra material pericentriolar 1 en secciones de tejido muscular esquelético. Acta Physiol. 223: e13034. doi: 10.1111 / apha.13034
CrossRef Texto Completo | Google Scholar
Woo, J. (2017). Sarcopenia. Clin. Geriátrico. Mediterráneo. 33, 305–314. doi: 10.1016 / j. cger.2010.02.012
Texto completo de CrossRef | Google Scholar
Xiao, R., Ferry, A. L., and Dupont-Versteegden, E. E. (2011). La resistencia a la muerte celular de los miotubos diferenciados se asocia con mecanismos antiapoptóticos mejorados en comparación con los mioblastos. Apoptosis 16, 221-234. doi: 10.1007 / s10495-010-0566-9
Resumen de PubMed | Texto completo cruzado/Google Scholar
Yang, D., Morris, S. F., y Sigurdson, L. (1998). The sartorius muscle: anatomic considerations for reconstructive surgeons (en inglés). Luchando Radiol. Anat. 20, 307–310. doi: 10.1007
Resumen PubMed / Texto completo cruzado / Google Académico
Zhong, H., Roy, R. R., Siengthai, B., and Edgerton, V. R. (2005). Efectos de la inactividad en el tamaño de la fibra y el número mionuclear en el músculo sóleo de rata. J. Appl. Fisiol. 99, 1494–1499. doi: 10.1152 / japplfisiol.00394.2005
Texto completo cruzado / Google Scholar
Zhou, X., Wang, J. L., Lu, J., Song, Y., Kwak, K. S., Jiao, Q., et al. (2010). La reversión de la caquexia del cáncer y la emaciación muscular por el antagonismo del Act RIIB conduce a una supervivencia prolongada. Celda 142, 531-543. doi: 10.1016 / j.cell.2010.07.011
Resumen de PubMed / Texto completo Cruzado/Google Scholar
Ziaaldini, M. M., Marzetti, E., Picca, A., and Murlasits, Z. (2017). Vías bioquímicas de la sarcopenia y su modulación por el ejercicio físico: una revisión narrativa. Delantero. Mediterráneo. 4:167. doi: 10.3389 / fmed.2017.00167
CrossRef Texto Completo | Google Scholar