Si alguna vez ha estudiado una tabla periódica de los elementos (consulte a continuación), probablemente ya sea consciente de que esta tabla revela mucho sobre las propiedades químicas de los átomos que componen nuestro mundo.
Pero es posible que no se dé cuenta de que cada cuadrado de la tabla periódica en realidad representa una familia de isótopos, átomos que comparten el mismo nombre y propiedades químicas, pero tienen masas diferentes.
Para entender qué son los isótopos y cómo podemos usarlos, necesitamos echar un vistazo más de cerca al interior de un átomo.

Bloques de construcción de materia
Un átomo está compuesto por un núcleo increíblemente denso (llamado núcleo) de protones y neutrones, rodeado por una nube difusa de electrones.
Puede pensar en protones y neutrones como el mismo tipo de partícula con una diferencia clave: los protones están cargados positivamente, mientras que los neutrones no llevan carga. Esto significa que los protones pueden «sentir» campos eléctricos o magnéticos, mientras que los neutrones no.
Los electrones, que son mucho más ligeros que los protones o neutrones, llevan la misma magnitud de carga que un protón pero con el signo opuesto, lo que significa que cada átomo que tiene el mismo número de protones y electrones es eléctricamente neutro.
Son los electrones que determinan el comportamiento químico de un elemento en particular.

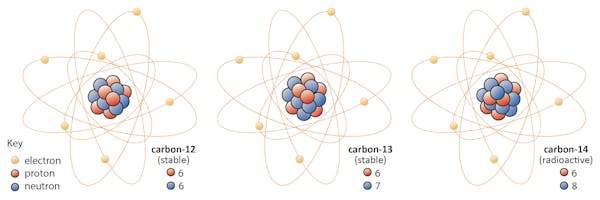
Los isótopos de un elemento comparten el mismo número de protones pero tienen diferentes números de neutrones. Usemos el carbono como ejemplo.
Hay tres isótopos de carbono que se encuentran en la naturaleza: carbono-12, carbono-13 y carbono-14. Los tres tienen seis protones, pero sus números de neutrones – 6, 7 y 8, respectivamente – difieren. Esto significa que los tres isótopos tienen masas atómicas diferentes (el carbono-14 es el más pesado), pero comparten el mismo número atómico (Z=6).
Químicamente, los tres son indistinguibles, porque el número de electrones en cada uno de estos tres isótopos es el mismo.
Así que los diferentes isótopos del mismo elemento son idénticos, químicamente hablando. Pero algunos isótopos tienen la capacidad de eludir esta regla transformándose en otro elemento por completo.
Marching towards stability
Esta capacidad transformadora que tienen algunos isótopos tiene que ver con el hecho de que no todos los isótopos son estables, y es lo que llevó a Frederick Soddy a su descubrimiento de isótopos ganador del Premio Nobel en 1913.
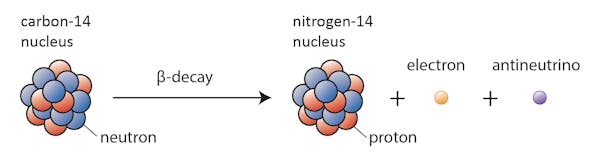
Algunos isótopos, como el carbono-12, seguirán existiendo felizmente como carbono a menos que suceda algo extraordinario. Otros, por ejemplo, el carbono-14, en algún momento se desintegrarán en un isótopo estable cercano.
En este caso, uno de los neutrones en carbono-14 se transforma en un protón, formando nitrógeno-14. Durante este proceso, que se conoce como desintegración beta, el núcleo emite radiación en forma de un electrón y un antineutrino.
Hay muchos factores que pueden causar la desintegración de un núcleo. Una de las más importantes es la relación de protones a neutrones que tiene un núcleo en particular. Si un núcleo tiene demasiados neutrones (la definición de «demasiados» depende de lo pesado que sea el núcleo), existe la posibilidad de que decaiga hacia la estabilidad.
lo mismo es cierto si un núcleo tiene demasiados protones. Esta es una de las razones por las que algunos isótopos de un elemento dado son radiactivos, mientras que otros no lo son.
De las entrañas de las estrellas
A estas alturas, es posible que se pregunte cómo se crearon todos estos isótopos en primer lugar. Resulta que esta pregunta es compleja, pero le da algo de verdad al adagio de que todos estamos hechos de polvo de estrellas.
Algunos de los isótopos más ligeros se formaron muy temprano en la historia del universo, durante el Big Bang. Otros son el resultado de procesos que ocurren dentro de las estrellas o como resultado de colisiones casuales entre núcleos altamente energéticos, conocidos como rayos cósmicos, dentro de nuestra atmósfera.
Los isótopos más naturales son el producto final (estable o de larga duración) resultante de una larga serie de reacciones y desintegraciones nucleares.
En la mayoría de estos casos, los núcleos de luz han tenido que romperse con suficiente energía para permitir que la fuerza fuerte – un enlace similar a un pegamento que se forma cuando los protones y neutrones se acercan lo suficiente para tocarse-supere la fuerza electromagnética – que separa a los protones. Si la fuerza fuerte gana, los núcleos en colisión se unen, o se fusionan, para formar un núcleo más pesado.
Nuestro sol es un buen ejemplo de esto. Una de sus principales fuentes de energía es una serie de reacciones de fusión y procesos de desintegración beta que transforman el hidrógeno en helio.

Transformar el conocimiento en herramientas
Desde principios de 1900, cuando se descubrió por primera vez la existencia de isótopos, los físicos y químicos nucleares han estado buscando formas de estudiar cómo se pueden formar los isótopos, cómo se descomponen y cómo podríamos usarlos.
Resulta que la naturaleza de los isótopos – su uniformidad química, su carácter distintivo nuclear-los hace útiles para una amplia gama de aplicaciones en campos tan diversos como la medicina, la arqueología, la agricultura, la generación de energía y la minería.
Si alguna vez se ha realizado una TEP, se ha beneficiado de un subproducto de la desintegración radiactiva de ciertos isótopos (a menudo llamados isótopos médicos). Producimos estos isótopos médicos utilizando nuestro conocimiento de cómo proceden las reacciones nucleares, con la ayuda de reactores nucleares o aceleradores llamados ciclotrones.
Pero también hemos encontrado formas de hacer uso de isótopos radiactivos naturales. La datación por carbono, por ejemplo, utiliza el isótopo de larga vida carbono-14 para determinar la antigüedad de los objetos.
En circunstancias normales, el carbono-14 se produce en nuestra atmósfera a través de reacciones de rayos cósmicos con nitrógeno-14. Tiene una vida media de aproximadamente 5.700 años, lo que significa que la mitad de una cantidad de carbono-14 se habrá deteriorado en ese período de tiempo.

Mientras un organismo biológico está vivo, toma aproximadamente un isótopo de carbono-14 por cada trillón de isótopos estables de carbono-12 y la relación carbono-12 a carbono-14 permanece aproximadamente igual mientras el organismo vive. Una vez que muere, la nueva ingesta de carbono se detiene.
Esto significa la relación de cambios de carbono-14 a carbono-12 en los restos de este organismo a lo largo del tiempo.
Si extraemos carbono utilizando métodos químicos de una muestra, podemos aplicar un método llamado espectrometría de masas aceleradora (AMS) para separar los isótopos de carbono individuales por peso.
AMS hace uso del hecho de que las partículas aceleradas con la misma carga pero diferentes masas siguen caminos separados a través de campos magnéticos. Al hacer uso de estas rutas separadas, podemos determinar las proporciones de isótopos con una precisión increíble.
Como puede ver en estos ejemplos, aplicamos nuestro conocimiento de isótopos de varias maneras. Producimos ellos, detectar, extraer y estudiar con el doble propósito de entender por qué el núcleo del átomo se comporta como lo hace, y cómo podemos aprovechar su energía para nuestro beneficio.