Determinar ciertos parámetros como el tamaño, la longitud y el ángulo en escala atómica no es fácil. Debido a la importancia de estos parámetros, los científicos han desarrollado métodos para deducir o calcular los parámetros a nivel atómico. El orden y la longitud de los enlaces son dos parámetros importantes que indican el tipo y la fuerza de los enlaces entre un par de átomos.
Este artículo explica,
1. Qué son el Orden y la Longitud del Enlace
2. Cómo Calcular el Orden y la Longitud del Enlace
– Cómo Calcular el Orden del Enlace
– Cómo Calcular la Longitud del Enlace
Qué son el Orden y la Longitud del enlace
La longitud del enlace y el orden del enlace son dos parámetros asociados a los enlaces covalentes. Bono de pedido es el número de enlaces químicos entre dos átomos de bonos y la longitud es la distancia entre dos núcleos de átomos enlazados covalentemente juntos. Este artículo explica cómo calcular el orden y la longitud de los enlaces en un nivel atómico.
Cómo calcular el orden de enlace
El orden de enlace es el número de enlaces químicos entre dos átomos. Indica la estabilidad de un enlace. En los enlaces covalentes, el orden de los enlaces es el número de electrones compartidos. Por ejemplo, el orden de enlace de un par de átomos unidos por un enlace simple es uno, mientras que el orden de enlace de un par de átomos unidos por un enlace doble es dos. El orden de enlace cero indica que no hay enlace entre átomos. La estabilidad de una molécula aumenta al aumentar el orden de enlace. Las moléculas con unión por resonancia no necesitan ser un entero. En compuestos covalentes con dos átomos, el orden de enlace entre un par de átomos se determina primero dibujando la estructura de Lewis, y luego determinando el tipo de enlaces entre los átomos: enlace cero, enlace simple, doble o triple. Por ejemplo, el orden de enlace del gas hidrógeno se determina de la siguiente manera.
- Dibujar la estructura de Lewis
H: H
- Determinar el número de bonos/par de electrones de valencia
Un par de electrones, por lo tanto el bono de fin de es 1.
Si hay más de dos átomos, el orden de enlace se determina de la siguiente manera. Véase el ejemplo: ion nitrato.
- Dibujar la estructura de Lewis
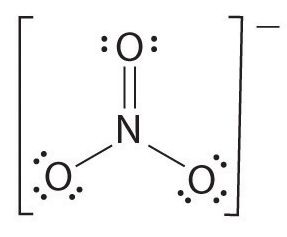
- Contar el número total de enlaces (de acuerdo con el ion nitrato, sus 4)
- El número de grupos de enlace entre átomos individuales (de acuerdo con el amoníaco, sus 3)
- Por lo tanto, el orden de enlace = Número total de enlaces/ número de grupos de enlace
= 4/3
= 1.33
Por lo tanto, el orden de enlace del ion nitrato es 1.33
Cómo calcular la longitud de enlace
La longitud de enlace es la distancia entre dos núcleos de átomos que están unidos covalentemente entre sí. La longitud de enlace suele estar en el rango de 0,1 a 0,2 nm. Cuando dos átomos similares están unidos entre sí, la mitad de la longitud de enlace se conoce como radio covalente. La longitud del enlace depende del número de electrones enlazados de dos átomos o del orden del enlace. Más alto el orden de unión, más corta la longitud de unión se debe a las fuertes fuerzas de tracción de los núcleos cargados positivamente. La unidad de longitud de enlace es picómetro. En enlaces simples, dobles y triples, la longitud del enlace aumenta en el orden de
enlace triple<enlace doble<enlace simple
La electronegatividad se puede usar para calcular la longitud del enlace entre dos átomos que tienen electronegatividades diferentes. La siguiente fórmula empírica fue propuesta por Shoemaker y Stevenson para calcular la longitud del enlace.
dA – B = rA + rB-0.09(xA – xB)
dA-B es la distancia de enlace entre dos átomos A y B, rA y rB son radios covalentes de A y B, y
(xA – xB) es la diferencia de electronegatividad entre A y B.
Se utiliza otro método para calcular la longitud aproximada del enlace. En este método, se dibuja la primera estructura de Lewis para determinar el tipo de enlace covalente. A continuación, utilizando un gráfico* elaborado a partir de los estudios realizados por Cordero et al., y Pyykkö y Atsumi, se determinan los radios correspondientes de los enlaces hechos por cada átomo. Luego, la longitud del enlace se determina tomando la suma de los dos radios. Por ejemplo, al determinar la longitud de enlace del dióxido de carbono, se dibuja la primera estructura de Lewis.
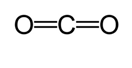
Según el gráfico, el radio covalente del doble enlace de carbono es de 67 picómetros y el del doble enlace de oxígeno es de 57 picómetros. Por lo tanto, la longitud de enlace del dióxido de carbono es de aproximadamente 124 picómetros (57 pm+ 67 pm).
*Covalente gráfico se encuentra aquí
Referencia:
Cordero, Beatriz, et al. «Radios covalentes revisited.»Dalton Transactions 21 (2008): 2832-2838.
Libretexts. «Orden y Duración de las fianzas.»Chemistry LibreTexts. Libretexts, 05 de diciembre. 2016. Web. 10 de enero 2017.Lister, Ted y Janet Renshaw. Comprensión de la Química para el Nivel Avanzado. N. p.: Nelson Thornes, 2000. Imprimir.
Pratiyogita Darpan. «Propiedades de los Elementos en Relación con su Estructura Electrónica .»Competition Science Vision Ago. 1998: n. pag. Imprimir.
Pyykkö, Pekka y Michiko Atsumi. «Radios Covalentes de Doble Enlace Molecular para Elementos Li–E112.»Chemistry-A European Journal 15.46( 2009): 12770-12779.
![]()