Arenos más grandes
La mayoría de los arenos que contienen un solo anillo de seis miembros son líquidos volátiles, como el benceno y los xilenos, aunque algunos arenos con sustituyentes en el anillo son sólidos a temperatura ambiente. En la fase gaseosa, el momento dipolar del benceno es cero, pero la presencia de sustituyentes electronegativos o electropositivos puede dar lugar a un momento dipolar neto que aumenta las fuerzas de atracción intermoleculares y eleva los puntos de fusión y ebullición. Por ejemplo, el 1,4-diclorobenceno, un compuesto utilizado como alternativa al naftaleno en la producción de bolas de naftalina, tiene un punto de fusión de 52,7°C, que es considerablemente mayor que el punto de fusión del benceno (5,5°C).
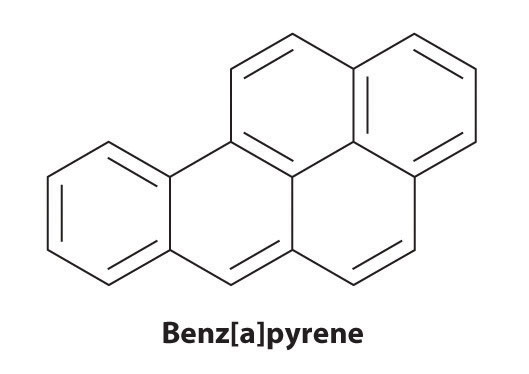
Ciertos hidrocarburos aromáticos, como el benceno y el bencireno, son potentes toxinas hepáticas y carcinógenos. En 1775, un médico británico, Percival Pott, describió la alta incidencia de cáncer de escroto entre los niños pequeños utilizados como deshollinadores y lo atribuyó a su exposición al hollín. Sus conclusiones fueron correctas: el benzpireno, un componente del hollín de la chimenea, las carnes a la parrilla al carbón y el humo del cigarrillo, fue el primer carcinógeno químico que se identificó.
Aunque los arenos generalmente se dibujan con tres enlaces C = C, el benceno es aproximadamente 150 kJ / mol más estable de lo que se esperaría si contuviera tres enlaces dobles. Esta mayor estabilidad se debe a la deslocalización de la densidad de electrones π sobre todos los átomos del anillo. En comparación con los alquenos, los arenos son nucleófilos pobres. En consecuencia, no experimentan reacciones de adición como los alquenos; en su lugar, experimentan una variedad de reacciones de sustitución aromáticas electrofílicas que implican la sustitución de –H en el areno por un grupo –E, como –NO2, –SO3H, un halógeno o un grupo alquilo, en un proceso de dos pasos. El primer paso consiste en la adición del electrofilo (E) al sistema π de benceno, formando un carbocatión. En el segundo paso, se pierde un protón del carbono adyacente en el anillo:
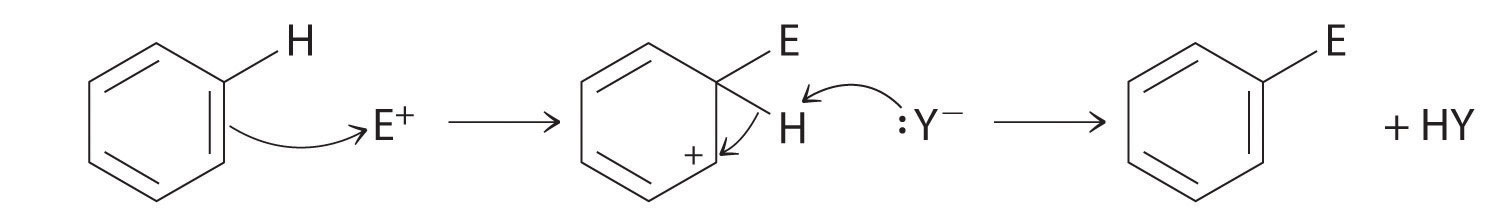
La carbocación formada en el primer paso se estabiliza por resonancia.
Los arenos experimentan reacciones de sustitución en lugar de eliminación debido a una mayor estabilidad derivada de la deslocalización de su densidad de electrones π.
Muchos arenos sustituidos tienen una potente actividad biológica. Algunos ejemplos incluyen medicamentos y antibióticos comunes como la aspirina y el ibuprofeno, drogas ilícitas como las anfetaminas y el peyote, el aminoácido fenilalanina y hormonas como la adrenalina, como se muestra a continuación.
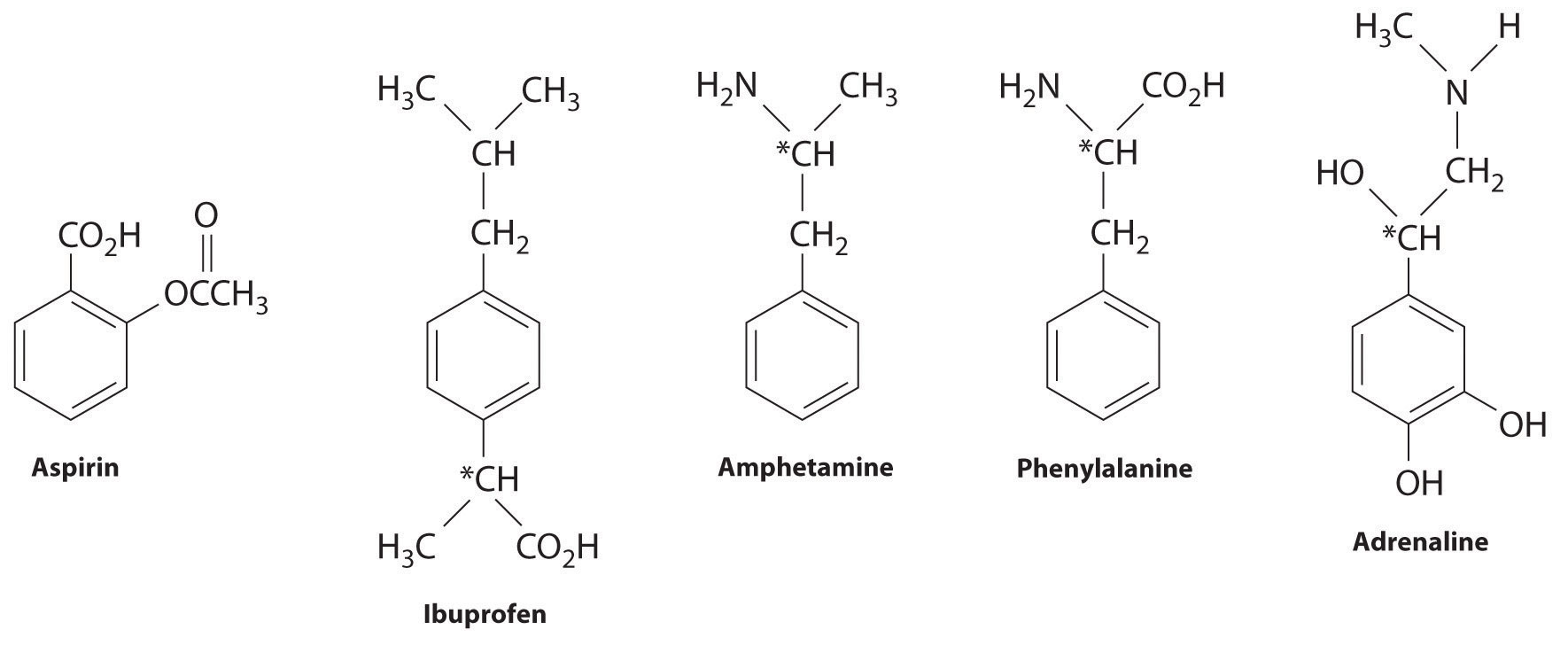
La aspirina (actividad antifever), el ibuprofeno (actividad antifever y antiinflamatoria) y la anfetamina (estimulante) tienen efectos farmacológicos. La fenilalanina es un aminoácido. La adrenalina es una hormona que provoca la respuesta de «lucha o huida» al estrés.