
det molære volumen (symbol Vm) for et stof er det volumen, der optages af en mol af stoffet på et givet temperatur og tryk. Det er lig med molekylmassen (m) af stoffet divideret med dets densitet (kur) ved den givne temperatur og tryk:
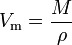
den har en SI-enhed på kubikmeter pr.mol (m3/mol). Molvolumener udtrykkes dog ofte som kubikmeter pr.1.000 mol (m3/kmol) eller kubiske decimeter pr. mol (dm3/mol) for gasser og som centimeter pr. mol (cm3/mol) for væsker og faste stoffer.
Hvis et stof er en blanding indeholdende N-komponenter, beregnes det molære volumen ved hjælp af:
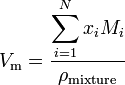
hvor I er molfraktionen af Ith-komponenten, M I er molekylmassen af Ith-komponenten, og pmblanding er blandingstætheden ved den givne temperatur og tryk.
Når du angiver numeriske værdier for molvolumen, er det vigtigt også at angive de givne betingelser for temperatur og tryk. Ellers er de numeriske værdier meningsløse.
ideelle gasser
den ideelle gaslovligning kan omarrangeres for at give dette udtryk for det molære volumen af en ideel gas:
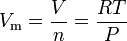
hvor i SI-enheder:
= gasen absolut tryk, i pa
= antal mol, i mol
= gasmolarvolumenet, i m3/mol
= gasens absolutte temperatur, i k
= den universelle gaslovskonstant på 8.314472 m3·pa·mol-1·K-1
hvor i amerikanske sædvanlige enheder:
= gasens absolutte tryk, i PSIA
= antal mol, i LB-mol
= gasmolarvolumenet, i ft3/lb-mol
= gasens absolutte temperatur, i grader Rankine (liter R)
= den universelle gaslovskonstant på 10.7316 ft3·psia·lb-mol-l·liter R-1
eksempelberegninger af ideelle gasmolære volumener:
- i Si-metriske enheder:
VM = 8.314472 liter 273.15 / 101.325 = 0,022414 m3/mol ved 0 liter C og 101.325 pa absolut tryk = 22,414 m3/kmol ved 0 liter C (273,15 k) og 101.325 kPa absolut tryk Vm = 8.314472 × 273.15 / 100,000 = 0.022711 m3/kmol ved 0 °C og 100.000 Pa absolut tryk = 22.711 m3/kmol ved 0 °C (273.15 K) og 100 kPa absolut tryk
- I almindeligt USA-enheder:
Vm = 10.7316 × 519.67 / 14.696 = 379.48 ft3/lb-mol ved 60 °F (519.67 °R) og 14.696 psia
Bemærkninger:
- lb-mol er en forkortelse for pund-mol
- °R er grader Rankine (en absolut temperatur skala) og °F til grader Fahrenheit (en temperatur skala).
- L. r = L. F. + 459.67
- den tekniske litteratur kan være forvirrende, fordi nogle forfattere ofte undlader at forklare, om de bruger den universelle gaslovskonstant R, som gælder for enhver ideel gas, eller om de bruger den specifikke gaslovskonstant Rs, som kun gælder for en bestemt individuel gas. Forholdet mellem de to konstanter er Rs = R / M, hvor M er gasens molekylmasse.
virkelige gasser
virkelige gasser er de gasser, der ikke udviser ideel gasadfærd. For sådanne gasser er den enkleste metode til bestemmelse af molære volumener ved at anvende kompressibilitetsfaktorer som i følgende udtryk:
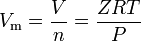
hvor Å er gaskompressibilitetsfaktoren, som er en nyttig termodynamisk egenskab til ændring af den ideelle gaslov for at redegøre for opførsel af virkelige gasser. Ovenstående ligning er dybest set en simpel tilstandsligning (EOS). Den største begrænsning af denne tilstandsligning er, at gaskompressibilitetsfaktoren, Å, er ikke en konstant, men varierer fra en gas til en anden såvel som med temperaturen og trykket af den pågældende gas.
mere nøjagtige værdier af reelle gasmolære volumener kan opnås ved hjælp af tilstandsligninger som f.eks Van Der Vaals ligning udviklet i 1873, Redlich-Kvong ligning udviklet i 1949, Soave-Redlich-Kvong ligning udviklet i 1972 og Peng-Robinson ligning udviklet i 1976.
- 1.0 1.1 International Union of Pure and Applied chemistry (IUPAC): mængder, enheder og symboler i fysisk kemi 2.udgave, 1993
- 2.0 2.1 NIST Guide til Si punkt 8.6.3 i Afsnit 8
- 3.0 3.1 bestemmelse af gaskompressibilitetsværdier Information om, hvordan man bestemmer gaskompressibilitetsfaktorer og molære volumener.
| |
noget indhold på denne side kan tidligere have været vist på borgerskab. |