da de fleste af de nye hydroksidioner fjernes, øges pH ikke meget.
fjernelse af hydroksidionerne ved at reagere med hydrogenioner
Husk, at der er nogle hydrogenioner til stede fra ioniseringen af ethansyren.
![]()
Hydroksidioner kan kombineres med disse for at gøre vand. Så snart dette sker, ligevægten tips til at erstatte dem. Dette fortsætter med at ske, indtil de fleste af hydroksidionerne fjernes.
![]()
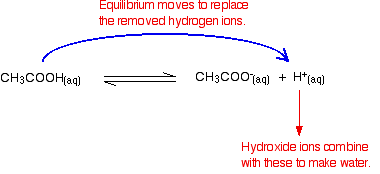
igen, fordi du har ligevægte involveret, fjernes ikke alle hydroksidionerne – bare de fleste af dem. Det dannede vand reioniserer i meget ringe grad for at give nogle få hydrogenioner og hydroksidioner.
alkaliske bufferopløsninger
Vi tager en blanding af ammoniak og ammoniumchloridopløsninger som typisk.
ammoniak er en svag base, og positionen af denne ligevægt vil være godt til venstre:
![]()
![]()
tilsætning af ammoniumchlorid til dette tilføjer masser af ekstra ammoniumioner. Ifølge Le Chateliers princip vil det tippe ligevægtens position endnu længere til venstre.
opløsningen vil derfor indeholde disse vigtige ting:
-
masser af uomsat ammoniak;
-
masser af ammoniumioner fra ammoniumchloridet;
-
nok hydroksidioner til at gøre opløsningen alkalisk.
andre ting (som vand og chloridioner), der er til stede, er ikke vigtige for argumentet.
tilsætning af en syre til denne bufferopløsning
der er to processer, der kan fjerne de hydrogenioner, du tilføjer.
fjernelse ved at reagere med ammoniak
det mest sandsynlige basiske stof, som en hydrogenion vil kollidere med, er et ammoniakmolekyle. De vil reagere for at danne ammoniumioner.
![]()
![]()
de fleste, men ikke alle, af hydrogenionerne fjernes. Ammoniumionen er svagt sur, og derfor frigives nogle af hydrogenionerne igen.
fjernelse af hydrogenioner ved at reagere med hydroksidioner
Husk, at der er nogle hydroksidioner til stede fra reaktionen mellem ammoniak og vandet.
![]()
![]()
hydrogenioner kan kombineres med disse hydroksidioner for at gøre vand. Så snart dette sker, er ligevægten tips til at erstatte hydroksidionerne. Dette fortsætter med at ske, indtil de fleste hydrogenioner fjernes.
![]()
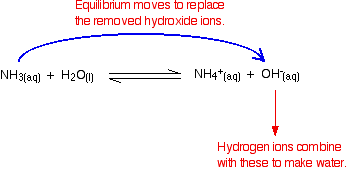
igen, fordi du har ligevægte involveret, fjernes ikke alle hydrogenioner – bare de fleste af dem.
tilsætning af en alkali til denne bufferopløsning
hydroksidionerne fra alkalien fjernes ved en simpel reaktion med ammoniumioner.
![]()
![]()
fordi den dannede ammoniak er en svag base, kan den reagere med vandet – og så er reaktionen lidt reversibel. Det betyder, at de fleste (men ikke alle) af hydroksidionerne fjernes fra opløsningen.
beregninger, der involverer bufferløsninger
Dette er kun en kort introduktion. Der er flere eksempler, herunder flere variationer, over 10 sider i min Kemi beregninger bog.
sure bufferopløsninger
Dette er lettere at se med et specifikt eksempel. Husk, at en syrebuffer kan fremstilles af en svag syre og et af dens salte.
lad os antage, at du havde en bufferopløsning indeholdende 0,10 mol dm-3 af ethansyre og 0.20 mol dm-3 natriumethanoat. Hvordan beregner du dens pH?
i enhver opløsning, der indeholder en svag syre, er der en ligevægt mellem den ikke-ioniserede syre og dens ioner. Så for ethansyre har du ligevægten:
![]()
tilstedeværelsen af ethanoationerne fra natriumethanoatet vil have flyttet ligevægten til venstre, men ligevægten eksisterer stadig.
det betyder, at du kan skrive ligevægtskonstanten, Ka, for det:
![]()
![]()
hvor du tidligere har foretaget beregninger ved hjælp af denne ligning med en svag syre, vil du have antaget, at koncentrationerne af hydrogenioner og ethanoater var de samme. Hvert molekyle af ethansyre, der splitter op, giver en af hver slags ion.
det gælder ikke længere for en bufferløsning:
![]()
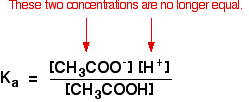
Hvis ligevægten er skubbet endnu længere til venstre, vil antallet af ethanoationer, der kommer fra ethansyren, være fuldstændig ubetydelig sammenlignet med dem fra natriumethanoatet.
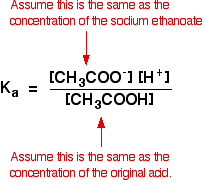
Vi antager derfor, at ethanoationskoncentrationen er den samme som koncentrationen af natriumethanoatet – i dette tilfælde 0,20 mol dm-3.
i en svag syreberegning antager vi normalt, at så lidt af syren har ioniseret, at koncentrationen af syren ved ligevægt er den samme som koncentrationen af den syre, vi brugte. Det er endnu mere sandt nu, hvor ligevægten er flyttet endnu længere til venstre.
så de antagelser, vi laver for en bufferopløsning, er:
![]()
nu, hvis vi kender værdien for Ka, kan vi beregne hydrogenionkoncentrationen og derfor pH.
Ka for ethansyre er 1,74 gange 10-5 mol dm-3.
Husk, at vi ønsker at beregne pH af en bufferopløsning indeholdende 0,10 mol dm-3 ethansyre og 0,20 mol dm-3 natriumethanoat.
![]()
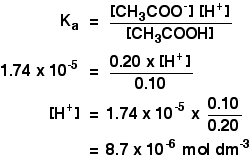
så er alt hvad du skal gøre at finde pH ved hjælp af udtrykket
pH = -log10
du vil stadig have værdien for hydrogenionkoncentrationen på din lommeregner, så tryk på log-knappen og ignorer det negative tegn (for at tillade minustegnet i pH-udtrykket).
Du skal få et svar på 5,1 til to signifikante tal. Du kan ikke være mere præcis end dette, fordi dine koncentrationer kun blev givet til to tal.