- Úvod
- Materiály a Metody
- Kmeny
- Extrakce DNA
- stx1 a stx2 PCR Amplifikace
- Sekvenování DNA
- Mikrodestičky Vero Buňky Přípravky
- Mobil-Zdarma Bakteriální Přípravky
- Cytotoxického Testu a Stanovení LD50
- Blokáda a Toxin Neutralizační Test
- Omvs odběr a extrakce DNA z OMVs
- Výsledky
- stx1 a stx2 PCR Amplifikace
- Sekvenování DNA
- Cytotoxického Testu a Stanovení LD50
- neutralizace toxinu
- stx1 Genu PCR Amplifikace z OMVs
- Diskuse
- Autor Příspěvky
- finanční Prostředky
- Prohlášení o střetu zájmů
- Poděkování
- Zkratky
Úvod
po několik let význam Aeromonas spp. jako člověk průjem-působit agent byl kontroverzní; několik studií prokázalo, že patogenní mechanismus Aeromonas je multifaktoriální, protože mnoho faktorů virulence jsou zapojeny, včetně výroby cytotoxiny (Castro-Escarpulli et al., 2002, 2003). Tyto toxiny mohou způsobit průjem nebo hemoragickou kolitidu a mohou hrát hlavní roli v hemolyticko-uremickém syndromu (HUS) a vývoji TTP (Bogdanović et al., 1991; Fang et al., 1999; Monforte-Cirac et al., 2010).
cytotoxiny zapojené do těchto onemocnění zahrnují Shiga toxin a úzce související Stx. Varianty Stx jsou exprimovány v bakteriálních druzích Shigella, Enterobacter, Citrobacter, Acinetobacter, Campylobacter a Hamiltonella (Mauro a Koudelka, 2011). Alperi a Figueras (2010) popsali přítomnost Stx1 a Stx2 v klinických izolátech Aeromonas spp., spojené s gastroenteritidou, hemoragickou kolitidou a HUS. Geny kódující tyto toxiny jsou umístěny v různých lambdoidních bakteriofágech, které lysogenizují tento kmen. Kromě toho má rod Aeromonas systém s nulovou sekrecí nazvaný OMVs. OMVs by mohlo být prostředkem, který některé bílkoviny, RNA, periplasmic prostoru komponenty a další komponenty spojené s virulencí, mohou být přenášeny horizontálně do jiných rodů, a proto, to je věřil, že OMVs hrát důležitou roli v patogenitě (Guerrero-Mandujano et al., 2015a, b).
z tohoto důvodu bylo cílem této studie vyhodnotit poškození způsobené produkcí Stx kmeny izolovanými od dětí z Mexico City v buněčných kulturách Vero.
Materiály a Metody
Kmeny
Tato studie zahrnovala 66 klinických izolátů z INP, 54 získané z střevní a 12 z extra-střevní infekce. Kmeny byly izolovány ze vzorků získaných pro rutinní testování v uvedené nemocnici; proto nebyl vyžadován informovaný souhlas rodičů nebo zákonných zástupců dětí. Všechny kmeny byly geneticky identifikovány pomocí 16S rDNA-RFLP (Hernández-Cortez et al., 2011). Zadaný kmen Escherichia coli O157:H7 CECT 4076 byl použit jako pozitivní kontrola a E. coli kmen K12 (5512 ENCB) z kolekce Lékařské Bakteriologie Laboratoř (Escuela Nacional de Ciencias Biologicas, IPN) byl použit jako negativní kontrola pro tvorbu toxinů. Kmeny byly udržovány na krátkou dobu při pokojové teplotě na krevní agar na základě svažuje; pro delší skladování, byly buď zmraženy na -70°C, v 20% (w/v) glycerol-Todd Hewitt broth (Oxoid, Mexiko) nebo lyofilizované v 7.5% koňské glukózové sérum.
Extrakce DNA
Všechny kultury byly pěstovány na tryptic soy agar při teplotě 30°C po dobu 18 h. Genomické DNA z každého kmene byl získán pomocí InstaGene Matrix (BioRad®, Mexiko) podle pokynů uvedených výrobcem. Čistota a množství DNA byly stanoveny pomocí spektrofotometru Ampli Quant AQ-07. DNA byla až do použití uchovávána při teplotě -20°C.
stx1 a stx2 PCR Amplifikace
přítomnost stx1 a stx2 od DNA OMVs a genomické DNA byla detekována pomocí jediného PCR reakcí za použití primerů STX1F/STX1R a STXF/STXR s 144 a 217 bp produktu, respektive, tyto primery byly navrženy na základě sekvence podjednotky A. primery, reakční a amplifikační podmínky byly zpracovány, jak již bylo dříve popsáno podle Hernández-Cortez et al. (2013), s pozitivními kontrolami (E.coli O157:H7) a negativními kontrolami (E. coli K12).
Sekvenování DNA
Polymerázová řetězová reakce produkty byly čištěny pomocí PureLink Quick Gel Extraction Kit (Invitrogen®, Mexiko) podle instrukcí výrobce. Výrobky byly přímo sekvenovány na ABI PRISM 310 Genetic Analyzer (Applied Biosystems, Foster City, CA, USA) pomocí forward a reverse primery použité pro PCR, podle pokynů výrobce. Sekvenování bylo provedeno v Instituto de Biología, UNAM (Mexiko). Sekvenční analýza byla provedena pomocí nástroje Basic Local Alignment Search Tool (BLAST) poskytnutého Národním centrem pro biotechnologické informace (NCBI).
Mikrodestičky Vero Buňky Přípravky
Tento postup se provádí v 96-well mikrodestičky s Vero (ATCC CCL81) buňky jednovrstevné s 80% soutoku, přidání minimální esenciální médium (MEM; Invitro®, Mexiko) s přídavkem 10% v/v fetální bovinní sérum (FBS; Invitro®, Mexiko).
buněčná suspenze byla homogenizována a upravena na 105-106 buněk / mL pomocí Neubauerovy Komory. Po úpravě byla suspenze uložena v 200 µL jamce. Mikrodestičky byly inkubovány při 37°C pod 5% CO2 po dobu 24 hodin (CO2 inkubátor, VWR Scientific, USA) (Giono-Cerezo et al., 1994).
Mobil-Zdarma Bakteriální Přípravky
Pět kolonií z každé krevním agarem byly naočkovány do 3 mL Craig střední (0.4% extrakt z kvasnic, 3% casamino acids, 0.05% K2HPO4). Ty byly inkubovány po dobu 24 hodin při 37°C a optická hustota použité bakteriální kultury byla 0,25 při 600 nm. Cell-free přípravky byly vyrobeny odstředěním kultur na 14 000 g po dobu 10 min při 4°C, následuje filtrace supernatantu přes membránový filtr (velikost pórů 0.45 pm, Sartorius Minisart NML). Mobil-zdarma supernatanty byly uloženy při teplotě -20°C. celkem 66 mobil-zdarma bakteriální přípravky byly získány tímto způsobem; pozitivní kontroly (E. coli O157:H7) a negativní kontrola (E. coli K12) byly získány také stejným způsobem (Giono-Cerezo et al., 1994).
Cytotoxického Testu a Stanovení LD50
mobil-zdarma filtrátu (20 µL) byl naočkován do jamek obsahujících buňky a příslušné růstové médium bez antibiotik. Naočkované buňky byly inkubovány po dobu 96 hodin při 37°C s 5% CO2 a pozorovány každých 24 hodin na obráceném mikroskopu. Očekávalo se, že cytotoxický účinek se objeví jako zaokrouhlení a smrštění buněk se silnou granulací a nakonec progresivní a nevratná destrukce monovrstvy. Všechny testy byly provedeny ve dvou vyhotoveních; byly také provedeny kontroly životaschopnosti s mem a Craig medium (Giono-Cerezo et al., 1994).
LD50 byl stanoven u kmenů Aeromonas zjištěných jako pozitivní pro vyvolání cytotoxického poškození ve Vero buňkách. Standardní 96-well mikrodestičky s Vero buněk byl připraven, jak je uvedeno v 2.6, ale na střední byl změněn na 100 µL MEM s 1% BFS. Tento přípravek byl vystaven 100 µL bezbuněčného bakteriálního přípravku a sériová ředění byla provedena na celé řadě destiček. Po 24 hodinách inkubace při 37°C s 5% CO2 byl LD50 stanoven pod obráceným mikroskopem. LD50 byl přidělen do studny, ve které bylo poškozeno 50% buněk Vero a 50% nepoškozeno (Marques et al., 1986).
Blokáda a Toxin Neutralizační Test
toxin neutralizační test byl proveden v kmeny, které indukované cytotoxické poškození v Vero buňky, protože toto poškození je orientační Stx. Pro tento test byla připravena mikrodestička s Vero buňkou pěstovanou na soutok 90-100% s LD50 každého bezbuněčného bakteriálního přípravku. Provést neutralizační test ukázat poškození buněk produkovaných v důsledku Stx akce, dvě monoklonální protilátky (Universidad Nacional Autónoma de México), získané z E. coli O157:H7 byly použity.
Pro každé Ab Bradford protein kvantifikace byla provedena podle instrukcí výrobce (Biorad), s výsledkem 78,2 a 74.8 µg/µL, respektive, anti-Stx1 a anti-Stx2 a. koncentrované Ab byl zpracován a dvojí ředění Ab. Pak, 10 µL Ab (anti-STX1 nebo anti-STX2) byl inkubován s 190 µL buněčné-volné supernatantu na koncentrace LD50 po dobu 1 h při 37°C. Po tomto, 200 µL ta byla naočkována do Vero buněk na 90% konfluence a inkubovány po dobu 24 h při 37°C s 5% CO2 (Marques et al., 1986).
Omvs odběr a extrakce DNA z OMVs
vnější membránové vezikuly byly získány z Aeromonas hydrophila F-0050. Protokol byl proveden, jak již bylo popsáno Guerrero-Mandujano et al. (2015a).
DNA OMVs byla získána pomocí matice InstaGene (BioRad®, Mexiko) podle pokynů poskytnutých výrobcem. Poté byla DNA OMVs čištěna technikou fenol-chloroform extrakce DNA (Guerrero-Mandujano et al., 2015b).
Výsledky
stx1 a stx2 PCR Amplifikace
Polymerázová řetězová reakce promítání 66 klinických kmenů Aeromonas ukázal, že 22/66 (33.3%) kmeny obsažené v genu stx1, 42/66 (63.6%) kmeny obsažené oba geny, ne kmeny obsažené pouze stx2, a 2/66 (3%) kmenů byly negativní pro oba geny.
Sekvenování DNA
BLASTn analýzy vyplynulo, 79 až 99% podobnost a očekávané hodnoty 3e-16/2e-97 mezi stx-1/stx-2 geny E. coli O157:H7 a amplikon z Aeromonas spp., kmen.
Cytotoxického Testu a Stanovení LD50
cytotoxicity, test provádí ve Vero buněčných kulturách ukázaly, že 17/66 (25.7%) mobil-zdarma bakteriální přípravky způsobené cytotoxické poškození, což naznačuje, výroba aktivní Stx (Obrázek 1), odhalila charakteristické škody způsobené Stx.
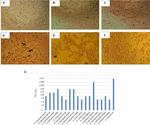
obrázek 1. Stanovení Cytotoxicity a stanovení LD50 ve Vero buněčných kulturách. A) kultura Vero buněk s minimálním základním médiem (test životaschopnosti). B) kultura buněk Vero s Craigovým médiem(test životaschopnosti). C) negativní kontrola E. coli K12. (D) pozitivní kontrola s E. coli O157: H7, cytotoxické poškození je ukázáno (šipky) destrukcí buněčné monovrstvy a efektem „staré krajky“. E) cytotoxické poškození kmene a.hydrophila F-0050. F) cytotoxické poškození kmene a.caviae 421423. G) grafické znázornění titru LD50 všech kmenů.
výsledky pro stanovení LD50 titru byly následující: 6/17 (35.2%) mobil-zdarma bakteriální přípravky předložila titr 1:16; 5/17 (29.4%) mobil-zdarma bakteriální přípravky líčil titr 1:8; 3/17 (17.6%) mobil-zdarma bakteriální přípravky má titr 1:64; 2/17 (11.7%) mobil-zdarma bakteriální přípravky s titrem 1:32; a 1/17 (5.8%) mobil-zdarma bakteriální přípravky s titru 1:256 (Obrázek 1G).
neutralizace toxinu
aplikace anti-STX1 Ab v 11/17 (64 .7%) kmenů poškození buněk v supernatantu byla zcela inhibována při 39.1 µg/µL Ab koncentrace; v 4/17 (23.5%) mobil-zdarma bakteriální přípravky, snižuje poškození buněk byl pozorován ve stejné koncentraci; a v 2/17 (11.7%) mobil-zdarma bakteriální přípravky, poškození buněk byla zcela inhibována při koncentraci 78.2 µg/µL. Pomocí Ab anti-STX2 ukázal, že v 9/17 (52.9%) mobil-zdarma bakteriální přípravky, poškození buněk byla zcela inhibována na úrovni 37,4 µg/µL, a 6/17 (35.2%) mobil-zdarma bakteriální přípravky ukázal, snižuje poškození buněk ve stejné koncentraci; a v 2/17 (11.7%) bakteriální přípravky bez buněk, poškození buněk bylo zcela inhibováno koncentrací Ab 74,8 µg / µL (obrázky 2 a 3).

obrázek 2. Inhibice cytotoxického účinku indukovaného v kultuře Vero buněk bezbuněčnými bakteriálními přípravky Aeromonas spp. kmeny nesoucí gen stx1 nebo stx2.
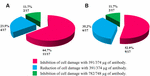
OBRÁZEK 3. Procento kmenů, které vykazovaly inhibici nebo snížení poškození buněk. (A) neutralizace anti-Stx1 Ab. B) neutralizace anti-Stx2 Ab.
stx1 Genu PCR Amplifikace z OMVs
Polymerázová řetězová reakce OMVs DNA z A. hydrophila F-0050 odhalil OMVs obsahoval gen stx1; proto, OMVs by mohla být potenciální vozidla pro horizontální virulence geny převodu (Obrázek 4).
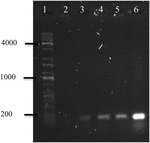
obrázek 4. Elektroferogram amplifikace genu stx1 z dna OMVs. (1) Univerzální žebřík Kapa, (2) negativní kontrola, (3) OMV a. hydrophila F-0050, (4) a. hydrophila F-0050, (5) OMV E. coli O157:H7 a (6) E. coli O157: H7.
Diskuse
rodu Aeromonas, jako výrobce Stx, může být vznikající patogen, který způsobuje průjem hlavně u dětských pacientů (Hernández-Cortez et al., 2011; Figueras a Baez-Hidalgo, 2014). Nicméně, tento rod stal se více relevantní v lékařské oblasti, jako je patogen způsobující HUS (San Joaquín a Pickett, 1988; Bogdanović et al., 1991; Robson et al., 1992; Fang et al., 1999; Monforte-Cirac et al., 2010).
v této studii jsme pomocí PCR amplifikace genů stx1 a stx2 zjistili, že 22/66 (33 .3%) kmenů aeromonad obsahoval Gen stx1, 42/66 (63,6%) kmenů obsahovalo oba geny a neexistovaly žádné kmeny obsahující samotný stx2. To nás může vést k naznačují, že tento gen je široce distribuován v Aeromonas kmenů izolovaných od dětských pacientů a že tito pacienti mohou být v ohrožení pro rozvoj HUS.
Tam je jen jeden předchozí zprávu, ve které stx genů byly studovány v Aeromonas kmenů izolovaných z různých nemocnicích ve Španělsku; získané výsledky byly, že 19/80 (23.7%) kmenů měl genu stx1 a pouze 1/80 (1.25%) kmen byl pozitivní pro oba geny (Alperi a Figueras, 2010). Tyto výsledky sdělit, že tam je větší distribuce genu v Mexické kmeny; měli bychom však vzít v úvahu, že ve Španělsku, Aeromonas rodu je známo, že gastrointestinální patogenů izolovaných rutinně u pacientů s gastrointestinální profil, proto je adekvátní léčba je vzhledem ke konfrontaci tohoto rodu.
v Mexiku není tento rod zařazen do seznamu patogenů způsobujících průjem a není běžně izolován; v důsledku toho je obtížné poskytnout pacientům jakoukoli léčbu a dobrou kvalitu života, navíc neexistují žádné statistiky o jeho prevalenci. Kromě toho rodu se stává více relevantní vzhledem k socioekonomické podmínky Mexické populace, které zahrnují nedostatek vody; to usnadňuje jeho přenos a zvyšuje možnost, že HUS se stal veřejný zdravotní problém.
Sekvenování amplikonů byla provedena a Výbuch hledání byla provedena, který ukázal, 79-99% podobnost a očekávaná hodnota 3e-16/2e-97 mezi genů stx1/stx2 v porovnání s E. coli O157:H7.
LD50 byl určen k vyhodnocení cytotoxického poškození v kultuře buněk Vero; s tímto parametrem a na základě Marques et al. (1986), kmeny mohou být seskupeny do nízké (2 × 101 až 6 × 102), střední (103-104) a vysoké (105-108) produkce (obrázek 1G). Marques et al. (1986) provedli studii, ve které udělali podobný test se, že této studie, ale s různých kmenů STEC, které získali, že 262/400 (63%) kmenů byly seskupeny tak nízké, Stx výrobců, a 48% vyrobené cytotoxické poškození; nicméně u 40% těchto kmenů bylo cytotoxické poškození inhibováno anti-STX protilátkami.
V této studii, 25.7% bakterií-bez přípravy způsobil cytotoxické poškození charakteristické Stx ve Vero buňkách, což naznačuje, výroba aktivní Stx, všechny kmeny Aeromonas byly seskupeny tak nízké, výrobci Stx; nicméně, v 50-70% mobil-zdarma supernatanty, poškození buněk byl inhibován a v 20-30% mobil-zdarma supernatant buněčné poškození byla snížena (viz Obrázek 3). Buňka-zdarma supernatanty, ve kterém buněčné poškození byl snížen to mohlo být, protože má dvě varianty toxinu přítomného v supernatantu, následně, jako jsou různé imunologicky, Stx nemůže být zcela potlačen a buněčné poškození zůstal (Marques et al., 1986).
dvě předchozí studie (Haque et al., 1996; Alperi a Figueras, 2010) získalo 10,2% a 10,53% kmenů Aeromonas produkujících Stx1. Důvodem pro vyšší procento kmenů Aeromonas produkují aktivní Stx by mohlo být způsobeno vysokou dostupnost Stx bakteriofága uvnitř kultury jako některé STEC kmenů dopravci Stx bakterie byly izolovány z městských odpadních vod z čistíren, odpadních vod z jatek a dobytek stolice (García-Aljaro et al., 2004, 2009). Podobně transdukce byly provedeny studie in vivo s Stx fágů E. coli, které mohou infikovat střevní mikroflóry bakterie, což toxigenic charakteristiku kmenů, které nebyly infikovány, než (Acheson et al., 1998; Schmidt a kol., 1999; Gamage et al., 2003). Totéž by se mohlo stát s rod Aeromonas, když vyvolávající gastrointestinální profil, následuje skutečnost, že rod Aeromonas má schopnost zachytit a integrovat faktorů virulence v jeho genomu, a jedním z nich je Stx-kódování genu.
zbytek kmenů způsobil cytotonic poškození v buňce, možná naznačuje, produkce různých toxinů, jiné než Stx, jelikož je rod Aeromonas schopen produkovat dva cytotonic enterotoxiny, termostabilní (AST) a thermolabile (ALT) (Figueras a Baez-Hidalgo, 2014), které mohou způsobit cytotonic škody ve Vero buňkách; další možností je, že kmeny Aeromonas mít více než jeden bakteriofága vložený v jejich genomu, protože bylo prokázáno, že STEC kmenů s manželskou lysogeny jsou schopny regulovat bakteriofágy, které inhibují schopnost lytický cyklus indukce, což má za následek snížení Stx výrobu, ale bez ztráty genu (García-Aljaro et al., 2004; Imamovic a Muniesa, 2011). Proto je nutné stanovit, kolik bakteriofágů obsahují kmeny Aeromonas, a to i v této studii, aby bylo možné korelovat přítomnost bakteriofágů Stx a množství produkovaného Stx.
na druhé straně přítomnost bakteriofágů Stx v indukovatelných Aeromonách představuje horizontální přenosový mechanismus genu stx, ale není jediný. V novějších studiích bylo zjištěno, že Aeromonas jsou schopny produkovat OMV (Guerrero-Mandujano et al., 2015a) a tyto OMV jsou schopny transportovat integrovanou DNA (Guerrero-Mandujano et al., 2015b). V této studii, jsme zesílit stx1 genu z DNA extrahované z OMVs jednoho A. hydrophila kmen klinické původu, které indukované cytotoxické poškození v Vero buněk, a tato škoda byla inhibována s anti-Stx protilátky. To znamená, že Stx bakteriofága je transportní mechanismus stx genu; dále OMVs a nedávno volal Dopravní Systém Typu 0 jsou schopny šíření stx genu mezidruhové nebo vnitrodruhové. Je však nutné potvrdit, zda je gen obsažený v OMV kompletní. Výsledky získané v této studii podporují hypotézu, že gen stx je dalším předpokládaným virulenčním faktorem Aeromonas, který by mohl být přenášen prostřednictvím OMV. Může představovat další mechanismus horizontálního transportu genu stx do jiných kmenů Aeromonas a / nebo jiných bakteriálních rodů.
z tohoto důvodu by měl být tento rod zahrnut jako možný původce gastroenteritidy při pokusu o identifikaci příčinných činitelů a měl by být hlášen jako součást standardních postupů zdravotního dohledu.
Autor Příspěvky
IP-M a AG-M provádí experimenty a MR-R provádí do bioinformatiky analýzy a rukopis; CH-C je navržen tak, primer; VB-G, a JM-L kriticky komentoval a revidovaný rukopis; GC-E koncipované studie, se podíleli na jeho designu a koordinace, vyhodnotil data a rukopis. Všichni autoři přečetli a schválili konečný rukopis. Rádi bychom poděkovali Sofii Marteli Mulii za laskavou opravu stylu rukopisu.
finanční Prostředky
GC-E a VB-G získal podporu z Estímulos al Desempeño en Investigación a Comisión y Fomento de Actividades Académicas (Instituto Politécnico Nacional) a Sistema Nacional de Investigadores (SNI, CONACyT). Tato studie byla financována sekretariátem výzkumu a postgraduálního Národního Polytechnického institutu (SIP 20160609). SIP-IPN nebyl zapojen do vývoje designu studie, sběru, analýzy a interpretace dat, při psaní zprávy, ani v rozhodnutí předložit papír pro zveřejnění. IP-M a AG-M měli stipendium od CONACyT a BEIFI.
Prohlášení o střetu zájmů
autoři prohlašují, že výzkum byl proveden bez jakýchkoli obchodních nebo finančních vztahů, které by mohly být vykládány jako potenciální střet zájmů.
Poděkování
děkujeme Dr. Patricia Arzate Barbosa za poskytnutí izolátů kmen a Dr. Armando Navarro pro poskytování monoklonální protilátky.
Zkratky
Ab, Antibody; HUS, Hemolyticko-uremický syndrom; INP, Instituto Nacional de Pediatria Mexiko; LD50 Střední letální dávka; OMVs, Outer membrane vesicles; PCR, Polymerase chain reaction; STEC, Shiga toxin-producing E. coli; Stx, Shiga-like toxin; TTP, Thrombotic thrombocytopenic purpura.
Acheson, D. W., Reidl, J., Zhang, X., Keusch, G. T., Mekalanos, J. J., and Waldor, M. K. (1998). In vivo transduction with shiga toxin 1-encoding phage. Infect. Immun. 66, 4496–4498.
Google Scholar
Alperi, A., and Figueras, M. J. (2010). Lidské izoláty Aeromonas mají Shiga toxin geny jsou (stx1 a stx2) velmi podobné mostu virulentní genové varianty Escherichia coli. Cline. Mikrobiol. Infikovat. 16, 1563-1567. doi: 10.1111 / j. 1469-0691. 2010. 03203.x
CrossRef Plný Text | Google Scholar
Bogdanovic, R., Čobeljić, M., Markovic, M. Nikolić, V., Ognjanović, M., Sarjanović, L., et al. (1991). Hemolyticko-uremický syndrom spojený s enterokolitidou Aeromonas hydrophila. Pediatr. Nefrol. 5, 293-295. doi: 10.1007
CrossRef Plný Text | Google Scholar
Castro-Escarpulli, G., Aguilera-Arreola, M. G., Giono-Cerezo, S., Hernández-Rodríguez, C. H., Rodriguez-Chacón, M., Soler, F. L., et al. (2002). Rod Aeromonas > důležitý patogen v Mexiku? Enf. Infec. Mik. 22, 206–216.
Google Scholar
Castro-Escarpulli, G., Figueras, J. M., Aguilera-Arreola, M. G., Soler, L., Fernández-Rendón, E., Aparicio, G. O., et al. (2003). Charakteristika Aeromonas spp. izolovaný ze zmrazených ryb určených k lidské spotřebě v Mexiku. Int. J. Food Microbiol. 84, 41–49. doi: 10.1016/S0168-1605(02)00393-8
CrossRef Plný Text | Google Scholar
Fang, J. S. Chen, J. B., Chen, W. J., a Hsu, K. T. (1999). Hemolyticko-ureemický syndrom u dospělého muže s enterokolitidou Aeromonas hydrophila. Nefrol. Vytáčení. Transplantace. 14, 439–440. doi: 10.1093/ndt/14.2.439
CrossRef Plný Text | Google Scholar
Figueras, M. J., a Baez-Hidalgo, R. (2014). „Aeromonas,“ in Encyclopedia of Food Microbiology, eds C. a. Batt and M. L. Tortorello (Cambridge, MA: Academic Press), 24-30.
Gamage, S. D., Strasser, J. E., Křídy, C. L., Weiss, a. a. (2003). Nepatogenní Escherichia coli může přispět k produkci toxinu shiga. Infikovat. Immun. 71, 3107–3115. doi: 10.1128/IAI.71.6.3107-3115.2003
CrossRef Plný Text | Google Scholar
García-Aljaro, C., Muniesa, M., Jofre, J., a Zbledl, A. R. (2004). Prevalence genu stx2 v koliformních populacích z vodního prostředí. Appl. Environ. Mikrobiol. 70, 3535–3540. doi: 10.1128/AEM.70.6.3535-3540.2004
CrossRef Plný Text | Google Scholar
García-Aljaro, C., Muniesa, M., Jofre, J., a Zbledl, A. R. (2009). Genotypová a fenotypová rozmanitost mezi indukovanými bakteriofágy nesoucími stx2 z environmentálních kmenů Escherichia coli. Appl. Environ. Mikrobiol. 75, 329–336. doi: 10.1128/AEM.01367-08
CrossRef Plný Text / Google Scholar
Giono-Cerezo, S., Rodríguez-Ángeles, M. G., Rodríguez-Cadena, M. J., a Valdespino-Gómez, J. L. (1994). Identifikace enterotoxinů a cytotoxinů Escherichia coli kulturou vero buněk a hybridizací v pevné fázi (blot kolonie). Páter Latinoam. Mikrobiol. 36, 231–241.
Google Scholar
Guerrero-Mandujano, A., López-Villegas, E. O., Longa-Briseño, A., a Castro-Escarpulli, G. (2015a). Produkce vezikul vnější membrány v klinickém kmeni Aeromonas hydrophila. EC Microbiol. 1, 113–117.
Google Scholar
Guerrero-Mandujano, A., Palma-Martínez, I., a Castro-Escarpulli, G. (2015b). Transport DNA z vnější membrány vezikuly Aeromonas hydrophila. EC Microbiol. 2, 354–357.
Google Scholar
Haque, Q.M., Sugiyama, a., Iwade, y., Midorikawa, Y., and Yamauchi, T. (1996). Průjmové a environmentální izoláty Aeromonas spp. vyrobte toxin podobný toxinu podobnému Shiga 1. Curre. Mikrobiol. 32, 239–245. doi: 10.1007/s002849900043
CrossRef Plný Text | Google Scholar
Hernández-Cortez, C., Aguilera-Arreola, M. G., Chávez-Méndez, Y., Arzate-Barbosa, P., Lara-Hernandez, A., a Castro-Escarpulli, G. (2011). Genetická identifikace kmenů Aeromonas spp. izolován v národním pediatrickém ústavu. Rev. Enfer. Infecc. Dětský. 24, 157–165.
Google Scholar
Hernández-Cortez, C., Méndez-Tenorio, A., Aguilera-Arreola, M. G., a Castro-Escarpulli, G. (2013). Návrh a standardizace čtyř multiplexních polymerázových řetězových reakcí k detekci bakterií, které způsobují gastrointestinální onemocnění. Afr. J. Mikrobiol. Rez.7, 2673-2681. doi: 10.5897/AJMR2013.5452
CrossRef Plný Text | Google Scholar
Imamovic, L., a Muniesa, M. (2011). Kvantifikace a hodnocení infekčnosti bakteriofágů kódujících Shiga toxin v hovězím mase a salátu. Appl. Environ. Mikrobiol. 77, 3536–3540. doi: 10.1128/AEM.02703-10
CrossRef Plný Text | Google Scholar
Marques, L. R. M., Moore, m. a., Wells, J. G., Wachsmuth, i. k., and O ‚ Brien, a. D. (1986). Produkce toxinu podobného shiga Escherichia coli. J. Dis. 154, 338–341. doi: 10.1093/infdis/154.2.338
CrossRef Plný Text | Google Scholar
Mauro, S. a., a Koudelka, G. B. (2011). Shiga toxin: exprese, distribuce a jeho role v životním prostředí. Toxiny 3, 608-625. doi: 10.3390/toxins3060608
CrossRef Plný Text | Google Scholar
Monforte-Cirac, M. L., Palacian-Ruiz, M. P., Aisa-Iriarte, M. L., a Espuelas-Monge, m. (2010). Hemolytický uremický syndrom Aeromonas: o klinickém případu. Reverende Cline. Duch. 210, 206–207. doi: 10.1016 / j. cer.2009.08.002
CrossRef Plný Text/Google Scholar
Robson, W. L. M., Leung, A. K. C., a Trevenen, C. L. (1992). Hemolyticko-uremický syndrom spojený s enterokolitidou Aeromonas hydrophila. Dětský. Nefrol. 6, 221–222. doi: 10.1007
CrossRef Plný Text / Google Scholar
San Joaquin, V. H., a Pickett, D. A. (1988). Gastroenteritida spojená s Aeromonas u dětí. Pediatr. Infikovat. Dis. J. 7, 53-57. doi: 10.1097/00006454-198801000-00013
CrossRef Plný Text | Google Scholar
Schmidt, H., Bielaszewska, M., a Karch, H. (1999). Přenos střevních izolátů Escherichia coli s derivátem shiga toxin 2-kódování bakteriofága f3538 izolovaný z Escherichia coli O157:H7. Appl. Environ. Mikrobiol. 65, 3855–3861.
Google Scholar