Normální metabolismus buněk závisí na údržbu krve pHwithin velmi úzkých mezích (7.35-7.45).
I relativně mildexcursions mimo normální rozmezí pH může mít deleteriouseffects, včetně snížené dodávky kyslíku do tkání, electrolytedisturbances a změny v srdeční svalovou kontraktilitu; přežití israre pokud pH krve klesne pod 6,8 nebo stoupne nad 7.8.
problemfor tělo je to, že normální metabolismus je spojena withcontinuous produkce vodíkových iontů (H+) a oxid uhličitý(CO2), které mají tendenci ke snížení pH. Na mechanismwhich překonává tento problém a slouží k udržení normální krevní pH(tj. zachování acidobazické homeostázy) je komplexní synergie činnosti zahrnující chemické pufry v krvi, červené krvinky(erytrocyty), které cirkulují v krvi, a funkce threeorgans: plíce, ledviny a mozek.
než vysvětlíte, jak těchto pětprvky přispívají k celkovému udržení pH krve, by bylo užitečné rychle přezkoumat některé základní pojmy.
- co je kyselina, co je báze a co je pH?
- Co je pufr? – bikarbonátovém pufru systému
- funkce Plic, transport CO2 a kyselina-basebalance
- Ledviny a acidobazická rovnováha
- PORUCHY acidobazické ROVNOVÁHY
- Příčiny poruch acidobazické rovnováhy
- Respirační acidóza – (zvýšený pCO2(a),snížení pH)
- Respirační alkalóza – (reducedpCO2(a), zvýšené pH)
- metabolická acidóza – (sníženáhco3 -, snížené pH)
- metabolická alkalóza – (zvýšenáhco3 -, zvýšené pH)
- Odškodnění – v důsledku kyseliny-basedisturbance
- Smíšené acidobazické poruchy
- shrnutí
- někteří navrhli dalšíčtení
co je kyselina, co je báze a co je pH?
kyselina je látka, která uvolňuje ionty vodíku (H+) při disociaci v roztoku.
například: Kyselina chlorovodíková (HCl) disociuje na hydrogenions a chloridových iontů
HCl ![]() H+ + Cl-
H+ + Cl-
kyselina Uhličitá (H2CO3) odloučí tohydrogen ionty a bikarbonátové ionty
H2CO3 ![]() H+ +HCO3–
H+ +HCO3–
rozlišujeme mezi silné kyseliny, jako je kyselina chlorovodíková andweak kyseliny, jako kyselina uhličitá. Rozdíl je v silných kyselináchdisociovat více než slabé kyseliny. V důsledku toho je vodíkový ionkoncentrace silné kyseliny mnohem vyšší než koncentrace slabé kyseliny.
báze je látka, která v roztoku přijímávodíkové ionty.
například, základní hydrogenuhličitan (HCO3–)přijímá vodíkové ionty za vzniku kyseliny uhličité,
HCO3– + H+ ![]() H2CO3
H2CO3
pH je rozsah 0-14 kyselosti a zásaditosti. Čistá voda má pH 7 a je neutrální (ani kyselá, ani zásaditá). pH nad 7JE alkalické a pod 7 kyselé. PH krve (7,35-7,45) je tedy mírně alkalické, i když v klinické medicíně je termín alkalózaje možná matoucí, vyhrazeno pro pH krve vyšší než 7.45A termín acidóza je vyhrazen pro pH krve nižší než 7,35.
pH je míra koncentrace vodíkových iontů (H+).Dva se týkají podle followingequation:
pH = – log10
kde je koncentrace vodíkových iontů inmoles za litr (mol/L)
Z této rovnice
pH 7.4 = koncentrace H+ 40 nmol/L
pH 7.0 = H+ o koncentraci 100 nmol/L
pH 6.0 = H+ o koncentraci 1000 nmol/L,
je zřejmé, že:
- dva parametry se mění inverzně; jako koncentrace vodíkových iontů zvyšuje pH klesá
- vzhledem k logaritmické vztah, velkou změnu koncentrace vodíkových iontů je ve skutečnosti, že malé změny v pH. Například zdvojnásobení koncentrace vodíkových iontů způsobuje, že pH klesne o 0,3
Co je pufr? – bikarbonátovém pufru systému
Nárazníky jsou chemické látky v roztoku, které se minimalizovalo změňte v pH, které nastane, když kyseliny jsou přidány ‚vyčištění’hydrogen ionty. Pufr je roztok slabé kyseliny a jehokonjugátová báze. V krvi je princip pufrového systému slabýkyselina, kyselina uhličitá (H2CO3)a její konjugovaná báze, hydrogenuhličitan (HCO3–). Vysvětlit, jestli tahle systém minimalizuje změny v pH, předpokládám, že přidáme silnou kyselinu,např. HCl, na bikarbonátový pufr:
kyselina začne uvadat, uvolňuje vodíkové ionty:
HCl ![]() H+ + Cl–
H+ + Cl–
bikarbonátovém pufru pak absorbuje‘ vodíkové ionty, formingcarbonic kyseliny v procesu:
HCO3– + H+ ![]() H2CO3 (kyselina uhličitá)
H2CO3 (kyselina uhličitá)
důležité je, že protože vodíkové ionty z HClhave byla začleněna do slabé kyseliny uhličité, která se notdissociate stejně snadno, celkový počet vodíkových iontů v solutionand proto pH se nemění tolik, jak by occurredin absence vyrovnávací paměti.
i když pufr výrazně minimalizuje změnu, nevylučuje ji, protože i slabá kyselina (kyselina uhličitá) se do určité míry disociuje. PH pufru je funkcí relativních koncentrací slabékyseliny a její konjugované báze.
pH = 6.1 + log ( /)
Kde = koncentrace ofbicarbonate
= koncentrace kyseliny uhličité
Tento vztah, známý jako Henderson-Hasselbalch rovnice,ukazuje, že pH se řídí poměr báze(HCO3–) koncentrace kyseliny(H2CO3) koncentrace.
jako vodíkové ionty se přidávají do hydrogenuhličitanového pufru:
H+ +HCO3– ![]() H2CO3
H2CO3
bikarbonátu sodného (base) je spotřebována (koncentrace klesá) andcarbonic kyseliny vzniká (zvyšuje koncentraci). Pokud hydrogenions i nadále být přidány, všechny hydrogenuhličitan by nakonec beconsumed (v přepočtu na kyselinu uhličitou) a tam by nobuffering efekt – pH by se pak prudce klesat, pokud se více kyseliny wereadded.
Nicméně, pokud se kyselina uhličitá může být trvale odstraněna ze systému a hydrogenuhličitan neustále regenerovat, pak thebuffering kapacitu, a proto pH může být zachováno despitecontinued kromě vodíkových iontů.
Jak bude jasné, s více detaily fyziologie ofacid-base rovnováhy, který je, v podstatě, co se děje v těle. V důsledku toho plíce zajišťují odstranění kyseliny uhličité (jako oxidu uhličitého) a ledviny zajišťují nepřetržitou regeneraci bikarbonátu.
tato role plic je závislá na singularcharakteristickém pufrovacím systému bikarbonátu a to je schopnost kyseliny uhličité přeměnit na oxid uhličitý a vodu.
následující rovnice popisuje vztah allelements z hydrogenuhličitan ukládání do vyrovnávací paměti systému, jak to funguje v thebody
H+ +HCO3– ![]() H2CO3
H2CO3 ![]() H2O + CO2
H2O + CO2
je důležité si uvědomit, že reakce jsou reverzibilní.Směr závisí na relativní koncentraci každéhoprvku. Takže například vzestup oxidu uhličitéhokoncentrace nutí reakci doleva se zvýšenou tvorbou kyseliny uhličité a nakonec vodíkových iontů.
to vysvětluje kyselý potenciál oxidu uhličitého a přivádí nás k důležitémpříspěvek, který plíce a červené krvinky dělají k celkové acidobazické rovnováze.
funkce Plic, transport CO2 a kyselina-basebalance
konstantní množství CO2 v krvi, který je nezbytný pro normalacid-base rovnováhy, odráží rovnováhu mezi které produkoval v důsledku tkáně metabolismus buněk a vylučován plícemi inexpired vzduchu.
změnou rychlosti vylučování oxidu uhličitého regulují plíce obsah oxidu uhličitého v krvi.Sled událostí z produkce oxidu uhličitého vtkáně k eliminaci v prošlém vzduchu je popsán na obr. 1.Oxid uhličitý difunduje z tkáňových buněk do okolíkapilární krev (obr. 1a). Malá část se rozpouští v krviplasma a je transportována do plic beze změny.
ale většina difundujena červené krvinky, kde se kombinuje s vodou za vzniku kyseliny uhličité.Kyselina se disociuje s produkcí vodíkových iontů abikarbonát. Vodíkové ionty se spojí s odkysličenou hemoglobinu(hemoglobin se chová jako nárazníkové zde), prevence dangerousfall v buněčném pH, bikarbonát difunduje podél concentrationgradient z červených krvinek do plazmy.
tedy většina oxidu uhličitéhoprodukované v tkáních je transportován do plic jako bikarbonátv krevní plazmě.
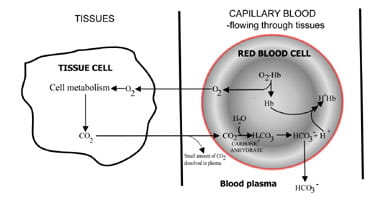
Obr. 1a. CO2 produkovaný v tkáních přeměněn na hydrogenuhličitan pro transport do plic.
|
|
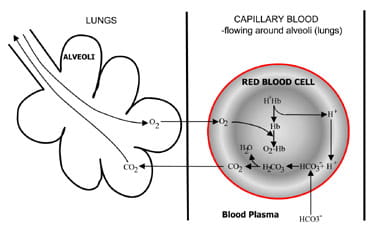
Fig. 1b. At the lungs bicarbonate convertedback to CO2 and eliminated by the lungs.
u alveol v plicích je proces obrácen (obr. 1b).Vodíkové ionty jsou vytlačovány z hemoglobinu, protože zabírají kyslíkz inspirovaného vzduchu. Vodíkové ionty jsou nyní pufrovány bikarbonátem, který difunduje z plazmy zpět do červených krvinek a vzniká kyselina uhličitá. Vzhledem k tomu, že koncentrace stoupá, je topřeveden na vodu a oxid uhličitý. Nakonec oxid uhličitý snižuje koncentrační gradient z červených krvinek do alveol proexkreci ve vzduchu, který vypršel.
Dýchací chemoreceptory v mozku reagují na změny koncentrace oxidu uhličitého v krvi, což způsobuje increasedventilation (dýchání), pokud koncentrace oxidu uhličitého stoupne anddecreased větrání pokud se oxidu uhličitého falls.
Ledviny a acidobazická rovnováha
Normální buněčný metabolismus výsledky v continuousproduction vodíkových iontů. Viděli jsme, že kombinací těchto vodíkových iontů se bikarbonátový pufr v krvi minimalizuje. Pufrování je však užitečné pouze v krátkodobém horizontu a nakonec musí být vodíkové ionty odstraněny z těla.Dále je důležité, aby se hydrogenuhličitan, který se používábušní vodíkové ionty, neustále nahrazují.
tyto dva úkoly, eliminace vodíkových iontů a regenerace hydrogenuhličitanu, jsoudoplněné ledvinami. Buňky renálních tubulů jsou bohaté naenzym karboanhydráza, která usnadňuje tvorbu karbonukyseliny z oxidu uhličitého a vody. Kyselina uhličitá se disociujebikarbonátové a vodíkové ionty. Bikarbonát se reabsorbujekrve a vodíkové ionty procházejí do lumen tubulu ajsou vyloučeny z těla močí.
tato vylučování močí jezávisí na přítomnosti pufrů v moči, hlavněfosfátových a amoniakových iontů.
PORUCHY acidobazické ROVNOVÁHY
Většina poruch acidobazické rovnováhy výsledek od
- onemocnění, nebo poškození orgánů (ledviny, plíce, mozek), jehož normální funkce je nezbytná pro acidobazické homeostázy,
- onemocnění, které způsobuje abnormálně zvýšené produkci metabolických kyselin tak, že homeostatické mechanismy jsou zahlceni
- lékařský zásah (např. mechanické ventilace, některé léky)
arteriální krevní plyny jsou krevní test používaný k identifikaci amonitorových acidobazických poruch. Tři parametry měřené duringblood analýza plynů, arteriální pH krve (pH), parciální tlak uhlíku uhličitého v arteriální krvi (pCO2(a)) soustředění bikarbonátu (HCO3–) jsou ofcrucial význam (viz Tabulka I pro referenční (normální) rozmezí).Výsledky těchto tří umožňují klasifikaci kyselinyporucha do jedné ze čtyř etiologických kategorií:
- Respiratory acidosis
- Respiratory alkalosis
- Metabolic acidosis
- Metabolic alkalosis
|
Adults |
Neonates |
|
|
pH |
7.35-7.45 |
7.30-7.40 |
|
pCO2 (kPa) |
4.7-6.0 |
3.5-5.4 |
|
Bicarbonate |
22-28 |
15-25 |
TABLE I. Orientační referenční (normální)se pohybuje
pochopit, jak výsledky pH, pCO2(a)a hydrogenuhličitan jsou použity ke klasifikaci poruch acidobazické rovnováhy v thisway, musíme se vrátit do Henderson-Hasselbalch rovnice
pH = 6.1 + log (/ )
měříme pH a hydrogenuhličitan ale ne kyselina uhličitá(H2CO3). Nicméně, tam je tedy vztah mezi pCO2(a) a H2CO3which umožňuje přepočet z Henderson-Hasselbalch rovnice má tři parametry (pH, pCO2(a) andbicarbonate) naměřené během analýzu krevních plynů:
pH = 6.1 + log ( /( pCO2(a) × 0.23))
Tím, že odstraní všechny konstanty z rovnice, tedy vztah mezi tří měřených parametrů může být více simplystated:
pH ∝ / pCO2(a)
Tento vztah zásadní pro pochopení všech thatfollows o acidobazické poruchy, uvádí, že arterialblood pH je proporcionální k poměru bikarbonátu concentrationto pCO2(a). Umožňuje následující:
- pH zůstává normální, pokud poměr: pCO2(a) zůstává normální
- pH se zvyšuje (tj. alkalóza se vyskytuje), pokud se buď zvyšuje nebo pCO2(a) klesá.
- pH klesá (tj. acidóza se vyskytuje), pokud se buď snižuje nebo pCO2(a) se zvyšuje
- Pokud jsou oba pCO2(a) a se zvýšil o relativně stejné množství, poměr a proto pH jsou normální
- Pokud jsou oba pCO2(a) a se snížil o relativně stejné množství, poměr a proto pH jsou normální.
acidobazické poruchy postihují primárně buďpco2(a), v tomto případě se nazývá arespirační porucha nebo v tomto případě se nazývá anon-respirační nebo metabolická porucha:
- v Případě, že primární porucha je zvýšený pCO2(a) (což způsobuje acidóza – viz výše), stav se nazývá respirační acidóza
- v Případě, že primární porucha je snížení pCO2(a) (což způsobuje alkalóza – viz výše), stav se nazývá respirační alkalóza
- v Případě, že primární porucha je spojena se sníženou sodný (které výsledky v acidóza – viz výše), stav se nazývá metabolická acidóza
- v Případě, že primární porucha je spojena se zvýšeným sodný (které výsledky v alkalóza – viz výše), stav se nazývá metabolická alkalóza
Příčiny poruch acidobazické rovnováhy
Respirační acidóza – (zvýšený pCO2(a),snížení pH)
Respirační acidóza je charakterizována increasedpCO2(a) vzhledem k nedostatečné alveolární ventilace(hypoventilace) a následné snížené eliminace ofCO2 z krve. Respirační onemocnění, jako jebronchopneumonie, emfyzém, astma a chronické obstrukční dýchací cestynemoci, mohou být spojeny s hypoventilací dostatečnou kzpůsobit respirační acidózu.
některé léky (např. morfin abarbituráty) může způsobit respirační acidózu depresírespirační centrum v mozku. Poškození nebo trauma hrudní stěnya svaly zapojené do mechaniky dýchání mohousnížit rychlost ventilace. To vysvětluje, dýchací acidosisthat může komplikovat průběh onemocnění, jako jsou dětská obrna,syndrom Guillain-Barre syndrom a zotavení z těžké trauma hrudníku.
Respirační alkalóza – (reducedpCO2(a), zvýšené pH)
naopak, respirační alkalóza je charakterizována decreasedpCO2(a) v důsledku nadměrné alveolární ventilationand což vede k nadměrné vylučování CO2 z krve.Onemocnění, při kterém je v důsledku sníženého kyslíku v krvi (hypoxémie) stimulováno dýchací centrum, může mít za následek respiračníalkalózu.
příklady zde zahrnují těžkou anémii, plicní emboliia respirační syndrom dospělých. Hyperventilace dostatečná kzpůsobit respirační alkalózu může být rysem úzkostných záchvatů aodpovídá silné bolesti. Jedna z méně vítaných vlastnostísalicylát (aspirin) je jeho stimulační účinek na respiračnícentrum. Tento účinek odpovídá respirační alkalózědochází po předávkování salicylátem. Konečně, nadšenímechanická ventilace může způsobit respirační alkalózu.
metabolická acidóza – (sníženáhco3 -, snížené pH)
snížený bikarbonát je vždy znakem metabolickéacidózy. K tomu dochází z jednoho ze dvou důvodů: zvýšené použitíbikarbonát při pufrování abnormální zátěže kyselinou nebo zvýšené ztrátyhydrogenuhličitanu z těla. Diabetická ketoacidóza a laktikacidóza jsou dva stavy charakterizované nadprodukcímetabolických kyselin a následného vyčerpání hydrogenuhličitanu.
V prvním případě, abnormálně vysoká koncentrace v krvi keto-kyselin(b-hydroxymáselnou kyselinu a kyselinu acetoctové) odrážejí severemetabolic poruch, které vyplývají z insulindeficiency.
všechny buňky produkují kyselinu mléčnou, pokud mají nedostatek kyslíku, takže zvýšená produkce kyseliny mléčné a výsledná metabolickacidóza se vyskytují v jakémkoli stavu, kdy je vážně ohrožena dodávka kyslíku do tkání.
příklady zahrnují srdeční zástavu a jakýkoli stav spojený s hypovolemickým šokem (např. masivní ztráta tekutin). Játra hraje důležitou roli při odstraňování malá částka kyseliny mléčné, který je produkován během normálního cellmetabolism, tak, že laktátové acidózy může být funkce liverfailure.
abnormální ztráta bikarbonátu z těla může nastat běhemsilný průjem. Pokud není zaškrtnuto, může to vést k metabolické acidóze.Selhání regenerace hydrogenuhličitanu a vylučování iontů vodíkuvysvětluje metabolickou acidózu, ke které dochází při renálním selháním.
metabolická alkalóza – (zvýšenáhco3 -, zvýšené pH)
bikarbonát je vždy zvýšen v metabolické alkalóze. Zřídka nadměrné podávání hydrogenuhličitanu nebo požití hydrogenuhličitanuv antacidovém přípravku může způsobit metabolickou alkalózu, ale to jeobvykle přechodné. Abnormální ztráta vodíkových iontů z těla můžebýt primárním problémem. Bikarbonát, který by jinak bylspoužívá v pufrování těchto ztracených vodíkových iontů následněakumuluje se v krvi. Žaludeční šťáva je kyselá a žaludečníaspirace nebo jakýkoli chorobný proces, při kterém je žaludeční obsahztratil z těla představuje ztrátu vodíkových iontů.
Aprojektilní zvracení žaludeční šťávy například vysvětlujemetabolická alkalóza, která se může vyskytnout u pacientů s pylorikstenózou. Těžká deplece draslíku může způsobit metabolické alkalózykvůli vzájemnému vztahu mezi vodíkem a draslíkem.
Odškodnění – v důsledku kyseliny-basedisturbance
To je pro život důležité, že pH není vzdání se příliš daleko od normálu,a tělo bude vždy pokus o návrat abnormální pH towardsnormal když acidobazické rovnováhy je narušen. Odškodnění je pak dáno tomuto procesu zachování života. Pochopitkompenzace, je důležité připomenout, že pH se řídí theratio: pCO2(a). pokud je poměr normální, bude pH normální.
zvažte pacienta s metabolickou acidózou, jehož pH je nízképrotože hydrogenuhličitan je nízký. Kompenzovat nízký a obnovitvšechny důležité poměry k normálu pacient musí snížit hispCO2(a). Chemoreceptory v respiračnímcentru mozku reagují na stoupající koncentraci vodíkových iontů (nízké pH), což způsobuje zvýšenou ventilaci (hyperventilaci) aještě zvýšenou eliminací oxidu uhličitého; pCO2 (a) klesá a poměr: pCO2 (a) se vrací do normálu.
Kompenzace metabolické alkalózy, v nichž je vysoká, naopak, involvesdepression dýchání a tím zadržování uhlíku dioxideso, že pCO2(a) stoupá, aby odpovídaly increasein . Deprese dýchání má však nežádoucí vedlejší účinek ohrožující adekvátníoxygenaci tkání. Z tohoto důvodu respirační kompenzacemetabolická alkalóza je omezená.
primární poruchy pCO2(a) (respiratoryacidóza a alkalóza) jsou kompenzovány renálními úpravami vylučování vodíkových iontů, které vedou ke změnám, které vhodně kompenzují primární změnu pCO2 (a). Renální kompenzace respirační acidózy (zvýšenápco2(a)) zahrnuje zvýšenou reabsorpci bikarbonátu a renální kompenzace respirační alkalózy(snížená pCO2(a)) zahrnuje sníženou bikarbonátovou absorpci.
koncept acidobazické rovnováhy během kompenzaceje vizuálně vyjádřen na obr. 2. Tabulka II shrnuje krevní plynvýsledky, které charakterizují všechny čtyři poruchy acidobazické báze dřívea po kompenzaci.
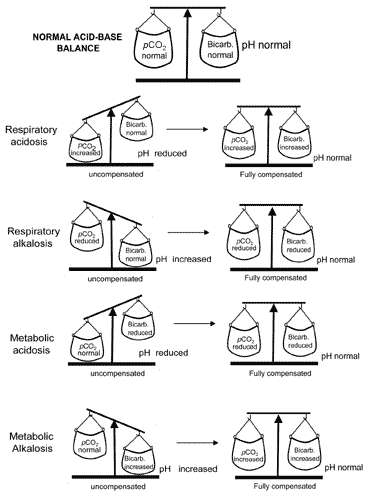
Obr. 2. „Acidobazická rovnováha“ : compensationrestores normal pH
|
Primary disturbance |
||||
|
Respiratory |
Repiratory |
Metabolic |
Metabolic |
|
|
Some |
Emphysema |
Hyper- |
Renal failure |
Bicarbonate Potassium |
|
Compen- |
RENAL |
RENAL |
RESPIRA- |
RESPIRA- |
|
Initial blood |
pH |
pH |
pH |
pH |
|
Blood gas |
pH pCO2 |
pH pCO2 |
pH pCO2 |
Limitovaná |
|
Blood gas |
pH normal |
pH normal |
pH normal |
Limited |
Printfriendly verze tabulky, pdf.
TABULKA II. Krevní plyny následek poruchy ofacid-base rovnováhy,
Respirační kompenzací primární metabolické disturbanceoccurs mnohem rychleji, než metabolické (renální) náhrada za primární respirační poruchy. Ve druhém případě kompenzacedochází spíše v průběhu dnů než hodin.
pokud má kompenzace za následek návrat pH na normální hodnotu, pak je pacient plně kompenzován. V mnoha případech však kompenzace vrací pHtowards normální, aniž by skutečně dosáhla normality; v takových případechpacient je údajně částečně kompenzován.
Prodůvody popsané výše, metabolická alkalóza je velmi vzácně plně kompenzována.
Smíšené acidobazické poruchy
To může být předpokládal, že z výše uvedené diskuse, ževšechny pacientů s acid-base poruchy trpí pouze jedním ze čtyř kategorií acidobazické rovnováhy. To může být případ, ale za zvláštních okolností mohou pacienti vykazovat více nežjedna porucha.
zvažte například pacienta s chronickým onemocněním plic, jako je emfyzém, který má dlouhodobě částečně kompenzovanou respirační acidózu. Pokud tento pacient také adiabetic, která nepřijala jeho normální dávky inzulínu a jako resultwas ve stavu, diabetické ketoacidózy, krevní plyny výsledky wouldreflect kombinovaný účinek obou respirační acidóza andmetabolic acidózy.
takové smíšené acidobazické poruchy nejsoučasté a může být obtížné je odhalit pouze na základě výsledků arteriálního krevního plynu.
shrnutí
udržování normálního pH krve zahrnuje několik orgánových systémůa závisí na integritě oběhu. Není divu, potéže poruchy acidobazické rovnováhy může komplikovat průběh ofwidely různých onemocnění, stejně jako trauma mnoha částech thebody. Tělo má značnou sílu zachovat pH krve aporuchy obvykle znamenají buď závažné chronické onemocnění nebo akutníkritické onemocnění.
výsledky analýzy arteriálních krevních plynů mohouidentifikovat narušení acidobazické báze a poskytnout cenné informace jakojeho příčinu.
- Thomson WST, Adams JF, Cowan RA. Klinická acidobazická rovnováha. Oxford: Oxford Medical Publications 1997
- Harrison RA. Acidobazická rovnováha. Respir Care Clin N. America 1995; 1,1: 7-21
- Woodrow P. analýza arteriálních krevních plynů. Nursing Standard 2004; 18,21: 45-52
- Sirker AA, Rhodes A, Gounds RM, Bennet ed. Acidobazická fyziologie: „tradiční“ a „moderní“ přístup. Anestezie 2002; 57: 348-56