Deci, după cum știți, Dmitri Mendeleev este tatăl tabelului periodic. Dar știați că tabelul Periodic Modern pe care îl folosim a fost de fapt dezvoltat de un om de știință pe nume Henry Moseley? Să învățăm istoria fascinantă din spatele tabelului periodic.
Suggested Videos
tabelul periodic modern
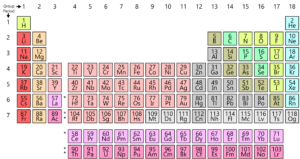
după cum știți, toate elementele găsite pe pământ sunt aranjate într-o grilă sau matrice numită tabelul periodic modern. Aranjamentul acestor elemente este conform unui model. Tabelul periodic a fost de fapt dezvoltat și de Mendeleev la începutul anilor 1800. Cu toate acestea, a fost de fapt perfecționat de Henry Moseley, un fizician englez în 1913. Prin ajustarea legii periodice, el a îmbunătățit toate defectele tabelului Mendeleev. Să aruncăm o privire la această evoluție.
Răsfoiți mai multe subiecte sub clasificarea periodică a elementelor
- încercări anterioare de clasificare a elementelor
- poziția elementelor în tabelul Periodic Modern
- tendințe în tabelul Periodic Modern
folosind numărul Atomic
În primul rând, să aruncăm o privire la structura unui atom. Fiecare atom este alcătuit dintr-un nucleu care constă din protoni și neutroni. Aici protonii au o sarcină pozitivă și un neutron nu are nicio sarcină. Acum electronii (care poartă o sarcină negativă) înconjoară nucleul. Acum numărul de masă atomică este numărul total de protoni și neutroni dintr-un atom. Și numărul atomic este numărul de protoni dintr-un atom. Acest număr atomic este complet unic pentru fiecare element, ceea ce înseamnă că fiecare element de pe planetă are propriul său număr atomic unic.Henry Moseley a fost cel care a sugerat un aranjament mai bun decât Mendeleev. El a aranjat elementele în funcție de numărul lor Atomic, mai degrabă decât de masa lor atomică. Procedând astfel, el a îmbunătățit tabelul anterior și a eliminat unele dintre dificultățile și anomaliile sale.
poziția hidrogenului
Mendeleev nu a putut niciodată să-și dea seama de poziția corectă a hidrogenului în tabelul său. Deoarece hidrogenul poate câștiga sau pierde un electron, acesta poate găsi un loc în Grupa 1 sau 17. Configurația sa electronică seamănă cu cea a metalelor alcaline. Deși se poate combina și cu metale și nemetale formând legături covalente precum halogeni.
dar în tabelul periodic modern, nu există nicio dilemă. Deoarece numărul Atomic de hidrogen este 1, acolo își găsește locul potrivit la începutul tabelului.
izotopii
izotopii sunt atomi diferiți ai unui element, fiecare având același număr de protoni, dar un număr diferit de neutroni în nucleele lor. Aceasta implică faptul că, deși masa lor atomică variază, numărul lor atomic este același. Ca de exemplu, Carbon-14 este un izotop radioactiv al atomului de carbon care are opt neutroni.
în timp ce aceasta a prezentat o problemă pentru Mendeleev, deoarece tabelul depindea de masa atomică, nu este o problemă cu tabelul Periodic Modern. Toți izotopii elementelor nu au locuri separate pe masă.
ordinea anumitor elemente
Mendeleev când a folosit masa atomică pentru a aranja elementele s-a confruntat cu o altă problemă. Au existat anumite cazuri în care a existat o rupere a acestui aranjament, astfel încât elementele cu proprietăți similare au fost într-un grup împreună. Luați exemplul iodului și telurului. Acum masa atomică a iodului este mai mică decât telurul. Și totuși Mendeleev a pus-o după telur, astfel încât să poată fi în același grup cu fluorul și clorul.
în tabelul periodic modern, masa atomică devine irelevantă și elementele sunt grupate cu elemente similare pe baza numărului lor atomic.
elemente de pământuri Rare
tabelul periodic modern a rezolvat o altă problemă prin plasarea elementelor de pământuri rare, cum ar fi ceriu, lantan, erbiu etc. într-un tabel separat din partea de jos a tabelului Periodic, pentru a nu interfera cu legea periodică.
exemplu rezolvat pentru tine
Q: Din toate cele 118 elemente cunoscute, câte elemente apar în mod natural?