deoarece majoritatea noilor ioni de hidroxid sunt îndepărtați, pH-ul nu crește foarte mult.
îndepărtarea ionilor de hidroxid prin reacția cu ionii de hidrogen
amintiți-vă că există unii ioni de hidrogen prezenți din ionizarea acidului etanoic.
![]()
![]()
ionii de hidroxid se pot combina cu aceștia pentru a produce apă. De îndată ce se întâmplă acest lucru, sfaturile de echilibru pentru a le înlocui. Acest lucru continuă să se întâmple până când majoritatea ionilor de hidroxid sunt îndepărtați.
![]()
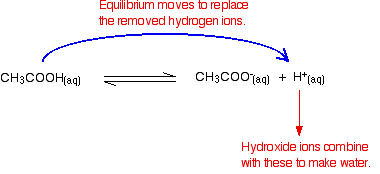
Din nou, pentru că aveți echilibre implicate, nu toți ionii de hidroxid sunt îndepărtați – doar majoritatea. Apa formată reionizează într-o măsură foarte mică pentru a da câțiva ioni de hidrogen și ioni de hidroxid.
soluții tampon alcaline
vom lua un amestec de amoniac și soluții de clorură de amoniu ca tipic.amoniacul este o bază slabă, iar poziția acestui echilibru va fi bine la stânga:
![]()
![]()
adăugarea clorurii de amoniu la aceasta adaugă o mulțime de ioni de amoniu suplimentari. Conform principiului lui Le Chatelier, aceasta va înclina poziția echilibrului chiar mai departe spre stânga.
soluția va conține, prin urmare, aceste lucruri importante:
-
o mulțime de amoniac nereacționat;
-
o mulțime de ioni de amoniu din clorura de amoniu;
-
suficient de ioni de hidroxid pentru a face soluția alcalină.
alte lucruri (cum ar fi ionii de apă și clorură) care sunt prezente nu sunt importante pentru argument.
adăugarea unui acid la această soluție tampon
există două procese care pot elimina ionii de hidrogen pe care îi adăugați.
îndepărtarea prin reacția cu amoniacul
cea mai probabilă substanță de bază cu care un ion de hidrogen se va ciocni este o moleculă de amoniac. Ei vor reacționa pentru a forma ioni de amoniu.
![]()
![]()
majoritatea, dar nu toți, ionilor de hidrogen vor fi îndepărtați. Ionul de amoniu este slab acid, astfel încât unii dintre ionii de hidrogen vor fi eliberați din nou.
îndepărtarea ionilor de hidrogen prin reacția cu ionii de hidroxid
amintiți-vă că există unii ioni de hidroxid prezenți din reacția dintre amoniac și apă.
![]()
![]()
ionii de hidrogen se pot combina cu acești ioni de hidroxid pentru a produce apă. De îndată ce se întâmplă acest lucru, echilibrul se termină pentru a înlocui ionii de hidroxid. Acest lucru continuă să se întâmple până când majoritatea ionilor de hidrogen sunt îndepărtați.
![]()
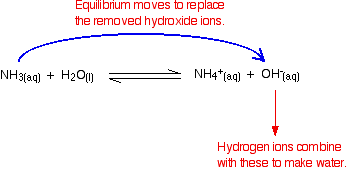
Din nou, pentru că aveți echilibre implicate, nu toți ionii de hidrogen sunt îndepărtați – doar majoritatea.
adăugarea unui alcalin la această soluție tampon
ionii de hidroxid din alcali sunt îndepărtați printr-o reacție simplă cu ionii de amoniu.
![]()
![]()
deoarece amoniacul format este o bază slabă, poate reacționa cu apa – și astfel reacția este ușor reversibilă. Asta înseamnă că, din nou, majoritatea (dar nu toți) ionii de hidroxid sunt îndepărtați din soluție.
calcule care implică soluții tampon
aceasta este doar o scurtă introducere. Există mai multe exemple, inclusiv mai multe variante, peste 10 pagini în cartea mea calcule chimie.
soluții tampon acide
Acest lucru este mai ușor de văzut cu un exemplu specific. Amintiți-vă că un tampon acid poate fi făcut dintr-un acid slab și una dintre sărurile sale.
Să presupunem că ați avut o soluție tampon care conține 0,10 mol dm-3 de acid etanoic și 0.20 mol dm-3 de etanoat de sodiu. Cum îi calculezi pH-ul?
în orice soluție care conține un acid slab, există un echilibru între acidul neionizat și ionii săi. Deci, pentru acidul etanoic, aveți echilibrul:
![]()
![]()
prezența ionilor de etanoat din etanoatul de sodiu va fi mutat echilibrul spre stânga, dar echilibrul încă mai există.
asta înseamnă că puteți scrie constanta de echilibru, Ka, pentru ea:
![]()
![]()
unde ați făcut calcule folosind această ecuație anterior cu un acid slab, veți fi presupus că concentrațiile ionilor de hidrogen și ale ionilor de etanoat au fost aceleași. Fiecare moleculă de acid etanoic care se desparte dă câte unul din fiecare tip de ion.
asta nu mai este valabil pentru o soluție tampon:
![]()
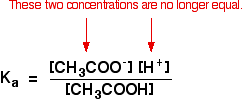
dacă echilibrul a fost împins și mai mult spre stânga, Numărul de ioni de etanoat proveniți din acidul etanoic va fi complet neglijabil în comparație cu cei din etanoatul de sodiu.
prin urmare, presupunem că concentrația ionilor de etanoat este aceeași cu concentrația etanoatului de sodiu – în acest caz, 0,20 mol dm-3.
într-un calcul al acidului slab, presupunem în mod normal că atât de puțin din acid s-a ionizat încât concentrația acidului la echilibru este aceeași cu concentrația acidului pe care l-am folosit. Acest lucru este și mai adevărat acum că echilibrul a fost mutat și mai departe spre stânga.
deci ipotezele pe care le facem pentru o soluție tampon sunt:
![]()
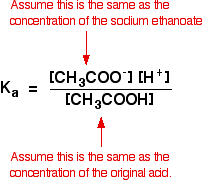
acum, dacă știm valoarea pentru Ka, putem calcula concentrația ionilor de hidrogen și, prin urmare, pH-ul.
ka pentru acidul etanoic este de 1,74 x 10-5 mol dm-3.
amintiți-vă că dorim să calculăm pH-ul unei soluții tampon care conține 0,10 mol dm-3 de acid etanoic și 0,20 mol dm-3 de etanoat de sodiu.
![]()
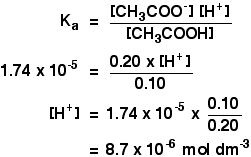
atunci tot ce trebuie să faceți este să găsiți pH-ul folosind expresia
pH = – log10
veți avea în continuare valoarea concentrației de ioni de hidrogen pe calculatorul dvs., așa că apăsați butonul log și ignorați semnul negativ (pentru a permite semnul minus în expresia pH).
ar trebui să obțineți un răspuns de 5.1 la două cifre semnificative. Nu poți fi mai precis decât asta, deoarece concentrațiile tale au fost date doar la două cifre.