metabolismul celular Normal depinde de menținerea pH-ului sanguinîn limite foarte înguste (7,35-7,45).
chiar și deplasările relativ ușoare în afara acestui interval normal de pH pot avea efecte dăunătoare, inclusiv reducerea furnizării de oxigen către țesuturi, tulburări electrolitice și modificări ale contractilității mușchiului cardiac; supraviețuirea este rară dacă pH-ul sângelui scade sub 6,8 sau crește peste 7,8.
problema pentru organism este că metabolismul normal este asociat cuproducția continuă de ioni de hidrogen (H+) și dioxid de carbon(CO2), ambele având tendința de a reduce pH-ul. mecanismcare depășește această problemă și servește la menținerea pH-ului normal al sângelui(adică conservarea homeostaziei acido-bazice) este o sinergie complexă de acțiune care implică tampoane chimice în sânge, celulele roșii(eritrocite), care circulă în sânge și funcția a trei organe: plămâni, rinichi și creier.
înainte de a explica modul în care aceste cincielemente contribuie la menținerea generală a pH-ului sângelui, ar fi util să revizuiți rapid câteva concepte de bază.
- ce este un acid, ce este o bază și ce este pH-ul?
- ce este un tampon? – sistemul tampon bicarbonat
- funcția pulmonară, transportul de CO2 și echilibrul acido-bazic
- rinichii și echilibrul acido-bazic
- tulburări ale echilibrului acido-bazic
- cauze ale tulburărilor acido – bazice
- acidoză respiratorie – (pCO2 crescut(a),pH redus)
- alcaloză respiratorie – (redusăpco2(a), pH crescut)
- acidoză metabolică – (scăderehco3–, scăderea pH-ului)
- alcaloză metabolică – (crescutăhco3– , pH crescut)
- compensare – o consecință a tulburărilor pe bază de acid
- tulburări acido-bazice mixte
- rezumat
- unii au sugerat mai departecitind
ce este un acid, ce este o bază și ce este pH-ul?
un acid este o substanță care elibereazăionii de hidrogen (H+) pe disociere în soluție.
de exemplu: Acidul clorhidric (HCl) disociază la hidrogenioni și ioni de clorură
HCl ![]() H+ + Cl-
H+ + Cl-
acidul Carbonic (H2CO3) disociază la ioni de hidrogen și ioni de bicarbonat
H2CO3 ![]() h+ +HCO3–
h+ +HCO3–
distingem între acizi puternici precum acidul clorhidric șiacizi slabi precum acidul carbonic. Diferența este că acizii puternicidisociază mai mult decât acizii slabi. În consecință, concentrația de ioni de hidrogen a unui acid puternic este mult mai mare decât cea a unui acid slab.
o bază este o substanță care în soluție acceptăionii hidrogeni.
de exemplu, bicarbonatul de bază (HCO3–)acceptă ioni de hidrogen pentru a forma acid carbonic:
HCO3– + H+ ![]() H2CO3
H2CO3
pH-ul este o scară de 0-14 de aciditate și alcalinitate. Apa pură areun pH de 7 și este neutru (nici acid, nici alcalin). pH peste 7este alcalin și sub 7 acid. Astfel, pH-ul sângelui (7,35-7,45) esteușor alcalin deși în medicina clinică termenul alcalozăeste, poate confuz, rezervat pentru pH-ul sângelui mai mare de 7.45și termenul de acidoză este rezervat pentru pH-ul sângelui mai mic de 7,35.
pH-ul este o măsură a concentrației de ioni de hidrogen (H+).Cele două sunt legate în conformitate cu următoarele ecuații:
pH = – log10
unde este concentrația ionilor de hidrogen inmoli pe litru (mol/L)
din această ecuație
pH 7,4 = h+ concentrație de 40 nmol/L
pH 7,0 = h+ concentrație de 100 nmol/L
pH 6,0 = h+ concentrație de 1000 nmol/L
este clar că:
- cei doi parametri se schimbă invers; pe măsură ce concentrația de ioni de hidrogen crește, pH-ul scade
- datorită relației logaritmice, o schimbare mare a concentrației de ioni de hidrogen este de fapt o mică modificare a pH-ului. de exemplu, dublarea concentrației de ioni de hidrogen determină scăderea pH-ului cu doar 0,3
ce este un tampon? – sistemul tampon bicarbonat
tampoanele sunt substanțe chimice în soluție care minimizează modificarea pH-ului care apare atunci când acizii sunt adăugați prin ‘mopping up’ ioni de hidrogen. Un tampon este o soluție a unui acid slab și a luibază conjugată. În sânge, sistemul tampon principal este slabacid, acid carbonic (H2CO3) și conjugatbaza sa, bicarbonat (HCO3–). Pentru a explica modul în care acest sistem minimizează modificările pH-ului, să presupunem că adăugăm un acid puternic,de exemplu HCl, la tamponul bicarbonat:
acidul se va disocia, eliberând ioni de hidrogen:
HCl ![]() H+ + Cl–
H+ + Cl–
tamponul bicarbonat apoi „absoarbe” ionii de hidrogen, formând acid carbonic în procesul de:
HCO3– + H+ ![]() H2CO3 (acid carbonic)
H2CO3 (acid carbonic)
important este că, deoarece ionii de hidrogen din Hclau fost încorporați în acidul carbonic slab, care nu se disociază la fel de ușor, numărul total de ioni de hidrogen din soluție și, prin urmare, pH-ul nu se modifică atât de mult pe cât s-ar fi produs în absența tamponului.
deși un tampon minimizează foarte mult schimbarea pH, nu o elimină deoarece chiar și un acid slab (cum ar fi acidul carbonic) disociază într-o oarecare măsură. PH-ul unei soluții tampon este o funcție a concentrațiilor relative ale slabuluiacid și a bazei sale conjugate.
pH = 6,1 + log (/)
unde = concentrația bicarbonatului
= concentrația acidului carbonic
această relație, cunoscută sub numele de ecuația Henderson-Hasselbalch,arată că pH– ul este guvernat de raportul dintre concentrația de bază(HCO3 -) și concentrația de acid(H2CO3).
pe măsură ce ionii de hidrogen sunt adăugați la tamponul de bicarbonat:
H+ +HCO3– ![]() H2CO3
H2CO3
bicarbonatul (baza) este consumat (concentrația scade) și se produce acid carbonic (concentrația crește). Dacă hidrogeniile continuă să fie adăugate, tot bicarbonatul ar fi în cele din urmă consumat (transformat în acid carbonic) și nu ar exista niciun efect de suferință – pH-ul ar scădea brusc dacă s-ar adăuga mai mult acid.
cu toate acestea, dacă acidul carbonic ar putea fi îndepărtat continuu din sistem și bicarbonatul regenerat constant, atunci capacitatea de încărcare și, prin urmare, pH-ul ar putea fi menținute în ciuda adăugării continue a ionilor de hidrogen.
As va deveni clar cu mai multe detalii despre fiziologiaechilibrul acido-bazic, adică, de fapt, ceea ce se întâmplă în organism. În esență, plămânii asigură îndepărtarea acidului carbonic (sub formă de dioxid de carbon), iar rinichii asigură regenerarea continuă a bicarbonatului.
acest rol al plămânilor depinde de o caracteristică singulară a sistemului de tamponare a bicarbonatului și anume capacitatea acidului carbonic de a fi transformat în dioxid de carbon și apă.
următoarea ecuație conturează relația tuturor elementelor sistemului de tamponare a bicarbonatului așa cum funcționează în corp
H+ +HCO3– ![]() H2CO3
H2CO3 ![]() H2O + CO2
H2O + CO2
este important de reținut că reacțiile sunt reversibile.Direcția depinde de concentrația relativă a fiecăruiaelement. Așa că, de exemplu, o creștere a dioxidului de carbonforțele de concentrare reacționează la stânga cu formarea crescutăa acidului carbonic și, în cele din urmă, a ionilor de hidrogen.
Acest lucru explică potențialul acid al dioxidului de carbon și ne aduce la contribuția importantă pe care plămânii și celulele roșii o fac la echilibrul acido-bazic global.
funcția pulmonară, transportul de CO2 și echilibrul acido-bazic
o cantitate constantă de CO2 în sânge, esențială pentru echilibrul acido-bazic normal, reflectă un echilibru între cel produs ca rezultat al metabolismului celulelor tisulare și cel excretat de plămâni.
prin modificarea ratei la care este dioxidul de carbonexcretat, plămânii reglează conținutul de dioxid de carbon din sânge.Secvența evenimentelor din producția de dioxid de carbon înțesuturile până la eliminarea în aerul expirat sunt descrise în Fig. 1.Dioxidul de Carbon difuzează din celulele țesutului în jursânge capilar (Fig. 1a). O mică proporție se dizolvă în sângeplasma și este transportată în plămâni neschimbată.
dar cele mai multe difuzează în celulele roșii unde se combină cu apa pentru a forma acid carbonic.Acidul disociază cu producerea de ioni de hidrogen șibicarbonat. Ionii de hidrogen se combină cu hemoglobina dezoxigenată (hemoglobina acționează ca un tampon aici), prevenind o scădere periculoasă a pH-ului celular, iar bicarbonatul difuzează de-a lungul unei concentrațiigradient de la celula roșie la plasmă.astfel, cea mai mare parte a dioxidului de carbon produs în țesuturi este transportat la plămâni sub formă de bicarbonatîn plasma sanguină.
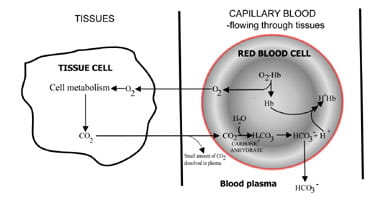
Fig. 1A. CO2 produs în țesuturiconvertit în bicarbonat pentru transportul în plămâni.
|
|
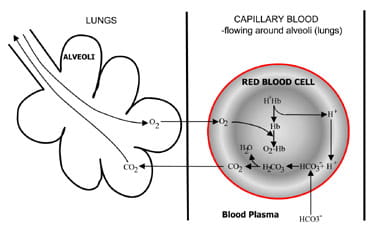
Fig. 1b. At the lungs bicarbonate convertedback to CO2 and eliminated by the lungs.
la alveolele din plămâni procesul este inversat (Fig. 1b).Ionii de hidrogen sunt deplasați din hemoglobină, deoarece preia oxigenuldin aerul inspirat. Ionii de hidrogen sunt acum tamponați de bicarbonatul care se difuzează din plasmă înapoi în celulele roșii și se formează acid carbonic. Pe măsură ce concentrația crește, esteconvertit în apă și dioxid de carbon. În cele din urmă, dioxidul de carbon difuză un gradient de concentrație de la celula roșie la Alveole pentruexcreție în aerul expirat.
chimioreceptorii respiratori din tulpina creierului răspund la modificăriîn concentrația de dioxid de carbon din sânge, provocând o ventilare crescută (respirație) dacă concentrația de dioxid de carbon crește șiventilație redusă dacă dioxidul de carbon scade.
rinichii și echilibrul acido-bazic
metabolismul celular Normal are ca rezultat o producție continuă de ioni de hidrogen. Am văzut că prin combinarea cu acești ioni de hidrogen, tamponul de bicarbonat din sânge minimizează efectul acestora. Cu toate acestea,tamponarea este utilă doar pe termen scurt și, în cele din urmă, ionii de hidrogen trebuie îndepărtați din organism.În plus, este important ca bicarbonatul care este utilizat pentru aumfla ionii de hidrogen este înlocuit continuu.
aceste două sarcini,eliminarea ionilor de hidrogen și regenerarea bicarbonatului, suntefectuate de rinichi. Celulele tubulare renale sunt bogate înenzima anhidrază carbonică, care facilitează formarea carbonului acid din dioxid de carbon și apă. Acidul Carbonic se disociază labicarbonat și ioni de hidrogen. Bicarbonatul este reabsorbit însânge și ionii de hidrogen trec în lumenul tubului șisunt eliminate din organism în urină.
această eliminare urinară este dependentă de prezența în urină a tampoanelor, în principal a ionilor de fosfat și amoniac.
tulburări ale echilibrului acido-bazic
cele mai multe tulburări acido-bazice rezultă din
- boală sau deteriorare a organelor (rinichi, plămâni, creier) a căror funcție normală este necesară pentru homeostazia acido-bazică,
- boală care determină creșterea anormală a producției de acizi metabolici, astfel încât mecanismele homeostatice sunt copleșite
- intervenție medicală (de ex. ventilația mecanică, unele medicamente)
gazele arteriale din sânge sunt testul de sânge utilizat pentru identificarea șimonitorizați tulburările acido-bazice. Trei parametri măsurați în timpul analizei gazelor din sânge, pH– ul sângelui arterial (pH), presiunea parțială a dioxidului de carbon în sângele arterial (pCO2(a)) și concentrația de bicarbonat (HCO3 -) sunt de o importanță crucială (vezi Tabelul I pentru intervalul de referință (normal)).Rezultatele acestor trei permit clasificarea tulburărilor pe bază de acid la una din cele patru categorii etiologice:
- Respiratory acidosis
- Respiratory alkalosis
- Metabolic acidosis
- Metabolic alkalosis
|
Adults |
Neonates |
|
|
pH |
7.35-7.45 |
7.30-7.40 |
|
pCO2 (kPa) |
4.7-6.0 |
3.5-5.4 |
|
Bicarbonate |
22-28 |
15-25 |
TABLE I. Intervale aproximative de referință (normale)
pentru a înțelege modul în care rezultatele pH-ului, pCO2(a) și bicarbonatului sunt utilizate pentru a clasifica tulburările acido-bazice în acest mod, trebuie să ne întoarcem la ecuația Henderson-Hasselbalch
pH = 6,1 + log (/)
măsurăm pH-ul și bicarbonatul, dar nu acidul carbonic(H2CO3). Cu toate acestea, există o relațieîntre pCO2(a) și H2co3care permite retratarea ecuației Henderson-Hasselbalch în cadrul celor trei parametri (pH, pCO2(a) șibicarbonat) măsurați în timpul analizei gazelor din sânge:
pH = 6,1 + log ( /( pCO2(a) 0.23))
prin eliminarea tuturor constantelor din această ecuație, relația dintre cei trei parametri măsurați poate fi mai simplă:
ph-ul/pCO2(a)
această relație, crucială pentru înțelegerea a tot ceea ce urmează în ceea ce privește tulburările de bază acidă, afirmă că pH-ul arterial al sângelui este proporțional cu raportul dintre concentrația de bicarbonat și pCO2(a). Permite următoarele scăderi:
- pH-ul rămâne normal atâta timp cât raportul: pCO2(a) rămâne normal
- pH-ul crește (adică alcaloza apare) dacă crește sau pCO2(a) scade.
- pH-ul scade (adică. dacă pCO2(a) crește
- dacă ambele pCO2(a) și sunt crescute cu relativ aceeași cantitate, raportul și, prin urmare, pH-ul sunt normale
- dacă ambele pCO2 (a) și sunt scăzute cu relativ aceeași cantitate, raportul și, prin urmare, pH-ul sunt normale
- dacă ambele pCO2 (a) și sunt scăzute cu relativ aceeași cantitate, raportul și, prin urmare, pH-ul sunt normale.
tulburările acido-bazice afectează în primul rând fie CO2(a), caz în care se numește tulburări respiratorii sau, caz în care se numește tulburări non-respiratorii sau metabolice:
- dacă tulburarea primară este un pCO2 crescut(a) (care provoacă acidoză – vezi mai sus), afecțiunea se numește acidoză respiratorie
- dacă tulburarea primară este un pCO2 redus(A) (care provoacă alcaloză – vezi mai sus), afecțiunea se numește alcaloză respiratorie
- dacă tulburarea primară este asociată cu bicarbonat redus (care are ca rezultat acidoză – vezi mai sus), afecțiunea se numește acidoză metabolică
- dacă tulburarea primară este asociată cu acidoză crescută
- bicarbonat (care are ca rezultat alcaloză – vezi mai sus), condiția se numește alcaloză metabolică
cauze ale tulburărilor acido – bazice
acidoză respiratorie – (pCO2 crescut(a),pH redus)
acidoza respiratorie se caracterizează prin creștereapco2(a) datorită ventilației alveolare inadecvate(hipoventilație) și, în consecință, eliminarea redusă a CO2 din sânge. Boli respiratorii, cum ar fibronchopneumonie, emfizem, astm și căile respiratorii obstructive croniceboala, toate pot fi asociate cu hipoventilație suficientă pentrucauza acidozei respiratorii.
unele medicamente (de ex. morfină șibarbiturice) poate provoca acidoză respiratorie prin deprimarecentrul respirator din creier. Deteriorarea sau trauma peretelui toracicși musculatura implicată în mecanica respirației poate reduce rata de ventilație. Acest lucru explică acidoză respiratoriecare poate complica cursul bolilor precum poliomielita,sindromul Guillain-Barre și recuperarea după traumatisme toracice severe.
alcaloză respiratorie – (redusăpco2(a), pH crescut)
în schimb, alcaloza respiratorie se caracterizează prin scăderepco2(a) datorită ventilației alveolare excesive și rezultând eliminarea excesivă a CO2 din sânge.Boala în care, datorită oxigenului redus în sânge (hipoxemie), centrul respirator este stimulat poate duce la respirație alcaloză.
exemplele de aici includ anemia severă, embolismul pulmonarși sindromul respirator adult. Hiperventilație suficientă pentrucauza alcalozei respiratorii poate fi o caracteristică a atacurilor de anxietate șirăspunsul la dureri severe. Una dintre proprietățile mai puțin binevenite alesalicilatul (aspirina) este efectul său stimulator asupra centrului respirator. Acest efect explică alcaloza respiratorie careapare după supradozajul cu salicilat. În cele din urmă, supraentuziastiventilația mecanică poate provoca alcaloză respiratorie.
acidoză metabolică – (scăderehco3–, scăderea pH-ului)
bicarbonatul redus este întotdeauna o caracteristică a metabolicacidozei. Acest lucru se întâmplă din unul din cele două motive: utilizarea crescută a bicarbonatului în tamponarea unei încărcări anormale de acid sau creșterea pierderilor de bicarbonat din organism. Cetoacidoza diabetică și lacticacidoza sunt două afecțiuni caracterizate prin supraproducția de acizi metabolici și epuizarea consecventă a bicarbonatului.
În primul caz, concentrațiile anormal de mari în sânge ale cetoacizilor(acidul B-hidroxibutiric și acidul acetoacetic) reflectă dereglările metabolice severe care rezultă din insuficiența insulinei.
toate celulele produc acid lactic dacă sunt deficitare de oxigen,astfel încât producția crescută de acid lactic și acidoza metabolică rezultată apar în orice stare în care livrarea de oxigen către țesuturi este grav compromisă.
Exemplele includ stop cardiac și orice afecțiune asociată cu șocul hipovolemic (de exemplu, pierderea masivă a fluidelor). Ficatul joacă un rol major în eliminarea miciicantitatea de acid lactic care este produsă în timpul metabolismului celular normal, astfel încât acidoza lactică poate fi o caracteristică a ficatului.
pierderea anormală a bicarbonatului din organism poate apărea în timpuldiaree severă. Dacă este necontrolat, acest lucru poate duce la acidoză metabolică.Eșecul de a regenera bicarbonatul și de a elimina ionii de hidrogenexplică acidoza metabolică care apare în eșecul renal.
alcaloză metabolică – (crescutăhco3– , pH crescut)
bicarbonatul este întotdeauna crescut în alcaloză metabolică. Rar, administrarea excesivă de bicarbonat sau ingestia de bicarbonatîn preparatul antiacid poate provoca alcaloză metabolică, dar aceasta estede obicei tranzitorie. Pierderea anormală a ionilor de hidrogen din organism poatesă fie problema principală. Bicarbonat care altfel ar fi fost consumat în tamponarea acestor ioni de hidrogen pierduți în consecință se acumulează în sânge. Sucul Gastric este acid și gastricaspirația sau orice proces de boală în care conținutul gastric estepierdut din organism reprezintă o pierdere de ioni de hidrogen.
vărsăturile erectile ale sucului gastric, de exemplu, explică alcaloza metabolică care poate apărea la pacienții cu piloricstenoză. Epuizarea severă a potasiului poate provoca alcaloză metabolicădatorită relației reciproce dintre hidrogen și potasiu.
compensare – o consecință a tulburărilor pe bază de acid
este vital pentru viață ca pH-ul să nu renunțe prea departe de normal,iar organismul va încerca întotdeauna să readucă un pH anormal la normal atunci când echilibrul acido-bazic este perturbat. Compensarea estenumele dat acestui proces de conservare a vieții. Pentru a înțelegecompensare, este important să reamintim că pH-ul este guvernat de theratio : pCO2(a).atâta timp cât raportul este normal, pH-ul va fi normal.
luați în considerare pacientul cu acidoză metabolică al cărui pH este scăzutdeoarece bicarbonatul este scăzut. Pentru a compensa scăderea și pentru a restabili raportul foarte important față de normal, pacientul trebuie să scadă hispCO2(a). Chemoreceptorii din centrul respirator al creierului răspund la o concentrație în creștere a ionilor de hidrogen (pH scăzut), provocând o ventilație crescută(hiperventilație) șiprin eliminarea crescută a dioxidului de carbon; CO2(a) scade și raportul : pCO2 (a) revine la normal.
compensarea alcalozei metabolice în care este mare, prin contrast, implicădepresia respirației și, prin urmare, reținerea dioxidului de carbonastfel încât pCO2(a) crește pentru a se potrivi cu creșterea . Cu toate acestea, depresia respirației are efectul secundar nedorit al amenințării oxigenării adecvate a țesuturilor. Din acest motiv, compensarea respiratorie aalcoza metabolică este limitată.
tulburările primare ale pCO2(a) (acidoză respiratorie și alcaloză) sunt compensate prin ajustări renale ale excreției de ioni de hidrogen care au ca rezultat modificări ale acestei compensări corespunzătoare pentru modificările primare ale pCO2(a). Astfel, compensarea renala pentru acidoza respiratorie(raisedpCO2(a)) implica reabsorbtie crescuta a bicarbonatului, iar compensarea renala pentru alcaloza respiratorie(redusa pCO2 (a)) implica reducerea absorbtiei bicarbonatului.
conceptul de echilibru acido-bazic în timpul compensăriieste transmis vizual în Fig. 2. Tabelul II rezumă gazele din sângerezultatele care caracterizează toate cele patru tulburări acido-bazice înainteși după compensare.
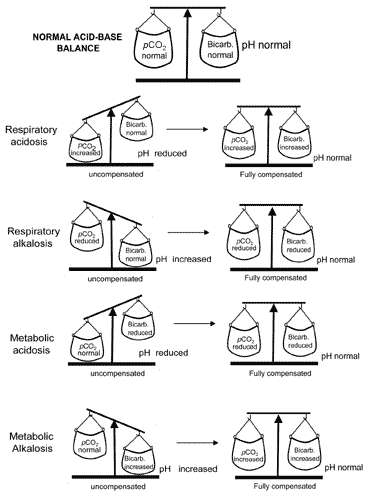
Fig. 2. „Echilibrul acido-bazic” : compensationrestores normal pH
|
Primary disturbance |
||||
|
Respiratory |
Repiratory |
Metabolic |
Metabolic |
|
|
Some |
Emphysema |
Hyper- |
Renal failure |
Bicarbonate Potassium |
|
Compen- |
RENAL |
RENAL |
RESPIRA- |
RESPIRA- |
|
Initial blood |
pH |
pH |
pH |
pH |
|
Blood gas |
pH pCO2 |
pH pCO2 |
ph pCO2 |
limitată |
|
Blood gas |
pH normal |
pH normal |
pH normal |
Limited |
Versiunea Printfriendly a tabelului, pdf.
tabelul II. gazul din sânge are ca rezultat perturbări ale echilibrului acido-bazic
compensarea respiratorie pentru o tulburare metabolică primarăapare mult mai repede decât compensarea metabolică (renală) pentru tulburările respiratorii primare. În cel de-al doilea caz, compensareaapare mai degrabă în zile decât în ore.
dacă compensarea duce la revenirea pH-ului la normal, atunci se spune că pacientul este complet compensat. Dar, în multe cazuri, compensația returnează pHtowards normale, fără a atinge de fapt normalitate; în astfel de cazurise spune că pacientul este parțial compensat.
Pentrumotivele descrise mai sus, alcaloza metabolică este foarte rar completăcompensată.
tulburări acido-bazice mixte
s-ar putea presupune din discuția de mai sus că toți pacienții cu tulburări acido-bazice suferă doar de una din cele patru categorii de echilibru acido-bazic. Acest lucru poate fi cazul, dar în anumite circumstanțe pacienții pot prezenta mai mult de o perturbare.
de exemplu, luați în considerare pacientul cu o cronicăboala pulmonară, cum ar fi emfizemul, care are o acidoză respiratorie parțială de lungă durată. Dacă acest pacient ar fi, de asemenea, adiabetic care nu și-ar fi luat doza normală de insulină și, ca rezultat, s-ar afla într-o stare de cetoacidoză diabetică, rezultatele gazelor din sânge ar reflecta efectul combinat atât al acidozei respiratorii, cât și al acidozei metabolice.
astfel de tulburări acido-bazice mixte nu sunt frecvente și pot fi dificil de dezlegat doar pe baza rezultatelor gazelor arteriale.
rezumat
menținerea pH-ului sanguin normal implică mai multe sisteme de organeși depinde de integritatea circulatorie. Nu este surprinzătorcă perturbarea echilibrului acido-bazic poate complica cursulboli foarte diverse, precum și traume pentru multe părți ale corpului. Organismul are o putere considerabilă de a păstra pH-ul sângelui șitulburările implică de obicei fie boli cronice severe, fie boli critice acute.
rezultatele analizei gazelor arteriale din sânge potidentifica perturbarea acido–bazică și oferă informații valoroase capentru cauza sa.
unii au sugerat mai departecitind
- Thomson WST, Adams JF, Cowan RA. Echilibrul acido-bazic clinic. Oxford: Oxford Medical Publications 1997
- Harrison RA. Echilibrul acido-bazic. Respir Care Clin N. America 1995; 1,1: 7-21
- Woodrow P. analiza gazelor arteriale din sânge. Nursing Standard 2004; 18,21: 45-52
- Sirker AA, Rhodes a, Gounds RM, Bennet ED. Fiziologia acido-bazică: abordarea tradițională și modernă. Anestezie 2002; 57: 348-56