
volumul molar (simbolul Vm) al unei substanțe este volumul ocupat de un mol al substanței la un moment dat temperatură și presiune. Este egal cu masa moleculară (M) a substanței împărțită la densitatea sa (inqq) la temperatura și presiunea date:
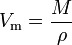
are o unitate SI de metri cubi pe mol (m3/mol). Cu toate acestea, volumele molare sunt adesea exprimate ca metri cubi la 1.000 de moli (m3/kmol) sau decimetri cubi pe mol (dm3/mol) pentru gaze și ca centimetri pe mol (cm3/MOL) pentru lichide și solide.
dacă o substanță este un amestec care conține N componente, volumul molar este calculat folosind:
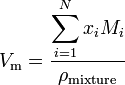
unde x i este fracția molară a componentei ith, M i este masa moleculară a componentei ith și pmixtura este densitatea amestecului la temperatura și presiunea date.
când se precizează valorile numerice ale volumului molar, este important să se precizeze și condițiile date de temperatură și presiune. În caz contrar, valorile numerice sunt lipsite de sens.
gaze ideale
ecuația legii gazului ideal poate fi rearanjată pentru a da această expresie pentru volumul molar al unui gaz ideal:
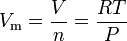
unde în unități SI:
= gazul absolut n
= numărul de moli, în mol
= volumul molar al gazului, în m3/mol
= temperatura absolută a gazului, în k
= Constanta universală a legii gazului de 8,314472 m3·pa·mol-1·K-1
în cazul în care în SUA unități obișnuite:
= presiunea absolută a gazului, în psia
= numărul de moli, în lb-mol
= volumul molar al gazului, în ft3/lb-mol
= temperatura absolută a gazului, în grade Rankine (R) br>
= Constanta universală a legii gazului de 10,7316 ft3·psia·lb-mol-L·R-1
exemplu calcule ale volumelor molare ideale de gaz:
- în unități metrice si:
vm = 8,314472 273,15/101,325 = 0,022414 m3 / mol la 0 C și 101.325 pa presiune absolută = 22,414 m3/kmol la 0 C (273,15 K) și 101.325 kPa presiune absolută Vm = 8.314472 × 273.15 / 100.000 de = 0.022711 m3/kmol de la 0 °C și 100 000 Pa presiunea absolută = 22.711 m3/kmol de la 0 °C (273,15 K) și 100 kPa presiune absolută
- obișnuiește În statele UNITE ale americii unități:
Vm = 10.7316 × 519.67 / 14.696 = 379.48 ft3/lb-mol la 60 °F (519.67 °R) și 14.696 psia
Note:
- lb-mol este o abreviere pentru lira-mol
- °R este în grade Rankine (absolută scară de temperatură) și °F este de grade Fahrenheit (o scară de temperatură).
- int.r = Int. F + 459.67
- literatura tehnică poate fi confuză, deoarece unii autori nu reușesc adesea să explice dacă folosesc Constanta universală a legii gazelor R, care se aplică oricărui gaz ideal, sau dacă folosesc Constanta specifică a legii gazelor Rs, care se aplică numai unui anumit gaz individual. Relația dintre cele două constante este Rs = R / M unde M este masa moleculară a gazului.
gazele reale
gazele reale sunt acele gaze care nu prezintă un comportament ideal al gazelor. Pentru astfel de gaze, cea mai simplă metodă de determinare a volumelor molare este prin utilizarea factorilor de compresibilitate ca în următoarea expresie:
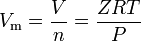
unde Z este factorul de compresibilitate a gazului, care este o proprietate termodinamică utilă pentru modificarea Legii gazului ideal pentru a ține cont de comportamentul gazelor reale. Ecuația de mai sus este în esență o ecuație simplă de stare (EOS). Limitarea majoră a acestei ecuații de stare este că factorul de compresibilitate a gazului, Z, nu este o constantă, ci variază de la un gaz la altul, precum și cu temperatura și presiunea gazului în cauză.
valori mai precise ale volumelor molare reale de gaz pot fi obținute prin utilizarea ecuațiilor de stare, cum ar fi ecuația van der Waals dezvoltată în 1873, ecuația Redlich-Kwong dezvoltată în 1949, ecuația Soave-Redlich-Kwong dezvoltată în 1972 și ecuația Peng-Robinson dezvoltată în 1976.
- 1.0 1.1 Uniunea Internațională de Chimie Pură și aplicată (IUPAC): cantități, unități și simboluri în chimia fizică ediția a 2-a, 1993
- 2.0 2.1 Ghid NIST pentru SI punctul 8.6.3 din secțiunea 8
- 3.0 3.1 determinarea valorilor compresibilității gazului informații despre modul de determinare a factorilor de compresibilitate a gazului și a volumelor molare.
| |
este posibil ca unele conținuturi de pe această pagină să fi apărut anterior pe Citizendium. |