- Introducere
- materiale și metode
- tulpini
- extragerea ADN-ului
- Stx1 și Stx2 amplificări PCR
- secvențierea ADN-ului
- preparate microplăci Vero Cells
- preparate bacteriene fără celule
- testul citotoxic și determinarea LD50
- testul de neutralizare a blocadei și toxinei
- prelevarea OMVs și extragerea ADN-ului din omvs
- rezultate
- amplificări PCR ale genei stx1 și stx2
- secvențierea ADN
- testul citotoxic și determinarea LD50
- neutralizarea toxinei
- Stx1 amplificări PCR ale genei de la OMVs
- discuție
- contribuțiile autorului
- de Finanțare
- Declarație privind conflictul de interese
- mulțumiri
- abrevieri
Introducere
de câțiva ani, semnificația Aeromonas spp., ca agent cauzator de diaree umană a fost controversat; mai multe studii au demonstrat că mecanismul patogen al Aeromonas este multifactorial, deoarece sunt implicați mulți factori de virulență, inclusiv producerea de citotoxine (Castro-Escarpulli și colab., 2002, 2003). Aceste toxine pot provoca diaree sau colită hemoragică și pot juca un rol major în sindromul hemolitic-uremic (HUS) și în dezvoltarea TTP (Bogdanovi XV și colab., 1991; Fang și colab., 1999; Monforte-Cirac și colab., 2010).citotoxinele implicate în aceste boli includ toxina Shiga și Stx strâns legate. Variantele Stx sunt exprimate în speciile bacteriene Shigella, Enterobacter, Citrobacter, Acinetobacter, Campylobacter și Hamiltonella (Mauro și Koudelka, 2011). Alperi și Figueras (2010) au descris prezența Stx1 și Stx2 în izolatele clinice ale Aeromonas spp., asociat cu gastroenterită, colită hemoragică și HUS. Genele care codifică aceste toxine sunt localizate în diferite bacteriofage lambdoide care lizogenizează această tulpină. În plus, genul Aeromonas are un sistem de secreție zero numit OMVs. OMV – urile ar putea fi un mijloc prin care unele proteine, ARN, componente spațiale periplasmice și alte componente asociate cu virulența, pot fi transferate orizontal către alte genuri; prin urmare, se crede că OMV-urile joacă un rol important în patogenitate (Guerrero-Mandujano și colab., 2015a, b).
Din acest motiv, scopul acestui studiu a fost de a evalua daunele cauzate de producerea Stx de tulpini izolate de la copii din Mexico City în culturi de celule Vero.
materiale și metode
tulpini
Acest studiu a inclus 66 de izolate clinice din INP, 54 obținute din infecții intestinale și 12 din infecții extra-intestinale. Tulpinile au fost izolate din probele obținute pentru testarea de rutină la Spitalul menționat; prin urmare, nu a fost necesar consimțământul informat al părinților sau al tutorilor legali ai copiilor. Toate tulpinile au fost identificate genetic prin 16S ADNR-RFLP (hernia Inksktsndez-Cortez și colab., 2011). Ca martor pozitiv a fost utilizată tulpina tipizată pentru Escherichia coli O157:H7 CECT 4076, iar ca martor negativ pentru producerea de toxine a fost utilizată tulpina E. coli K12 (5512 ENCB) din colecția Laboratorului de Bacteriologie medicală (Escuela Nacional de Ciencias Biologicas, IPN). Tulpinile au fost menținute pentru perioade scurte la temperatura camerei pe înclinații pe bază de agar sanguin; pentru o depozitare mai lungă, au fost fie congelate la -70 centi C în bulion de 20% (g/v) glicerol-Todd-Hewitt (Oxoid, Mexic), fie liofilizate în 7.5% ser de glucoză de cal.
extragerea ADN-ului
toate culturile au fost cultivate pe agar triptic de soia la 30 centimetric C timp de 18 ore. ADN-ul genomic al fiecărei tulpini a fost obținut prin intermediul matricei InstaGene (BioRad Centimetric, Mexic) conform instrucțiunilor furnizate de producător. Puritatea și cantitatea ADN-ului au fost determinate cu ajutorul spectrofotometrului Ampli Quant AQ-07. ADN-ul a fost stocat la -20 C până la utilizare.
Stx1 și Stx2 amplificări PCR
prezența stx1 și stx2 din ADN-ul OMVs și ADN genomic a fost detectată prin reacții unice PCR folosind primeri STX1F/STX1R și STXF / STXR cu un produs 144 și respectiv 217 bp, acești primeri au fost proiectați pe baza secvenței subunității A. primerii, reacția și condițiile de amplificare au fost procesate așa cum al. (2013), cu controalele pozitive (E. coli O157:H7) și negative (E. coli K12).
secvențierea ADN-ului
produsele de reacție în lanț a polimerazei au fost purificate folosind un Kit de extracție cu gel rapid PureLink (Invitrogen, Mexic) conform instrucțiunilor producătorului. Produsele au fost secvențiate direct pe un analizor genetic ABI-PRISM 310 (Applied Biosystems, Foster City, CA, SUA) folosind primerii forward și reverse utilizați pentru PCR, conform instrucțiunilor producătorului. Secventierea a fost efectuata la Institutul de Biologie din cadrul Unam (Mexic). Analiza secvenței a fost efectuată cu instrumentul de căutare a alinierii locale de bază (BLAST) furnizat de Centrul Național pentru Informații Biotehnologice (NCBI).
preparate microplăci Vero Cells
această procedură a fost efectuată în microplăci cu 96 de puțuri cu monostrat celular Vero (ATCC CCL81) cu confluență de 80%, adăugând mediu esențial minim (mem; Invitro XV, Mexic) suplimentat cu ser fetal bovin de 10% v / v (FBS; Invitro XV, Mexic).
suspensia celulară a fost omogenizată și ajustată la 105-106 celule / mL folosind o cameră Neubauer. După ajustare, suspensia a fost depusă în puț de 200-ecql. Microplăcile au fost incubate la 37 CTC Sub 5% CO2 timp de 24 h (Incubator CO2, VWR Scientific, SUA) (Giono-Cerezo și colab., 1994).
preparate bacteriene fără celule
cinci colonii din fiecare placă de agar din sânge au fost inoculate în 3 mL de mediu Craig (0,4% extract de drojdie, 3% casaminoacizi, 0,05% K2HPO4). Acestea au fost incubate timp de 24 de ore la 37 CTC, iar densitatea optică a culturii bacteriene utilizate a fost de 0,25 la 600 nm. Preparatele fără celule s-au realizat prin centrifugarea culturilor la 14.000 g timp de 10 min la 4 CTC, urmată de filtrarea supernatantului printr-un filtru cu membrană (dimensiunea porilor 0,45 pm, Sartorius Minisart NML). Supernatanții fără celule au fost depozitați la -20 CTC. un total de 66 de preparate bacteriene fără celule au fost obținute în acest fel; controlul pozitiv (E. coli O157:H7) și controlul negativ (E. coli K12) au fost obținute și în același mod (Giono-Cerezo și colab., 1994).
testul citotoxic și determinarea LD50
filtratul fără celule (20 ecql) a fost inoculat în godeuri conținând celule și mediul de creștere respectiv fără antibiotice. Celulele inoculate au fost incubate timp de 96 ore la 37 C cu 5% CO2 și observate la fiecare 24 ore la microscopul inversat. Efectul citotoxic era de așteptat să apară ca rotunjire și contracție a celulelor cu granulație groasă și, în final, distrugerea progresivă și ireversibilă a monostratului. Toate testele au fost efectuate în dublu exemplar; au fost efectuate și controale de viabilitate cu mem și Craig medium (Giono-Cerezo și colab., 1994).
LD50 a fost determinat la tulpinile Aeromonas detectate ca fiind pozitive pentru a provoca leziuni citotoxice în celulele Vero. A fost preparată o microplacă standard cu 96 de puțuri cu celule Vero, așa cum este indicat în 2.6, dar mediul a fost schimbat la 100 unqql de MEM cu 1% BFS. Acest preparat a fost expus la 100 ecql de preparat bacterian fără celule, iar diluțiile seriale s-au făcut pe întregul rând de plăci. După 24 de ore de incubare la 37 C cu 5% CO2, s-a determinat LD50, la microscopul inversat. LD50 a fost atribuit puțului în care 50% din celulele Vero au fost deteriorate și 50% ne-deteriorate (Marques și colab., 1986).
testul de neutralizare a blocadei și toxinei
testul de neutralizare a toxinei a fost efectuat la tulpinile care au indus leziuni citotoxice în celulele Vero, deoarece această afectare indică Stx. Pentru acest test, a fost preparată o microplacă cu celulă Vero crescută la o confluență de 90-100% cu LD50 din fiecare preparat bacterian fără celule. Pentru a efectua testul de neutralizare pentru a arăta deteriorarea celulară produsă ca urmare a acțiunii Stx, s-au utilizat doi anticorpi monoclonali (Universidad Nacional Autifictoma de M Incksico) obținuți din E. coli O157:H7.
pentru fiecare Ab s-a efectuat o cuantificare a proteinei Bradford conform instrucțiunilor producătorului (Biorad), cu un rezultat de 78,2 și respectiv 74,8 hectolitri / centicli de anti-Stx1 și anti-Stx2 A. S-a lucrat AB concentrat și s-a obținut o diluție dublă A Ab. Apoi, s-a incubat 10 ILV de Ab (anti-STX1 sau anti-STX2) cu 190 ILV de supernatant fără celule la o concentrație de LD50 timp de 1 h la 37 ILV C. ulterior, 200 ILV din acesta din urmă a fost inoculat în celule Vero la 90% din confluență și incubat timp de 24 h la 37 ILV C cu 5% CO2 (Marques și colab., 1986).
prelevarea OMVs și extragerea ADN-ului din omvs
veziculele membranei exterioare au fost obținute de la Aeromonas hydrophila F-0050. Protocolul a fost efectuat așa cum a fost descris anterior de Guerrero-Mandujano și colab. (2015a).
ADN-ul OMV-urilor a fost obținut prin intermediul matricei InstaGene (BioRad XV, Mexic) conform instrucțiunilor furnizate de producător. Apoi, ADN-ul OMVs a fost purificat cu tehnica de extracție a ADN-ului fenol-cloroform (Guerrero-Mandujano și colab., 2015b).
rezultate
amplificări PCR ale genei stx1 și stx2
screeningul reacției în lanț a polimerazei la 66 de tulpini clinice Aeromonas a arătat că 22/66 (33,3%) tulpini conțineau gena stx1, 42/66 (63,6%) tulpini conțineau ambele gene, nicio tulpină nu conținea doar gena stx2, iar 2/66 (3%) tulpini erau negative pentru ambele gene.
secvențierea ADN
analiza BLASTn a arătat o similitudine de 79 până la 99% și o valoare așteptată de 3e-16/2e-97 între genele stx-1 / stx-2 ale E. coli O157:H7 și amplicon de la Aeromonas spp., tulpini.
testul citotoxic și determinarea LD50
testul de citotoxicitate efectuat în culturi de celule Vero a arătat că 17/66 (25,7%) preparate bacteriene fără celule au provocat leziuni citotoxice, sugerând producerea unui STX activ (Figura 1), evidențiat prin afectarea caracteristică cauzată de Stx.
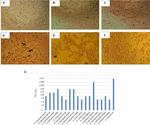
figura 1. Testul de citotoxicitate și determinarea LD50 efectuate în culturi de celule Vero. (A) cultură de celule Vero cu mediu esențial minim (test de viabilitate). (B) cultură celulară Vero cu mediu Craig (test de viabilitate). (C) control negativ cu E. coli K12. (D) control pozitiv cu E. coli O157: H7, se prezintă leziuni citotoxice (săgeți) prin distrugerea monostratului celular și a efectului „dantelă veche”. (E) deteriorarea citotoxică a tulpinii A. hydrophila F-0050. (F) leziuni citotoxice ale tulpinii A. caviae 421423. (G) reprezentarea grafică a titrului LD50 al tuturor tulpinilor.
rezultatele pentru determinarea titrului LD50 au fost următoarele: 6/17 (35,2%) preparate bacteriene fără celule au prezentat un titru de 1:16; 5/17 (29,4%) preparate bacteriene fără celule au reprezentat un titru de 1:8; 3/17 (17,6%) preparate bacteriene fără celule au avut un titru de 1:64; 2/17 (11,7%) preparate bacteriene fără celule cu un titru de 1:32; și 1/17 (5,8%) preparate bacteriene fără celule cu un titru de 1:256 (figura 1g).
neutralizarea toxinei
aplicarea anti-Stx1 Ab în 11/17 (64.7%) tulpini deteriorarea celulelor din supernatant a fost complet inhibată la concentrația de 39,1 hectolitri/centicli Ab; în 4/17 (23,5%) preparate bacteriene fără celule, s-a observat o deteriorare redusă a celulelor la aceeași concentrație; iar în 2/17 (11,7%) preparate bacteriene fără celule, afectarea celulelor a fost complet inhibată la o concentrație de 78,2 centicli/centicli. Utilizarea Ab anti-STX2 a arătat că în preparatele bacteriene fără celule 9/17 (52,9%), deteriorarea celulară a fost inhibată total la 37,4 hectog/xktl, iar preparatele bacteriene fără celule 6/17 (35,2%) au prezentat leziuni celulare reduse la aceeași concentrație; și în 2/17 (11.7%) preparate bacteriene fără celule, leziunea celulară a fost complet inhibată cu o concentrație de Ab de 74,8 hectolitri/centicli (figurile 2 și 3).

figura 2. Inhibarea efectului citotoxic indus în cultura celulelor Vero prin preparate bacteriene fără celule ale Aeromonas spp. tulpini care poartă gena stx1 sau stx2.
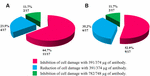
figura 3. Procentul de tulpini care au arătat inhibarea sau reducerea leziunilor celulare. (A) neutralizarea cu anti-Stx1 Ab. (B) neutralizarea cu anti-Stx2 Ab.
Stx1 amplificări PCR ale genei de la OMVs
reacția în lanț a polimerazei ADN-ului OMVs de A. hydrophila F-0050 a relevat că OMV-urile conțineau gen stx1; prin urmare, OMV-urile ar putea fi un vehicul potențial pentru transferul genelor de virulență orizontală (Figura 4).
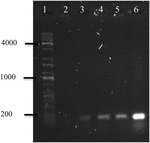
figura 4. Electroferograma amplificării genei stx1 din ADN-ul OMVs. (1) scara universală Kapa, (2) control negativ, (3) OMV-uri ale A. hydrophila F-0050, (4) A. hydrophila F-0050, (5) OMV-uri ale E. coli O157:H7 și (6) E. coli O157:H7.
discuție
genul Aeromonas, în calitate de producător de Stx, ar putea fi un agent patogen emergent care provoacă diaree în principal la pacienții pediatri (hernia Xvndez-Cortez și colab., 2011; Figueras și Baez-Hidalgo, 2014). Cu toate acestea, acest gen a devenit mai relevant în domeniul medical, deoarece este un agent patogen care provoacă HUS (San Joaquents și Pickett, 1988; Bogdanovi și colab., 1991; Robson și colab., 1992; Fang și colab., 1999; Monforte-Cirac și colab., 2010).
în acest studiu, am constatat, prin amplificarea PCR a genelor stx1 și stx2, că 22/66 (33.3%) din tulpinile aeromonad conțineau gena stx1, 42/66 (63,6%) tulpini conțineau ambele gene și nu existau tulpini care să conțină stx2 singur. Acest lucru ne poate determina să sugerăm că această genă este distribuită pe scară largă în tulpinile Aeromonas izolate de la pacienții pediatrici și că acești pacienți pot fi expuși riscului de a dezvolta HUS.
există un singur raport anterior în care genele stx au fost studiate în tulpini Aeromonas izolate din diferite spitale din Spania; rezultatele obținute au fost că 19/80 (23,7%) tulpini au avut gena stx1 și doar 1/80 (1.25%) tulpina a fost pozitivă pentru ambele gene (Alperi și Figueras, 2010). Aceste rezultate transmit că există o distribuție mai mare a genei în tulpinile mexicane; cu toate acestea, ar trebui să luăm în considerare faptul că, în Spania, genul Aeromonas este un agent patogen gastro-intestinal cunoscut izolat în mod obișnuit la pacienții cu profil gastro-intestinal, prin urmare, se acordă un tratament adecvat pentru a confrunta acest gen.
în Mexic, acest gen nu este inclus în lista agenților patogeni care provoacă diaree și nu este izolat în mod obișnuit; ca urmare, este dificil să se acorde pacienților un tratament și o bună calitate a vieții, în plus, nu există statistici despre prevalența acestuia. În plus, genul devine mai relevant datorită condițiilor socio-economice ale populației mexicane, care includ lipsa apei; acest lucru facilitează transmiterea acestuia și crește posibilitatea ca HUS să devină o problemă de sănătate publică.
s-a efectuat secvențierea ampliconilor și s-a efectuat o căutare blastică, care a arătat o similitudine de 79-99% și o valoare a speranței de 3e-16/2e-97 între genele stx1 / stx2 în comparație cu E. coli O157:H7.
LD50 a fost determinat pentru a evalua deteriorarea citotoxică în cultura de celule Vero; cu acest parametru și pe baza Marques și colab. (1986), tulpinile pot fi grupate în producție joasă (2-101-6-102), moderată (103-104) și înaltă (105-108) (figura 1g). Marques și colab. (1986) au efectuat un studiu în care au făcut un test similar cu cel al prezentului studiu, dar cu tulpini diferite de STEC, au obținut că 262/400 (63%) tulpini au fost grupate ca producători de Stx scăzute, iar 48% au produs leziuni citotoxice; cu toate acestea, la 40% din aceste tulpini, afectarea citotoxică a fost inhibată cu anticorpi anti-Stx.
în studiul de față, 25,7% din preparatele fără bacterii au provocat leziuni citotoxice caracteristice Stx în celulele Vero, sugerând producerea de STX activ, toate tulpinile Aeromonas au fost grupate ca producători scăzuți de Stx; cu toate acestea, la 50-70% din supernatanții fără celule, deteriorarea celulară a fost inhibată, iar la 20-30% din supernatanții fără celule deteriorarea celulară a fost redusă (Figura 3). Supernatanții fără celule în care deteriorarea celulară a fost redusă acest lucru ar fi putut fi din cauza a două variante ale toxinei prezente în supernatant, în consecință, deoarece acestea sunt diferite imunologic, Stx nu a putut fi inhibat total și deteriorarea celulară a rămas (Marques și colab., 1986).
două studii anterioare (Haque și colab., 1996; Alperi și Figueras, 2010) au obținut 10,2% și, respectiv, 10,53% din tulpinile Aeromonas producătoare de Stx1. Motivul pentru un procent mai mare de tulpini Aeromonas care produc STX activ s-ar putea datora disponibilității ridicate a bacteriofagului Stx în interiorul culturii, deoarece unele tulpini STEC purtătoare ale bacteriofagului Stx au fost izolate din apele uzate urbane din stațiile de epurare, apele uzate din abatoare și scaunele de bovine (Garcia-Aljaro și colab., 2004, 2009). În mod similar, studiile de transducție au fost efectuate in vivo cu fagii Stx din E. coli, care pot infecta bacteriile microbiotei intestinale, dând caracteristica toxigenică tulpinilor care nu au fost infectate înainte (Acheson și colab., 1998; Schmidt și colab., 1999; Gamage și colab., 2003). Același lucru s-ar putea întâmpla și cu genul Aeromonas atunci când induce un profil gastro-intestinal, urmat de faptul că genul Aeromonas are capacitatea de a capta și integra factori de virulență în genomul său, iar unul dintre aceștia este gena care codifică Stx.
restul tulpinilor au provocat leziuni citotonice în celulă, sugerând posibil producerea de toxine diferite, altele decât Stx, deoarece Aeromonas este un gen capabil să producă două enterotoxine citotonice, termostabile (AST) și termolabile (ALT) (Figueras și Baez-Hidalgo, 2014), care pot provoca leziuni citotonice în celulele Vero; o altă posibilitate este ca tulpinile Aeromonas să aibă mai mult de un bacteriofag inserat în genomul lor, deoarece s-a demonstrat că tulpinile STEC cu dublă lizogenie sunt capabile să regleze bacteriofagii pentru a inhiba capacitatea inducției ciclului litic, ceea ce duce la o scădere a producției de Stx, dar fără a pierde gena (Garcia Oqusta-Aljaro și colab., 2004; Imamovic și Muniesa, 2011). Prin urmare, este necesar să se stabilească câte bacteriofagi conțin tulpinile Aeromonas, inclusiv în studiul de față, pentru a putea corela prezența bacteriofagilor Stx și cantitatea produsă de Stx.
pe de altă parte, prezența bacteriofagilor Stx în Aeromonas inductibil reprezintă un mecanism de transfer orizontal al genei stx, dar nu este singurul. În studii mai recente, s-a stabilit că Aeromonas sunt capabili să producă OMV-uri (Guerrero-Mandujano și colab., 2015a) și aceste OMV-uri sunt capabile să transporte ADN integrat (Guerrero-Mandujano și colab., 2015b). În studiul de față, am amplificat gena stx1 din ADN-ul extras din OMV-urile unei tulpini A. hydrophila de origine clinică, care a indus leziuni citotoxice în celulele Vero, iar această deteriorare a fost inhibată cu anticorpi anti-Stx. Acest lucru indică faptul că bacteriofagul Stx este mecanismul de transport al genei stx; în plus, OMV-urile și sistemul de Transport recent numit Tip 0 sunt capabile să răspândească gena stx interspecii sau intraspecii. Cu toate acestea, este necesar să se confirme dacă gena conținută în OMVs este completă. Rezultatele obținute în acest studiu susțin ipoteza că gena stx este un alt factor de virulență presupus al Aeromonas care ar putea fi transferat prin OMVs. Ar putea reprezenta un alt mecanism pentru transportul orizontal al genei stx către alte tulpini Aeromonas și/sau alte genuri bacteriene.
din acest motiv, acest gen ar trebui inclus ca posibil agent cauzal al gastroenteritei atunci când se încearcă identificarea agenților cauzali și ar trebui raportat ca parte a procedurilor standard de supraveghere a sănătății.
contribuțiile autorului
IP-M și AG-m au efectuat experimentele, iar MR-R a efectuat analizele bioinformatice și a elaborat manuscrisul; CH-C a proiectat grundul; VB-G și JM-l au comentat și revizuit critic manuscrisul; GC-e a conceput studiul, a participat la proiectarea și coordonarea acestuia, a evaluat datele și a elaborat manuscrisul. Toți autorii au citit și aprobat manuscrisul final. Dorim să-i mulțumim Sofiei Marteli Mulia pentru corectarea amabilă a stilului manuscrisului.
de Finanțare
GC-E și VB-G a primit sprijin din Estímulos al Desempeño ro Investigación și Comisión y Fomento de Actividades Académicas (Instituto Politecnico Nacional) și Sistema Nacional de Investigadores (SNI, CONACyT). Acest studiu a fost finanțat de Secretariatul de cercetare și postuniversitar al Institutului Politehnic Național (SIP 20160609). SIP-IPN nu a fost implicat în elaborarea concepției studiului, colectarea, analiza și interpretarea datelor, în redactarea raportului și nici în decizia de transmitere a lucrării spre publicare. IP – M și AG-m au deținut o bursă de la CONACyT și BEIFI.
Declarație privind conflictul de interese
autorii declară că cercetarea a fost realizată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.
mulțumiri
mulțumim Dr.Patricia Arzate Barbosa pentru furnizarea de tulpini izolate și Dr. Armando Navarro pentru furnizarea de anticorpi monoclonali.
abrevieri
Ab, anticorp; Shu, sindrom hemolitic uremic; INP, Instituto Nacional de Pediatria Mexic; LD50, doza letală mediană; OMVs, Outer membrane vesicles; PCR, Polymerase chain reaction; STEC, Shiga toxin-producing E. coli; Stx, Shiga-like toxin; TTP, Thrombotic thrombocytopenic purpura.
Acheson, D. W., Reidl, J., Zhang, X., Keusch, G. T., Mekalanos, J. J., and Waldor, M. K. (1998). In vivo transduction with shiga toxin 1-encoding phage. Infect. Immun. 66, 4496–4498.
Google Scholar
Alperi, A., and Figueras, M. J. (2010). Izolatele umane ale Aeromonas posedă genele de toxină shiga sunt (stx1 și stx2) foarte asemănătoare cu variantele genei virulente de punte ale Escherichia coli. Clin. Microbiol. Infecta. 16, 1563-1567. doi: 10.1111 / j. 1469-0691.2010.03203.x
CrossRef Full Text/Google Scholar
Bogdanovic, R., Irakobelji, M., Markovic, M., Nikolic, V., Ognjanovi, M., Sarjanovi, L., și colab. (1991). Sindromul hemolitic-uremic asociat cu enterocolita Aeromonas hydrophila. Pediatru. Nephrol. 5, 293-295. doi: 10.1007
CrossRef Full Text | Google Scholar
Castro-Escarpulli, G., Aguilera-Arreola, M. G., Giono-Cerezo, S., hernia, F. L. și colab. (2002). Genul Aeromonas > un agent patogen important în Mexic? Enf. Infec. Mike. 22, 206–216.
Google Scholar
Castro-Escarpulli, G., Figueras, M. J., Aguilera-Arreola, M. G., Soler, L., Fern Inktivndez-rend Inktivn, E., Aparicio, G. O. și colab. (2003). Caracterizarea Aeromonas spp. izolat din pește congelat destinat consumului uman în Mexic. Int. J. Microbiol Alimentar. 84, 41–49. doi: 10.1016/S0168-1605(02)00393-8
CrossRef Full Text/Google Scholar
Fang, J. S., Chen, J. B., Chen, W. J., și Hsu, K. T. (1999). Sindromul hemolitic-ureemic la un bărbat adult cu enterocolită Aeromonas hydrophila. Nephrol. Formați. Transplant. 14, 439–440. doi: 10.1093/ndt/14.2.439
CrossRef Full Text | Google Scholar
Figueras, M. J. și Baez-Hidalgo, R. (2014). „Aeromonas”, în Enciclopedia microbiologiei alimentare, eds C. A. Batt și M. L. Tortorello (Cambridge, MA: Academic Press), 24-30.
Gamage, S. D., Strasser, J. E., Chalk, C. L. și Weiss, A. A. (2003). Escherichia coli nepatogenă poate contribui la producerea toxinei shiga. Infecta. Immun. 71, 3107–3115. doi: 10.1128 / IAI.71.6.3107-3115.2003
CrossRef Full Text/Google Scholar
Garcia Oqua-Aljaro, C., Muniesa, M., Jofre, J. și Blanch, A. R. (2004). Prevalența genei stx2 în populațiile coliforme din mediile acvatice. Appl. Environ. Microbiol. 70, 3535–3540. doi: 10.1128 / AEM.70.6.3535-3540.2004
CrossRef Full Text/Google Scholar
Garcia Oqua-Aljaro, C., Muniesa, M., Jofre, J. și Blanch, A. R. (2009). Diversitatea genotipică și fenotipică în rândul bacteriofagilor induși, purtători de stx2 din tulpini de Escherichia coli de mediu. Appl. Environ. Microbiol. 75, 329–336. doi: 10.1128 / AEM.01367-08
CrossRef Full Text/Google Scholar
Giono-Cerezo, S., Rodr Inktsguez-Inktsngeles, M. G., Rodr Inktsguez-Cadena, M. J., și Valdespino-G Inktsquez, J. L. (1994). Identificarea enterotoxinelor și citotoxinelor Escherichia coli prin cultură de celule vero și hibridizare în fază solidă (Colony blot). Rev. Latinoam. Microbiol. 36, 231–241.
Google Scholar
Guerrero-Mandujano, A., L Unktifpez-Villegas, E. O., Longa-Brise Unktifo, A., și Castro-Escarpulli, G. (2015a). Producția de vezicule cu membrană exterioară într-o tulpină Clinică de Aeromonas hydrophila. Ce Microbiol. 1, 113–117.
Google Scholar
Guerrero-Mandujano, A., Palma-Mart, I., și Castro-Escarpulli, G. (2015b). Transportul ADN – ului prin veziculele membranei exterioare ale Aeromonas hydrophila. Ce Microbiol. 2, 354–357.
Google Scholar
Haque, Q. M., Sugiyama, A., Iwade, Y., Midorikawa, Y. și Yamauchi, T. (1996). Izolate diareice și de mediu ale Aeromonas spp. produceți o toxină similară cu toxina asemănătoare shiga 1. Curr. Microbiol. 32, 239–245. doi: 10.1007/s002849900043
CrossRef Full Text | Google Scholar
hernia-Cortez, C., Aguilera-Arreola, M. G., Ch-Octavez-m, Y., Arzate-Barbosa, P., Lara-Hernandez, A. și Castro-escarpulli, G. (2011). Identificarea genetică a tulpinilor de Aeromonas spp. izolat la Institutul Național de Pediatrie. Rev. Enfer. Infecc. Pediatrie. 24, 157–165.
Google Scholar
hernia-Cortez, C., M-Tenorio, A., Aguilera-Arreola, M. G., și Castro-Escarpulli, G. (2013). Proiectarea și standardizarea a patru reacții în lanț multiplex polimerazei pentru a detecta bacteriile care cauzează boli gastro-intestinale. Pe. J. Microbiol. Rezoluția 7, 2673-2681. doi: 10.5897 / AJMR2013.5452
CrossRef Full Text/Google Scholar
Imamovic, L., și Muniesa, M. (2011). Cuantificarea și evaluarea infecțiozității bacteriofagilor care codifică toxina shiga în carnea de vită și salată. Appl. Environ. Microbiol. 77, 3536–3540. doi: 10.1128 / AEM.02703-10
CrossRef Full Text/Google Scholar
Marques, L. R. M., Moore, M. A., Wells, J. G., Wachsmuth, I. K. și O ‘ Brien, A. D. (1986). Producția de toxină asemănătoare shiga de către Escherichia coli. J. Infecta. Dis. 154, 338–341. doi: 10.1093 / infdis / 154.2.338
CrossRef Full Text/Google Scholar
Mauro, S. A. și Koudelka, G. B. (2011). Toxina Shiga: Expresie, distribuție și rolul său în mediu. Toxine 3, 608-625. doi: 10.3390/toxins3060608
CrossRef Full Text | Google Scholar
Monforte-Cirac, ml, Palacian-Ruiz, mp, Aisa-Iriarte, ml., și Espuelas-Monge, M. (2010). Sindromul hemolitic uremic de către Aeromonas: despre un caz clinic. Rev. Clin. Spirit. 210, 206–207. doi: 10.1016 / j. cer.2009.08.002
CrossRef Full Text/Google Scholar
Robson, W. L. M., Leung, A. K. C., și Trevenen, C. L. (1992). Sindromul hemolitic-uremic asociat cu enterocolita Aeromonas hydrophila. Pediatrie. Nephrol. 6, 221–222. doi: 10.1007
CrossRef Full Text / Google Scholar
San Joaquin, V. H. și Pickett, D. A. (1988). Aeromonas-gastroenterită asociată la copii. Pediatru. Infecta. Dis. J. 7, 53-57. doi: 10.1097 / 00006454-198801000-00013
CrossRef Full Text/Google Scholar
Schmidt, H., Bielaszewska, M. și Karch, H. (1999). Transducția izolatelor enterice de Escherichia coli cu un derivat al bacteriofagului care codifică toxina shiga 2 f3538 izolat din Escherichia coli O157:H7. Appl. Environ. Microbiol. 65, 3855–3861.
Google Scholar