Dacă ați studiat vreodată un tabel periodic al elementelor (vezi mai jos), probabil că sunteți deja conștienți de faptul că acest tabel dezvăluie multe despre proprietățile chimice ale atomilor care alcătuiesc lumea noastră.dar s — ar putea să nu vă dați seama că fiecare pătrat din tabelul periodic reprezintă de fapt o familie de izotopi-atomi care au același nume și proprietăți chimice, dar au mase diferite.
pentru a înțelege ce sunt izotopii și cum îi putem folosi, trebuie să aruncăm o privire mai atentă asupra interiorului unui atom.

blocuri de materie
un atom este compus dintr-un nucleu incredibil de dens (numit nucleu) de protoni și neutroni, înconjurat de un nor difuz de electroni.
vă puteți gândi la protoni și neutroni ca la același tip de particule cu o diferență cheie: protonii sunt încărcați pozitiv, în timp ce neutronii nu au sarcină. Aceasta înseamnă că protonii pot „simți” câmpuri electrice sau magnetice, în timp ce neutronii nu pot.electronii, care sunt mult mai ușori decât protonii sau neutronii, poartă aceeași magnitudine de sarcină ca un proton, dar cu semnul opus, ceea ce înseamnă că fiecare atom care are un număr egal de protoni și electroni este neutru din punct de vedere electric.electronii sunt cei care determină comportamentul chimic al unui anumit element.

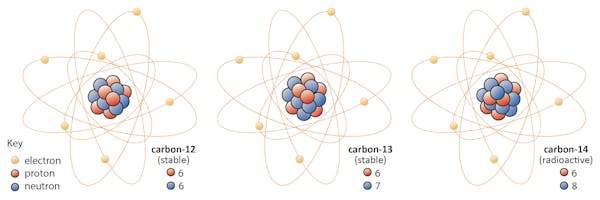
izotopii unui element au același număr de protoni, dar au un număr diferit de neutroni. Să folosim carbonul ca exemplu.
există trei izotopi de carbon găsiți în natură – carbon-12, carbon-13 și carbon-14. Toți trei au șase protoni, dar numărul lor de neutroni – 6, 7 și, respectiv, 8 – diferă. Aceasta înseamnă că toți cei trei izotopi au mase atomice diferite (carbon-14 fiind cel mai greu), dar au același număr atomic (Z=6).din punct de vedere chimic, toate cele trei sunt indistinguizabile, deoarece numărul de electroni din fiecare dintre acești trei izotopi este același.izotopii diferiți ai aceluiași element sunt identici din punct de vedere chimic. Dar unii izotopi au capacitatea de a eluda această regulă transformându-se într-un alt element în întregime.
marș spre stabilitate
această capacitate de transformare unii izotopi au are de a face cu faptul că nu toți izotopii sunt stabile, și este ceea ce a condus Frederick Soddy la descoperirea lui Premiul Nobel-câștigătoare a izotopilor în 1913.
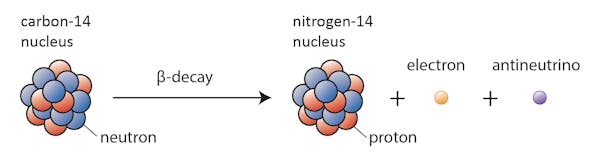
unii izotopi – cum ar fi carbonul-12 – vor continua fericit să existe ca carbon dacă nu se întâmplă ceva extraordinar. Alții-carbon-14, să zicem-se vor descompune la un moment dat într-un izotop stabil în apropiere.
în acest caz, unul dintre neutronii din carbon-14 se transformă într-un proton, formând azot-14. În timpul acestui proces, cunoscut sub numele de dezintegrare beta, nucleul emite radiații sub forma unui electron și a unui antineutrino.
există mulți factori care pot determina descompunerea unui nucleu. Unul dintre cele mai importante este raportul dintre protoni și neutroni pe care îl are un anumit nucleu. Dacă un nucleu are prea mulți neutroni (definiția „prea mulți” depinde de cât de greu este nucleul), există șansa ca acesta să se descompună spre stabilitate.
același lucru este valabil dacă un nucleu are prea mulți protoni. Acesta este unul dintre motivele pentru care unii izotopi ai unui element dat sunt radioactivi, în timp ce alții nu sunt.
din pântecele stelelor
până acum, s-ar putea să vă întrebați cum au fost creați toți acești izotopi în primul rând. După cum se dovedește, această întrebare este una complexă, dar dă un adevăr zicalei că suntem cu toții făcuți din praf de stele.
unii dintre izotopii mai ușori s-au format foarte devreme în istoria universului, în timpul Big Bang-ului. Altele rezultă din procese care se întâmplă în interiorul stelelor sau ca urmare a coliziunilor întâmplătoare dintre nucleele extrem de energetice – cunoscute sub numele de raze cosmice – din atmosfera noastră.
izotopii existenți în mod natural sunt produsul final (stabil sau de lungă durată) rezultat dintr-o serie lungă de reacții și dezintegrări nucleare.
în cele mai multe dintre aceste cazuri, nucleele ușoare au trebuit să se ciocnească cu suficientă energie pentru a permite forței puternice – o legătură asemănătoare lipiciului care se formează atunci când protonii și neutronii se apropie suficient de mult pentru a atinge-pentru a depăși forța electromagnetică – care împinge protonii în afară. Dacă forța puternică câștigă, nucleele care se ciocnesc se leagă sau fuzionează pentru a forma un nucleu mai greu.
Soarele nostru este un bun exemplu în acest sens. Una dintre principalele sale surse de energie este o serie de reacții de fuziune și procese de dezintegrare beta care transformă hidrogenul în heliu.

transformarea cunoștințelor în instrumente
de la începutul anilor 1900, când existența izotopilor a fost realizată pentru prima dată, fizicienii și chimiștii nucleari au căutat modalități de a studia modul în care izotopii pot fi formați, cum se descompun și cum i-am putea folosi.după cum se dovedește, natura izotopilor – uniformitatea lor chimică, distinctivitatea lor nucleară – îi face utili pentru o gamă largă de aplicații în domenii la fel de diverse precum medicina, arheologia, agricultura, generarea de energie și mineritul.
dacă ați avut vreodată o scanare PET, ați beneficiat de un produs secundar al dezintegrării radioactive a anumitor izotopi (adesea numiți izotopi medicali). Producem acești izotopi medicali folosind cunoștințele noastre despre modul în care se desfășoară reacțiile nucleare, cu ajutorul reactoarelor nucleare sau a acceleratoarelor numite ciclotroni.
dar am găsit, de asemenea, modalități de a face uz de izotopi radioactivi care apar în mod natural. Datarea cu Carbon, de exemplu, folosește izotopul carbon-14 de lungă durată pentru a determina cât de vechi sunt obiectele.
în condiții normale, carbon-14 este produs în atmosfera noastră prin reacții de raze cosmice cu azot-14. Are un timp de înjumătățire de aproximativ 5.700 de ani, ceea ce înseamnă că jumătate dintr-o cantitate de carbon-14 va fi decăzut în acea perioadă de timp.

în timp ce un organism biologic este în viață, este nevoie de aproximativ un izotop carbon-14 pentru fiecare trilion de izotopi carbon-12 stabili, iar raportul carbon-12 la carbon-14 rămâne aproximativ același în timp ce organismul trăiește. Odată ce moare, noul aport de carbon se oprește.
aceasta înseamnă că raportul dintre carbon-14 și carbon-12 se schimbă în rămășițele acestui organism în timp.
dacă extragem carbon folosind metode chimice dintr-o probă, putem aplica apoi o metodă numită spectrometrie de masă accelerator (AMS) pentru a separa izotopii individuali de carbon în greutate.
AMS folosește faptul că particulele accelerate cu aceeași sarcină, dar mase diferite, urmează căi separate prin câmpuri magnetice. Folosind aceste căi separate, putem determina rapoartele izotopilor cu o precizie incredibilă.
după cum puteți vedea din aceste exemple, aplicăm cunoștințele noastre despre izotopi într-o varietate de moduri. Le producem, le detectăm, le extragem și le studiem cu scopul dublu de a înțelege de ce nucleul atomic se comportă așa cum se comportă și cum îi putem valorifica puterea în beneficiul nostru.