termeni cheie
asigurați-vă că puteți defini și utiliza în context termenii cheie de mai jos.
- catalizatorul Adams
- hidrogenare
note de studiu
reacțiile chimice eterogene au reactanți care sunt în cel puțin două faze diferite (de exemplu, gaz cu un solid), în timp ce reacțiile omogene apar într-o singură fază (de exemplu, gaz cu un alt gaz).
o anumită confuzie poate apărea din descrierea catalizatorului utilizat în reacția dintre alchene și hidrogen. Trei metale—nichel, platină și paladiu—sunt utilizate în mod obișnuit, dar un chimist nu poate plasa pur și simplu o bucată din unul dintre aceste metale într-un amestec de alchenă și hidrogen și să obțină o reacție. Fiecare catalizator metalic trebuie preparat într-un mod special:
- nichelul este de obicei utilizat într-o formă fin divizată numită „Raney nickel.”Se prepară prin reacția unui aliaj Ni – Al cu NaOH.
- paladiul este obținut comercial „susținut” pe o substanță inertă, cum ar fi cărbunele, (Pd/C). Alchena este de obicei dizolvată în etanol atunci când Pd/C este utilizat ca catalizator.
- platina este folosită ca PtO2, catalizatorul lui Adams, deși este de fapt metalul de platină care este catalizatorul. Hidrogenul folosit pentru a adăuga la dubla legătură carbon-carbon reduce, de asemenea, oxidul de platină(IV) la metalul de platină fin divizat. Etanolul sau acidul acetic este utilizat ca solvent pentru alchenă.
alte tipuri de compuși care conțin legături multiple, cum ar fi cetonele, esterii și nitrilii, nu reacționează cu hidrogenul în condițiile utilizate pentru hidrogenarea alchenelor. Exemplele de mai jos arată reducerea unei alchene, dar grupările cetone și nitril prezente rămân intacte și nu sunt reduse.

inelele aromatice nu sunt, de asemenea, reduse în condițiile utilizate pentru reducerea alchenelor, deși aceste inele par să conțină trei legături duble carbon-carbon. După cum veți vedea mai târziu, inelele aromatice nu conțin cu adevărat legături duble și mulți chimiști preferă să reprezinte inelul benzenic ca un hexagon cu un cerc în interiorul acestuia

mai degrabă decât ca un hexagon cu trei legături duble alternante.
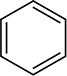
reprezentarea inelului benzenic va fi discutată în continuare în secțiunea 15.2.reacția dintre legăturile duble carbon-carbon și hidrogen oferă o metodă de determinare a numărului de legături duble prezente într-un compus. De exemplu, un mol de ciclohexenă reacționează cu un mol de hidrogen pentru a produce un mol de ciclohexan:

dar un mol de 1,4-ciclohexadienă reacționează cu doi moli de hidrogen pentru a forma un mol de ciclohexan:
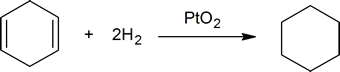
un chimist ar spune că ciclohexena reacționează cu un echivalent de hidrogen, iar 1,4-ciclohexadiena reacționează cu doi echivalenți de hidrogen. Dacă luați o cantitate cunoscută dintr-o hidrocarbură necunoscută, nesaturată și determinați cât de mult hidrogen va absorbi, puteți determina cu ușurință numărul de legături duble prezente în hidrocarbură (a se vedea Întrebarea 2, de mai jos).
adăugarea hidrogenului la o dublă legătură carbon-carbon se numește hidrogenare. Efectul general al unei astfel de adăugiri este eliminarea reductivă a grupului funcțional cu dublă legătură. Regioselectivitatea nu este o problemă, deoarece același grup (un atom de hidrogen) este legat de fiecare dintre carbonii cu dublă legătură. Cea mai simplă sursă de doi atomi de hidrogen este hidrogenul molecular (H2), dar amestecarea alchenelor cu hidrogenul nu are ca rezultat nicio reacție perceptibilă. Deși reacția generală de hidrogenare este exotermă, o energie de activare ridicată o împiedică să aibă loc în condiții normale. Această restricție poate fi eludată prin utilizarea unui catalizator, după cum se arată în diagrama următoare.
un exemplu de reacție de adiție a alchenei este un proces numit hydrogenation.In o reacție de hidrogenare, doi atomi de hidrogen sunt adăugați peste legătura dublă a unei alchene, rezultând un alcan saturat. Hidrogenarea unei legături duble este o reacție favorabilă termodinamic, deoarece formează un produs mai stabil (energie mai mică). Cu alte cuvinte, energia produsului este mai mică decât energia reactantului; astfel este exotermă (căldura este eliberată). Căldura eliberată se numește căldură de hidrogenare, care este un indicator al stabilității unei molecule.


catalizatorii sunt substanțe care modifică viteza (viteza) unei reacții chimice fără a fi consumate sau care apar ca parte a produsului. Catalizatorii acționează prin scăderea energiei de activare a reacțiilor, dar nu modifică energia potențială relativă a reactanților și a produselor. Metalele fin divizate, cum ar fi platina, paladiul și nichelul, sunt printre cei mai utilizați catalizatori de hidrogenare. Hidrogenarea catalitică are loc în cel puțin două etape, așa cum este descris în diagramă. În primul rând, alchena trebuie adsorbită pe suprafața catalizatorului împreună cu o parte din hidrogen. Apoi, doi hidrogeni se deplasează de la suprafața metalică la carbonii dublei legături, iar hidrocarbura saturată rezultată, care este mai slab adsorbită, părăsește suprafața catalizatorului. Natura exactă și calendarul ultimelor evenimente nu sunt bine înțelese.

așa cum se arată în diagrama energetică, hidrogenarea alchenelor este exotermă, iar căldura este eliberată corespunzător cu OQUSTE (verde colorat) din diagramă. Această căldură de reacție poate fi utilizată pentru a evalua stabilitatea termodinamică a alchenelor având un număr diferit de substituenți alchilici pe dubla legătură. De exemplu, următorul tabel listează căldurile de hidrogenare pentru trei alchene C5H10 care dau același produs alcanic (2-metilbutan). Deoarece o căldură mare de reacție indică un reactant cu energie ridicată, aceste călduri sunt invers proporționale cu stabilitatea izomerilor alchenei. Pentru o aproximare aproximativă, vedem că fiecare substituent alchil pe o legătură dublă stabilizează această grupă funcțională cu puțin mai mult de 1 kcal/mol.
| Alkene Isomer | (CH3)2CHCH=CH2 3-methyl-1-butene |
CH2=C(CH3)CH2CH3 2-methyl-1-butene |
(CH3)2C=CHCH3 2-methyl-2-butene |
|---|---|---|---|
| Heat of Reaction ( ΔHº ) |
–30.3 kcal/mole | –28.5 kcal/mole | –26.9 kcal/mole |

Din mecanismul prezentat aici ne-am aștepta ca adăugarea de hidrogen să aibă loc cu syn-stereoselectivitate. Acest lucru este adesea adevărat, dar catalizatorii de hidrogenare pot provoca, de asemenea, izomerizarea dublei legături înainte de adăugarea de hidrogen, caz în care stereoselectivitatea poate fi incertă.

exerciții
- în reacția
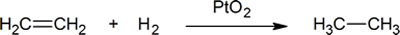
- 0,500 mol de etenă reacționează cu _______ mol de hidrogen. Astfel, un chimist ar putea spune că etena reacționează cu unul _ _ _ _ _ _ _ de hidrogen.
- etena este_______; în timp ce _ _ _ _ _ _ _ este oxidat.
- numărul de oxidare al carbonului în etenă este _______; în etan este _______.
- când 1.000 g dintr-o anumită trigliceridă (grăsime) este tratată cu hidrogen gazos în prezența catalizatorului Adams, se constată că volumul de hidrogen gazos consumat la 99,8 kPa și 25,0 CTC este de 162 mL. Un experiment separat indică faptul că masa molară a grăsimii este de 914 g mol−1. Câte legături duble carbon-carbon conține compusul?
răspunsuri:
-
-
arată răspunsul
-
arată răspunsul
-
arată răspunsul
-
-
Arată Răspunsul
Examples
Question
Predict the products if the following alkenes were reacted with catalytic hydrogen.

Solution

Contributors
- Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
- Prof. Steven Farmer (Universitatea de Stat Sonoma)
- Chimie organică cu un accent biologic de Tim Soderberg (Universitatea din Minnesota, Morris)