Legea lui Boyle
Robert Boyle (1627 – 1691), un chimist englez, este considerat a fi unul dintre fondatorii științei experimentale moderne a chimiei. El a descoperit că dublarea presiunii unui eșantion închis de gaz, păstrând în același timp temperatura constantă, a făcut ca volumul gazului să fie redus la jumătate. Legea lui Boyle afirmă că volumul unei mase date de gaz variază invers cu presiunea atunci când temperatura este menținută constantă. O relație inversă este descrisă în acest fel. Pe măsură ce o variabilă crește în valoare, cealaltă variabilă scade.
fizic, ce se întâmplă? Moleculele de gaz se mișcă și se află la o anumită distanță una de cealaltă. O creștere a presiunii împinge moleculele mai aproape, reducând volumul. Dacă presiunea este scăzută, gazele sunt libere să se deplaseze într-un volum mai mare.

matematic, legea lui Boyle poate fi exprimată prin ecuație:
\
\(k\) este o constantă pentru un anumit eșantion de gaz și depinde numai de masa gazului și de temperatură. Tabelul de mai jos prezintă datele de presiune și volum pentru o cantitate setată de gaz la o temperatură constantă. A treia coloană reprezintă valoarea constantei \(\stânga (k \dreapta)\) pentru aceste date și este întotdeauna egală cu presiunea înmulțită cu volumul. Pe măsură ce una dintre variabile se schimbă, cealaltă se schimbă în așa fel încât produsul \(p \times V\) rămâne întotdeauna același. În acest caz particular, acea constantă este \(500\: \ text{atm} \ cdot \ text{mL}\).
| Pressure \(\left( \text{atm} \right)\) | Volume \(\left( \text{mL} \right)\) | \(P \times V = k\) \(\left( \text{atm} \cdot \text{mL} \right)\) |
|---|---|---|
| 0.5 | 1000 | 500 |
| 0.625 | 800 | 500 |
| 1.0 | 500 | 500 |
| 2.0 | 250 | 500 |
| 5.0 | 100 | 500 |
| 8.0 | 62.5 | 500 |
| 10.0 | 50 | 500 |
un grafic al datelor din tabel în continuare ilustrează natura relației inverse a legii lui Boyle (vezi figura de mai jos). Volumul este reprezentat grafic pe axa \(x\), cu presiunea corespunzătoare pe axa \(y\).
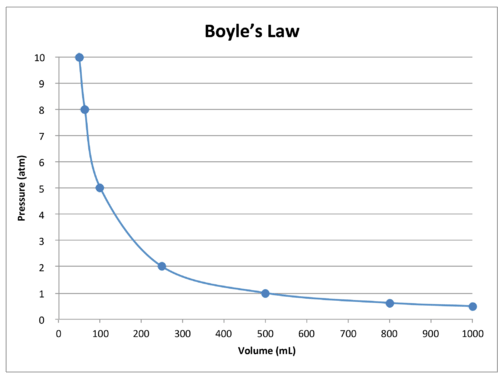
Legea lui Boyle poate fi utilizată pentru a compara condițiile în schimbare pentru un gaz. Folosim \(P_1\) și \(V_1\) pentru a reprezenta presiunea inițială și volumul inițial al unui gaz. După efectuarea unei modificări, \(P_2\) și \(V_2\) reprezintă presiunea și volumul final. Relația matematică a legii lui Boyle devine:
\
această ecuație poate fi utilizată pentru a calcula oricare dintre cele patru cantități dacă celelalte trei sunt cunoscute.
exemplu \(\PageIndex{1}\)
o mostră de oxigen gazos are un volum de \(425 \: \ text{mL}\) când presiunea este egală cu \(387 \: \text{kPa}\). Gazul este permis să se extindă într-un container \(1,75 \: \text{l}\). Calculați Noua presiune a gazului.
soluție
Pasul 1: enumerați cantitățile cunoscute și planificați problema.
cunoscut
- \(P_1 = 387 \: \text{kPa}\)
- \(V_1 = 425\: \ text{mL}\)
- \(V_2 = 1,75\: \ text{l} = 1750\: \ text{mL}\)
necunoscut
- \(p_2=? \: \text{kPa}\)
folosiți Legea lui Boyle pentru a rezolva presiunea necunoscută \(\stânga( P_2 \ dreapta)\). Este important ca cele două volume (\(V_1\) și \(V_2\)) să fie exprimate în aceleași unități, deci \(V_2\) a fost convertit în \(\text{mL}\).
Pasul 2: rezolva.
Mai întâi, rearanjați ecuația algebric pentru a rezolva pentru \(P_2\).
\
acum înlocuiți cantitățile cunoscute în ecuație și rezolvați.
\
Pasul 3: Gândiți-vă la rezultatul dvs.
volumul a crescut ușor de peste 4 ori valoarea inițială și astfel presiunea este scăzută cu aproximativ o pătrime. Presiunea este în \(\text{kPa}\) și valoarea are trei cifre semnificative. Rețineți că orice unități de presiune sau volum pot fi utilizate atât timp cât sunt consecvente pe tot parcursul problemei.