9.5 încălcări ale regulii octetului
obiectiv de învățare
- recunoașteți cele trei tipuri majore de încălcări ale regulii octetului.
la fel de important și util ca regula octetului este în Lipirea chimică, există unele încălcări bine cunoscute. Aceasta nu înseamnă că regula octetului este inutilă—dimpotrivă. Ca și în cazul multor reguli, există excepții sau încălcări.
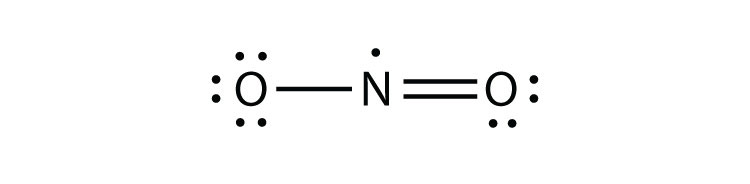
există trei încălcări ale regulii octetului. Ciudat-molecule de electrono moleculă cu un număr impar de electroni în carcasa de valență a unui atom. reprezintă prima încălcare a regulii octetului. Deși sunt puțini, unii compuși stabili au un număr impar de electroni în cochilii lor de valență. Cu un număr impar de electroni, cel puțin un atom din moleculă va trebui să încalce regula octetului. Exemple de molecule stabile de electroni impari sunt NO, NO2 și ClO2. Diagrama punctului de electroni Lewis pentru NO este următoarea:
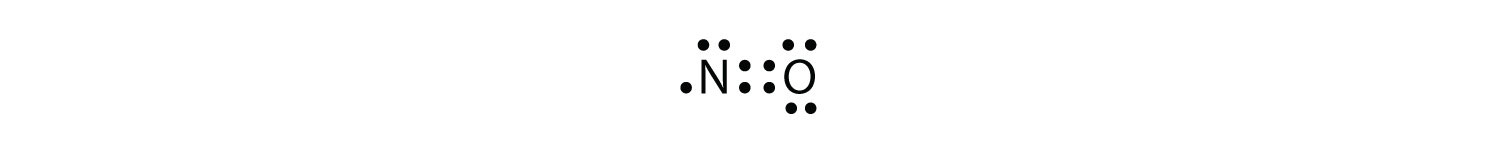
deși atomul de O are un octet de electroni, atomul de N are doar șapte electroni în învelișul său de valență. Deși NO este un compus stabil, este foarte reactiv din punct de vedere chimic, la fel ca majoritatea celorlalți compuși cu electroni impari.
molecule cu deficit de Electrono moleculă cu mai puțin de opt electroni în carcasa de valență a unui atom. reprezintă a doua încălcare a regulii octetului. Acești compuși stabili au mai puțin de opt electroni în jurul unui atom din moleculă. Cele mai frecvente exemple sunt compușii covalenți ai beriliului și borului. De exemplu, beriliul poate forma două legături covalente, rezultând doar patru electroni în învelișul său de valență:
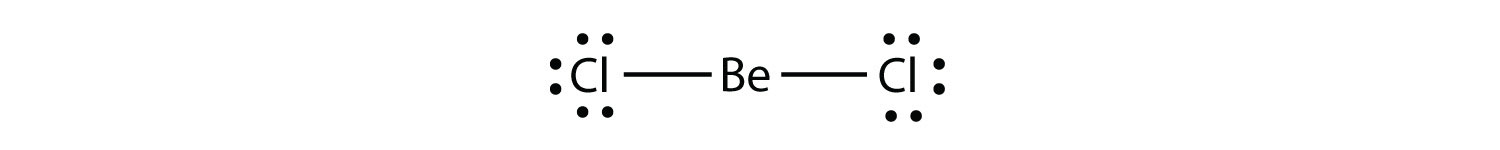
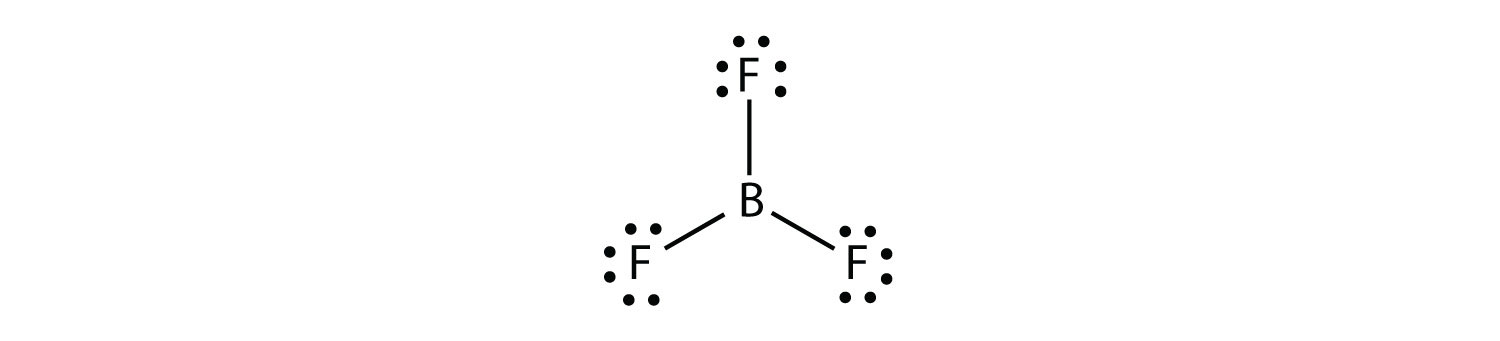
borul produce în mod obișnuit doar trei legături covalente, rezultând doar șase electroni de valență în jurul atomului B. Un exemplu binecunoscut este BF3:
a treia încălcare a regulii octetului se găsește în acei compuși cu mai mult de opt electroni atribuiți învelișului lor de valență. Acestea se numesc molecule de coajă de valență expandatăo moleculă cu mai mult de opt electroni în coaja de valență a unui atom.. Astfel de compuși sunt formați numai de atomi centrali din al treilea rând al tabelului periodic sau dincolo de care au orbitali d goi în cochilii lor de valență care pot participa la legătura covalentă. Un astfel de compus este PF5. Singura Diagramă rezonabilă a punctelor electronice Lewis pentru acest compus are atomul P care face cinci legături covalente:
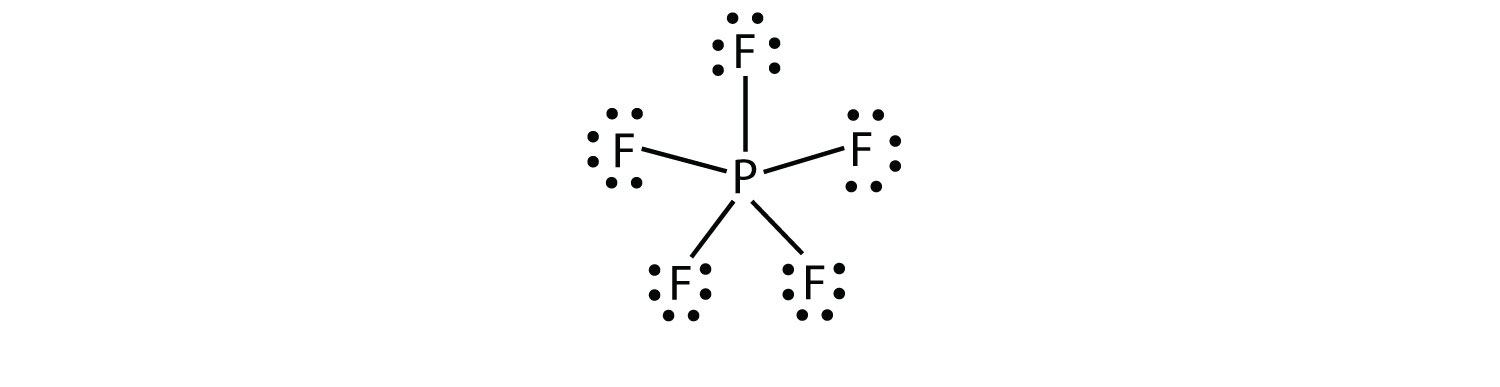
formal, atomul P are 10 electroni în învelișul său de valență.
exemplul 9
identificați fiecare încălcare a regulii octetului desenând o diagramă punct Lewis electron.
- ClO
- SF6
soluție
-
cu un atom Cl și un atom O, această moleculă are 6 + 7 = 13 electroni de valență, deci este o moleculă de electroni impari. O diagramă Lewis electron Dot pentru această moleculă este după cum urmează:

-
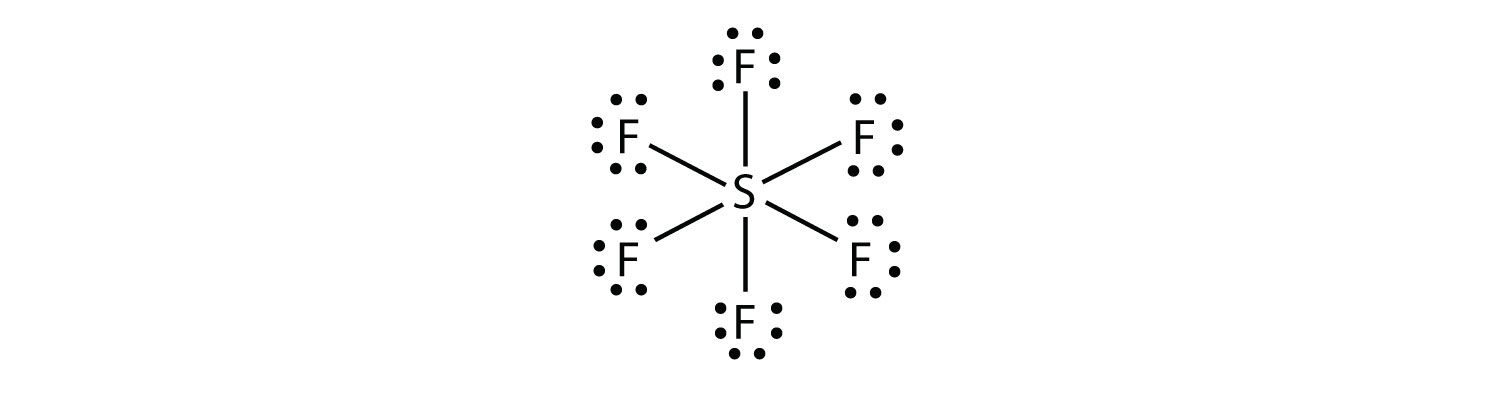
în SF6, atomul central s face șase legături covalente la cei șase atomi de F din jur, deci este o moleculă de coajă de valență extinsă. Diagrama sa Lewis electron Dot este după cum urmează:
Testați-vă
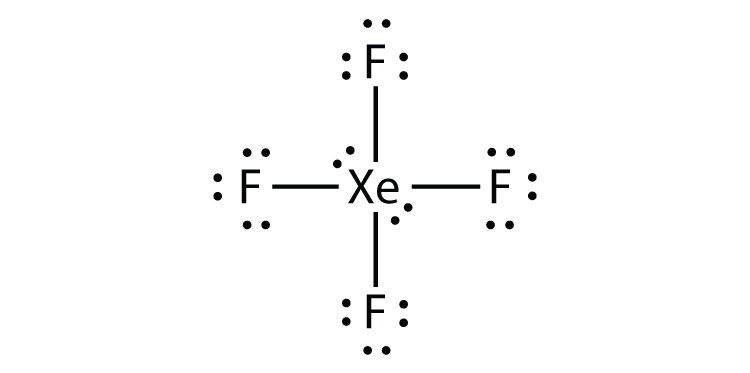
identificați încălcarea regulii octetului din XeF2 desenând o diagramă Lewis electron Dot.
răspuns
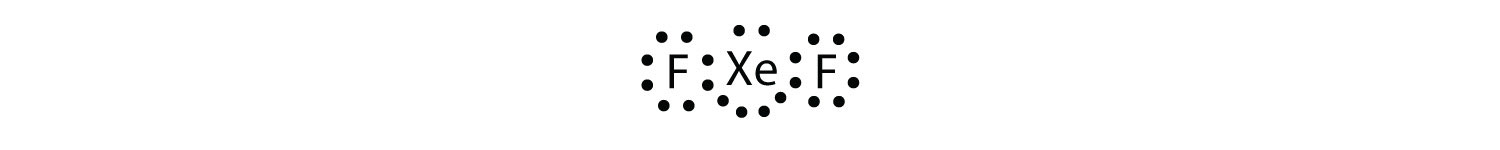
atomul Xe are o coajă de valență extinsă cu mai mult de opt electroni în jurul său.
Key Takeaway
- există trei încălcări ale regulii octetului: molecule de electroni impari, molecule cu deficit de electroni și molecule de coajă de valență extinsă.
exerciții
-
De ce o moleculă de electroni impari nu poate satisface regula octetului?
-
De ce un atom din al doilea rând al tabelului periodic nu poate forma molecule de coajă de valență expandată?
-
desenați o diagramă acceptabilă a punctelor electronice Lewis pentru aceste molecule care încalcă regula octetului.
- NO2
- XeF4
-
desenați o diagramă acceptabilă a punctelor electronice Lewis pentru aceste molecule care încalcă regula octetului.
- BCl3
- ClO2
-
desenați o diagramă acceptabilă a punctelor electronice Lewis pentru aceste molecule care încalcă regula octetului.
- POF3
- ClF3
-
desenați o diagramă acceptabilă a punctelor electronice Lewis pentru aceste molecule care încalcă regula octetului.
- SF4
- BeH2
răspunsuri
-
nu există nici un fel toți electronii pot fi asociat dacă există un număr impar de ei.
-
-
-