a vector-borne disease (specifically a biological transfer rather than mechanical) is one in which transmission of infection in a population (the host population) occurs only via a second population (vectors). Os vectores são geralmente Artrópodes hematófagos (que alimentam o sangue), como mosquitos, varejeiras ou carraças. Existem muitas doenças deste tipo, cuja dinâmica é de grande interesse do ponto de vista do controlo da infecção. A malária, a leishmaniose, a dengue e o vírus do Nilo Ocidental são apenas alguns, que têm actualmente um enorme impacto social nas populações humanas.
odos os anos na região de 225 milhões de pessoas estão infectadas com o parasita da malária e, em 2009, cerca de 781 000 destas doenças resultaram em mortalidade induzida pela doença. A história é semelhante para leishmaniose onde existem cerca de 12 milhões de pessoas no mundo que são pensados para ser infectado, a qualquer momento e cerca de 80.000 pessoas morrem anualmente de forma mais grave, a leishmaniose visceral. Essas doenças são abundantes no mundo em desenvolvimento; uma combinação de habitat ideal para vectores em regiões tropicais e uma falta de ajuda médica levam a endemias em grande escala.as doenças humanas não são a única preocupação; há muitas outras que infectam outras classes de hospedeiros que também são de interesse, particularmente do ponto de vista da preservação de Espécies Ameaçadas.
o curso típico de infecção para transmissão por Vetor, ignorando as especulações de doença, hospedeiro ou vetor, começa com um vetor infectado (um artrópode adulto que alimenta o sangue ou Chupa Artrópodes adultos) tomando uma refeição de sangue de um membro suscetível da população Hospedeira. Uma vez mordido, o hospedeiro tem a chance de ficar infectado com a doença. Nesta fase, se infectado, o hospedeiro é considerado exposto, mas não apresenta efeitos adversos da infecção e não pode transmitir a doença. O tempo depois de se tornar infectado, mas antes de se tornar infeccioso é conhecido como o período de latência. Quando o parasita atinge uma certa fase do seu ciclo reprodutivo, o hospedeiro torna-se infeccioso, após o que, se for mordido, pode transmitir a doença a um vector susceptível através do seu sangue infectado pelo parasita e completar o ciclo de transmissão (mostrado na figura abaixo).
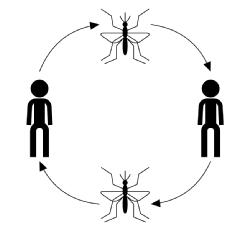
:
- a abundância e a propagação espacial de ambos os hospedeiros e vetores
- demografia
- uma taxa de alimentação de vector ou de desejo de morder
- o sucesso ou falha de transmissão
Normalmente de modelos matemáticos de doenças transmitidas por vetores são baseados em dois população SI(R) modelo apresenta “criss-cross” infecção termos, onde e
são a força de infecção de termos para os anfitriões e vetores, respectivamente,:
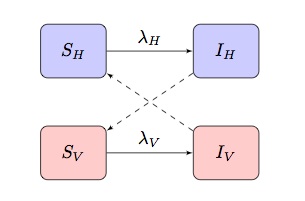
ependente da doença e da população em modelização, esta pode ser adaptada para incorporar outras características mais específicas.
Modelação da Dinâmica de Doenças Transmitidas por Vector
Existem muitos tipos diferentes de modelo matemático para transmitidas por vetores de transmissão da doença; idealmente, estes são procurados para ser mantido matematicamente tratável e tão simples quanto possível, mas mantendo a dinâmica geral do sistema biológico. Sem surpresa, os modelos da literatura variam muito.; do determinístico ao estocástico, endémico (incluindo as taxas de natalidade e de morte) ou epidémico (um surto de duração limitada), incorporando propagação espacial, heterogeneidade espacial, períodos de latência, estrutura etária, aquisição e perda de imunidade, estirpes múltiplas e muitas outras. Mesmo quando se considera apenas uma doença específica, as variações da doença dentro de diferentes populações podem levar a alterações não só na parametrização, mas também na forma como se pode querer adoptar a abordagem de modelização.alguns dos trabalhos de Kat se concentram nas simplificações que são feitas para reduzir a complexidade dos modelos. Este trabalho considera os efeitos do uso de modelos de transmissão “host-only” como o quasi-equilibrium assumption on disease dynamics e também o efeito de omitir o período de latência sobre previsões epidémicas.
Leishmaniose
a ser completado pela Erin
tripanossomíase humana Africana (HAT)
tripanossomíase humana Africana (HAT), mais coloquialmente conhecida como doença do sono, é uma doença mortal que é endémica em grande parte da África subsariana. 70 milhões de pessoas vivem em zonas de risco que cobrem mais de um milhão e meio de quilómetros quadrados. Enquanto a prevalência de CHAPÉU não é tão elevada como a de outras doenças transmitidas por vetores, como malária ou dengue (havia pouco mais de 7000 casos de CHAPÉU, mas de 207 milhões de euros estimados de casos de malária, em 2012), a falta de química, profilaxia, extremamente desagradável (e muitas vezes fatal) tratamento e a falta de substancial pesquisa científica tem agora colocou o CHAPÉU na lista de doenças tropicais negligenciadas.
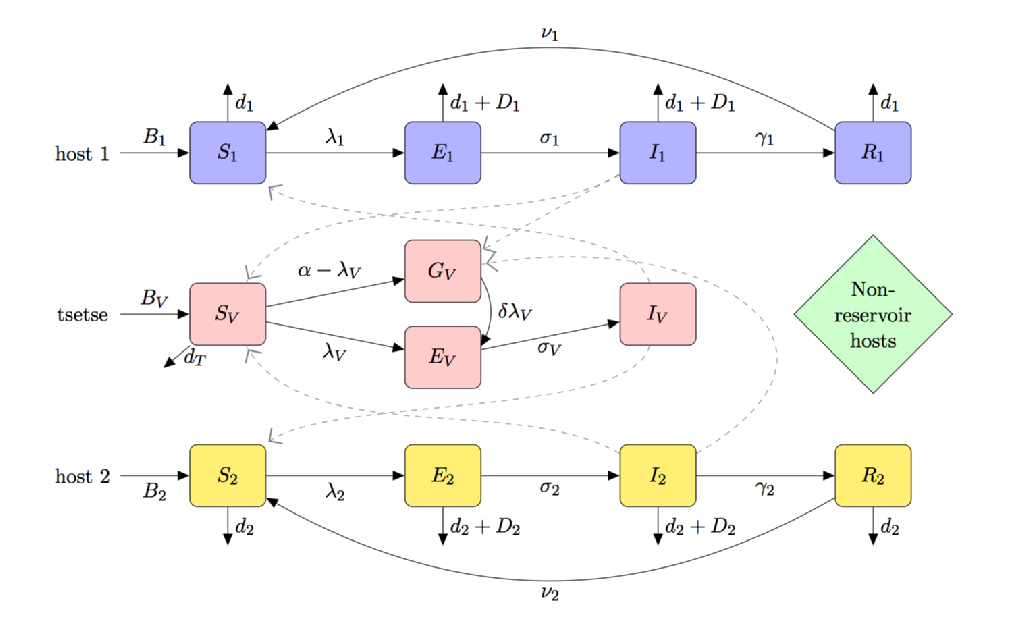
O vector do chapéu é o tsé-tsé; sua necessidade de alimentação sanguínea para prevenir a fome e uma interação vetor-parasita única (causando um “fenômeno de susceptibilidade teneral”) significa que a modelagem do chapéu é distintamente diferente de outras doenças transmitidas por Vetor, como a malária.
a figura abaixo é uma caricatura compartimental de um modelo para chapéu que inclui:
- (parcial) teneral voar susceptibilidade
- multi-host espécies (incluindo reservatório e não reservatório de hosts)
- tsé-tsé preferência alimentar
- fome de jejum tsé-tsé
febre catarral ovina (BTV)
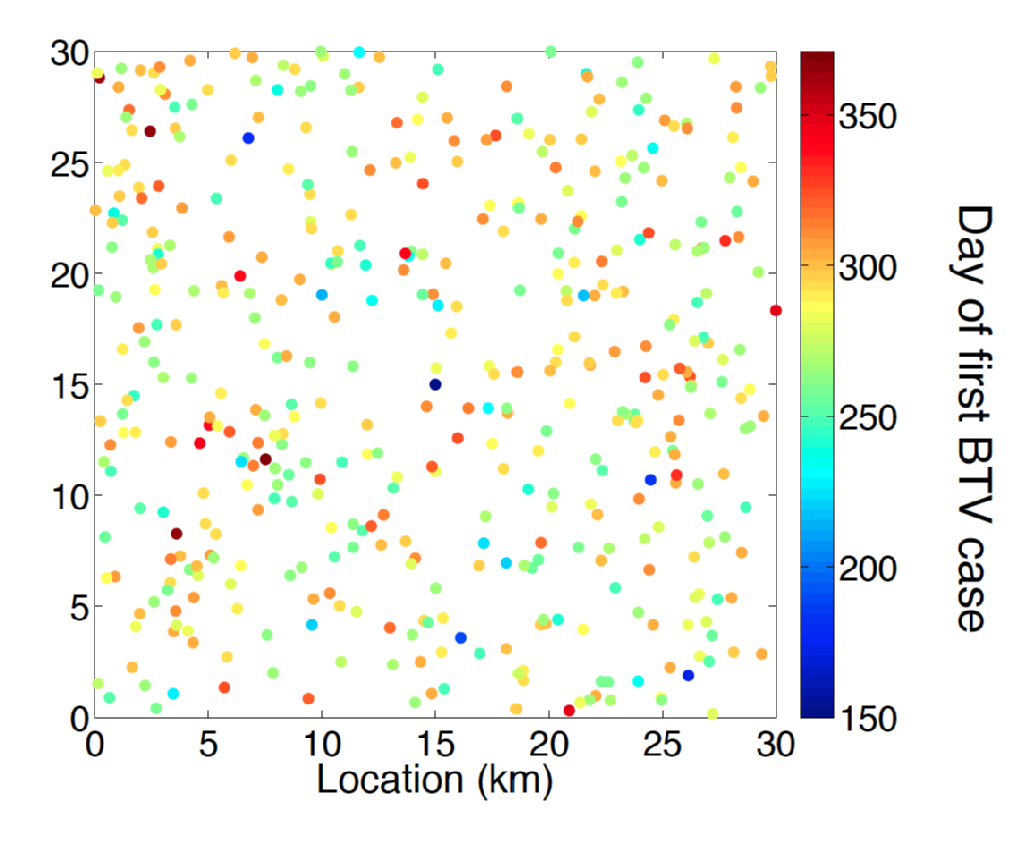
a febre catarral ovina é uma doença viral (BTV) de ruminantes transmitidos por várias gênero culicoides gênero mordendo midge espécies. Os sintomas para animais doentes com VFCO incluíam desconforto, febre alta e cianose da língua, o que dá à doença o seu nome. Entre a doença do vírus da febre catarral ovina, a mortalidade associada é elevada. Até o final da década de 1990, a gama europeia de BTV estava inteiramente associada com a gama do vetor midge C. Imicola. No final dos anos 90 e no início dos anos 2000, registou-se uma expansão sem precedentes do VFT em áreas da Europa que fazem parte da Gama de outras espécies de midge, tais como as do complexo C. Obsoletus e espécies de midge estreitamente relacionadas. Em particular, um surto originário dos Países Baixos em 2006 é o primeiro exemplo registado de uma incursão do VFC a 50 graus de latitude norte. Nos verões seguintes, foram descobertos casos de VFC em todo o norte da Europa, incluindo na Bélgica, Alemanha, Reino Unido e Dinamarca, demonstrando a capacidade da febre catarral ovina para passar o inverno no ambiente do Norte da Europa. Uma característica intrigante da serologia da febre catarral ovina do Norte da Europa é que a doença foi causada por uma estirpe distinta (BTV-8) dos responsáveis por incursões no sul da Europa, ou seja, Espanha (BTV-4) e Itália (BTV-2).a previsão do impacto da incursão do VFCO e a melhor concepção da gestão do gado e do controlo de doenças exigem uma metodologia de modelização de ponta. Entende-se muito sobre a epidemiologia do VFCO, por exemplo, uma compreensão sólida do período esperado de viremia para os hospedeiros de bovinos e ovinos e o efeito da temperatura climática no período de incubação da febre catarral ovina dentro do seu vector de midge. No entanto, a estimativa do risco espaço-temporal colocado pela dispersão vectorial longe dos animais hospedeiros infectados continua a ser um desafio significativo. O problema de inferência aqui é multi-factorial requerendo não só inferência de parâmetro, mas também a seleção de modelos com princípios estatísticos.
Malária
a Malária segue o genérico de ciclo de transmissão como anterior descrito; o vetor a ser a fêmea do mosquito, que toma a sua refeição de sangue como parte do processo reprodutivo; os machos da espécie são nectavorious e, como tal, não participam no ciclo de transmissão. A frequência de alimentação é determinada por esta necessidade biológica, e assim a taxa média de alimentação é geralmente em torno de uma vez a cada quatro dias e é geralmente assumido que a saciação para um lote de ovos é alcançada dentro desta única refeição. Existem muitos tipos diferentes de malária, alguns afetando os seres humanos (isso pode ser causado por um dos quatro tipos diferentes de Plasmodium) e outros afetando os animais. O gênero Anopheles é responsável pela transmissão ao ser humano, dos quais aproximadamente 30 em cada 400 espécies causam a disseminação da infecção.
uma característica fundamental que afeta a malária é a temperatura; mesmo se o mosquito reside dentro da área dada, temperaturas externas de cerca de 16C (temperado exato é dependente da espécie de parasita), não é quente o suficiente para permitir o desenvolvimento. Em geral, à medida que a temperatura aumenta a partir de 16C, o período de incubação é mais curto, com uma parada súbita acima de cerca de 32C, uma vez que o parasita não é capaz de sobreviver a essas temperaturas.alguns sistemas, no entanto, podem ser muito mais complexos do que o exemplo geral dado anteriormente. Um desses exemplos é o Honeycreeper Havaiano (Drepanididae); ele sofre não apenas os efeitos adversos da malária aviária (Plasmodium relictum) que é transmitida através do mosquito (Culex quinquefasciatus), mas também os da mudança climática, e predação. A interação entre esses fatores dominantes é grande, com temperaturas e abundância de predadores afetando o curso da doença e a capacidade das aves (ou incapacidade) de resistir à extinção. Além disso, algumas espécies do mel apresentam a capacidade de conferir resistência à malária, não sofrendo efeitos deletérios da doença enquanto permanecem infecciosos (estes são mais comumente referidos como portadores e inadvertidamente causam um reservatório de infecção, sobrevivendo à expectativa de vida normal “sem doença”, mas ainda espalhando a infecção.
Este trabalho foi publicado como:
K. S. Rock et al. “Modelling the Future of the Hawaiian Honeycreeper: An Ecological and Epidemiological Problem”. Modelização ecológica (junho de 2012)