
O volume molar (símbolo Vm) de uma substância é o volume ocupado por um mol de substância a uma dada temperatura e pressão. Ele é igual à massa molecular (M) da substância dividida pela sua densidade (ρ) a uma dada temperatura e pressão:
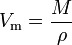
Ele tem uma unidade SI de metros cúbicos por mole (m3/mol). No entanto, os volumes molares são frequentemente expressos em metros cúbicos por 1000 moles (m3/kmol) ou decimais cúbicos por mol (dm3/mol) para gases e em centímetros por mol (cm3/mol) para líquidos e sólidos.se uma substância for uma mistura contendo componentes N, o volume molar é calculado utilizando:
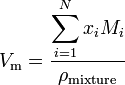
onde x i é mole fração da i-ésima componente, M i é a massa molecular do i-ésimo componente e pmixture é a mistura de densidade a uma dada temperatura e pressão.ao indicar os valores numéricos do volume molar, é importante também indicar as condições dadas de temperatura e pressão. Caso contrário, os valores numéricos não têm sentido.
Ideal de estufa
A lei dos gases ideais equação pode ser rearranjada para dar a esta expressão para o volume molar de um gás ideal:
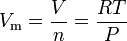
Onde, em unidades do SI:
= o gás de pressão absoluta, em Pa
= número de moles, em mol
= a gás volume molar, em m3/mol
= a gás temperatura absoluta, K
= a universal lei dos gases constantes do 8.314472 m3·Pa·mol-1·K-1
Onde nos EUA habitual unidades:
= o gás de pressão absoluta, na aisp
= número de moles, em lb-mol
= a gás volume molar, em ft3/lb-mol
= temperatura absoluta do gás, em graus Rankine (°R)
= a universal lei dos gases constantes do 10.7316 m3·aisp·lb-mol-l·°R-1
Exemplo de cálculos de gás ideal molar volumes:
- No SI as unidades métricas:
Vm = 8.314472 × seja, -273,15 / 101,325 = 0.022414 m3/mol a 0 °C e 101,325 Pa de pressão absoluta = 22.414 m3/kmol a 0 °C (ou Seja, -273,15 K) e 101.325 kPa de pressão absoluta Vm = 8.314472 × seja, -273,15 / 100,000 = 0.022711 m3/kmol a 0 °C e 100 000 Pa de pressão absoluta = 22.711 m3/kmol a 0 °C (ou Seja, -273,15 K) e 100 kPa de pressão absoluta
- No habituais EUA unidades:
Vm = 10.7316 × 519.67 / 14.696 = 379.48 ft3/lb-mol a 60 °F (519.67 °R) e 14.696 aisp
Notas:
- lb-mol é uma abreviação para a libra-mol
- °R está em graus Rankine (de uma escala de temperatura absoluta) e °F está em graus Fahrenheit (de uma escala de temperatura).R = ° F + 459.67
- a literatura técnica pode ser confusa porque alguns autores muitas vezes não conseguem explicar se eles estão usando a constante R da lei universal do gás, que se aplica a qualquer gás ideal, ou se eles estão usando a constante R da lei específica do gás, que só se aplica a um gás específico individual. A relação entre as duas constantes é Rs = R / M, em que M é a massa molecular do gás.
gases reais
gases reais são os gases que não exibem o comportamento ideal dos gases. Para tais gases, o método mais simples de determinação de volumes molares é usando compressibilidade factores como na expressão a seguir:
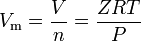
, onde Z é o gás de fator de compressibilidade, que é um útil termodinâmicos propriedade para modificar a lei dos gases ideais a conta para o comportamento real de gases. A equação acima é basicamente uma simples equação de Estado (EOS). A maior limitação desta equação de Estado é que o Fator de compressibilidade do gás, Z, não é uma constante, mas varia de um gás para outro, bem como com a temperatura e pressão do gás em consideração.
valores mais precisos dos volumes molares de gases reais podem ser obtidos usando equações de Estado como a equação de van der Waals desenvolvida em 1873, a equação de Redlich-Kwong desenvolvida em 1949, a equação de Soave-Redlich-Kwong desenvolvida em 1972 e a equação de Peng-Robinson desenvolvida em 1976.
- 1, 0 1.1-União Internacional de química Pura e Aplicada (IUPAC): Grandezas, Unidades e Símbolos em Físico-Química, 2a Edição, 1993
- 2.0 2.1 NIST Guia para SI Item 8.6.3 na Secção 8
- 3.0 3.1 Determinação da compressibilidade do gás valores Informações sobre como determinar a gás fatores de compressibilidade e molar volumes.
| |
algum conteúdo desta página pode ter aparecido anteriormente no Citizendium. |