9.5 Violações da Regra do Octeto
Objetivo
- Reconhecer os três principais tipos de violações da regra do octeto.
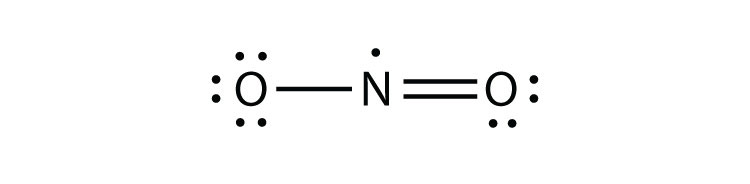
tão importante e útil como a Regra do octeto está na ligação química, existem algumas violações bem conhecidas. Isto não significa que a Regra do octeto seja inútil—muito pelo contrário. Como acontece com muitas regras, há exceções, ou violações.há três violações à Regra do octeto. Molécula Odd-electron molecular com um número ímpar de elétrons na camada de valência de um átomo. representa a primeira violação à Regra do octeto. Embora sejam poucos, alguns compostos estáveis têm um número ímpar de elétrons em suas conchas de Valência. Com um número ímpar de elétrons, pelo menos um átomo na molécula terá que violar a Regra do octeto. Exemplos de moléculas de elétrons ímpares estáveis são NO, NO2 e ClO2. O diagrama de pontos de elétrons de Lewis para NO é o seguinte:
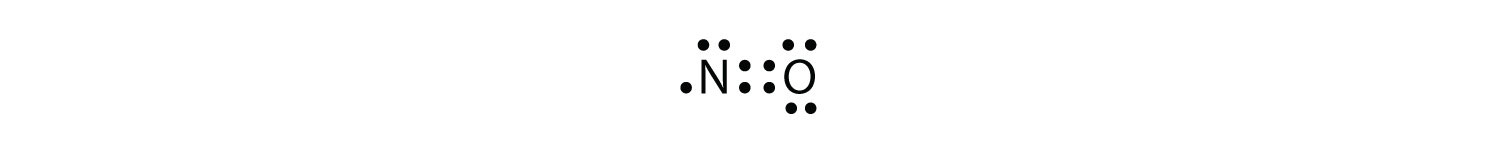
embora o átomo de o tenha um octeto de elétrons, o átomo de N tem apenas sete elétrons em sua camada de Valência. Embora NO seja um composto estável, é muito quimicamente reativo, como a maioria dos outros compostos de elétrons ímpares.moléculas moleculares com deficiência de electrões com menos de oito electrões na camada de valência de um átomo. representa a segunda violação à Regra do octeto. Estes compostos estáveis têm menos de oito elétrons em torno de um átomo na molécula. Os exemplos mais comuns são os compostos covalentes de berílio e boro. Por exemplo, berílio pode formar duas ligações covalentes, resultando em apenas quatro elétrons em sua concha de Valência. :
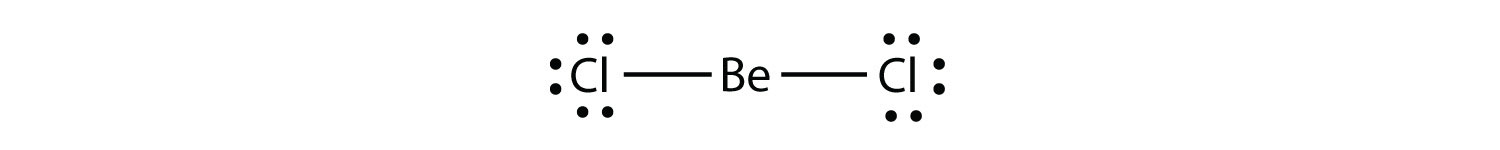
Boro comumente faz apenas três ligações covalentes, resultando em apenas seis elétrons de valência em torno do B átomo. Um exemplo bem conhecido é BF3:
a terceira violação à Regra do octeto é encontrada naqueles compostos com mais de oito elétrons atribuídos à sua concha de Valência. Estes são chamados de moléculas moleculares de Valência expandida com mais de oito elétrons na camada de valência de um átomo.. Tais compostos são formados apenas por átomos centrais na terceira linha da tabela periódica ou além que têm orbitais d vazios em suas conchas de Valência que podem participar na ligação covalente. Um desses compostos é o PF5. O único diagrama razoável de pontos de elétrons de Lewis para este composto tem o átomo de P fazendo cinco ligações covalentes:
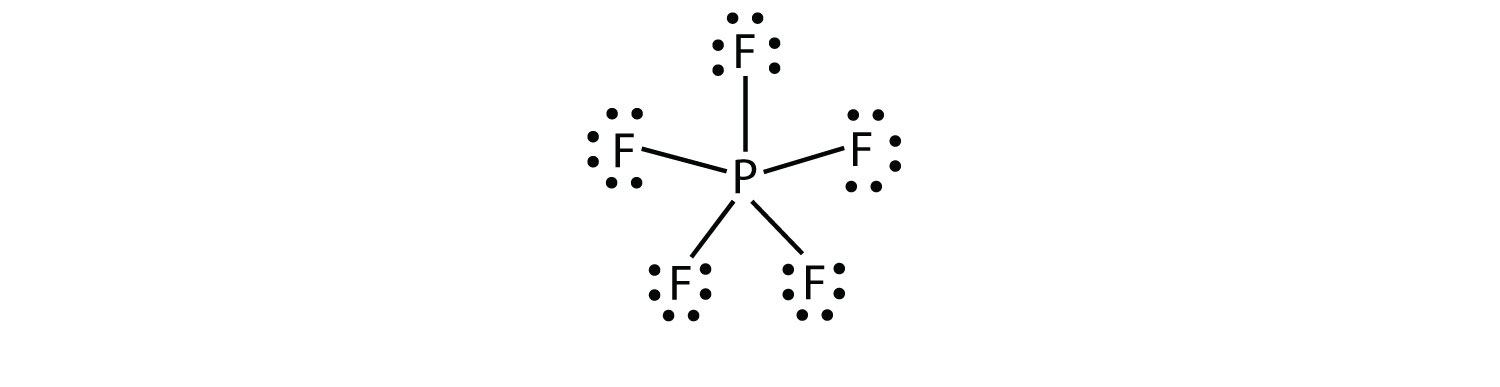
formalmente, o átomo de P tem 10 elétrons em sua concha de Valência.
exemplo 9
identifique cada violação à Regra do octeto desenhando um diagrama de pontos de Lewis.
- ClO
- SF6
Solução
-
Com um átomo de Cl e um átomo de O, esta molécula tem 6 + 7 = 13 elétrons de valência, por isso, é um ímpar de elétrons da molécula. A Lewis electron dot diagram for this molecule is as follows:

-
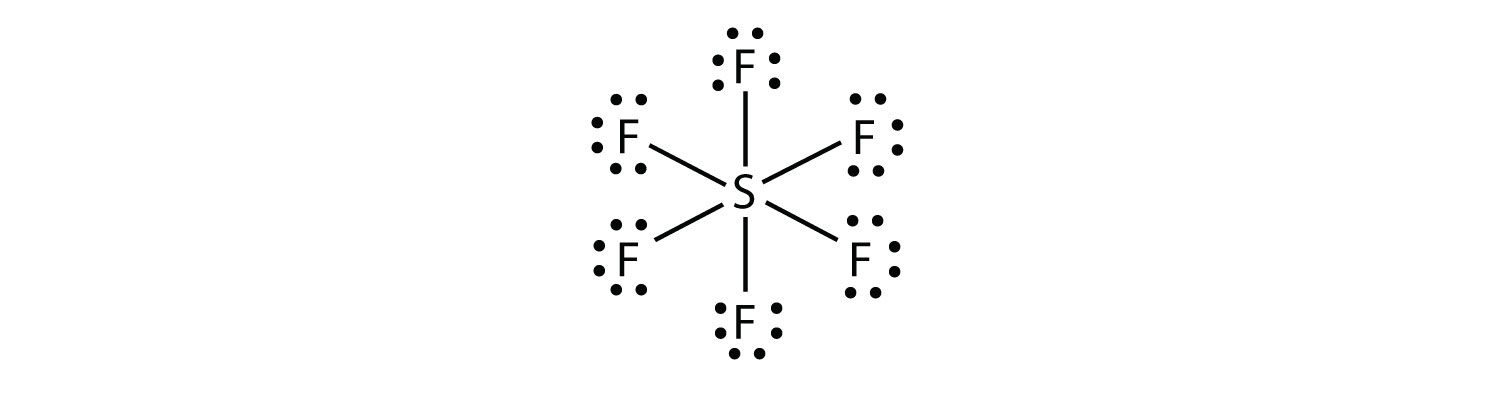
In SF6, the central S atom makes s s six covalent bonds to the six surrounding F atoms, so it is an expanded valence shell molecule. Seu diagrama de pontos de elétrons de Lewis é o seguinte::
Test Yourself
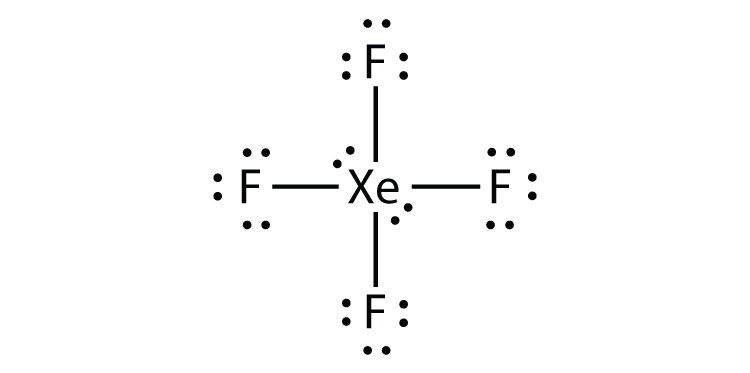
Identify the violation to the octet rule in XeF2 by drawing a Lewis electron dot diagram.
resposta
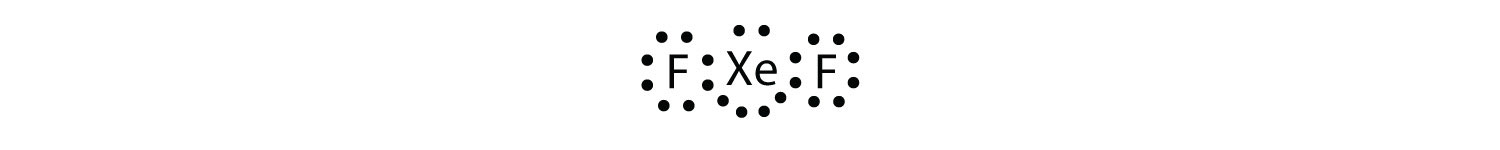
o átomo de Xe tem uma camada de Valência expandida com mais de oito electrões à sua volta.
Key Takeaway
- Existem três violações à Regra do octeto: moléculas de elétrons ímpares, moléculas com deficiência de elétrons, e moléculas de concha de Valência expandidas.porque é que uma molécula de electrões ímpares não satisfaz a regra dos octetos?
-
Por que um átomo na segunda linha da tabela periódica não pode formar moléculas de concha de Valência expandida?
-
desenhar um diagrama de pontos de Lewis aceitável para estas moléculas que violam a Regra do octeto.
- NO2
- XeF4
-
desenhe um diagrama de pontos de Lewis aceitável para estas moléculas que violam a Regra do octeto.
- BCl3
- ClO2
-
desenhe um diagrama de pontos de Lewis aceitável para estas moléculas que violam a Regra do octeto.
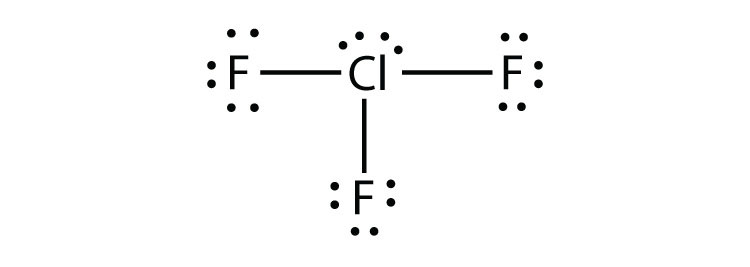
- POF3
- ClF3
-
desenhe um diagrama de pontos de Lewis aceitável para estas moléculas que violam a Regra do octeto.
- SF4
- BeH2
Respostas
-
não Há nenhuma maneira que todos os elétrons podem ser emparelhados se houver um número ímpar deles.
-
-
-
-