o metabolismo celular Normal depende da manutenção do pHwithin no sangue em limites muito estreitos (7.35-7.45).até mesmo relativamente mildexcursões fora deste intervalo de pH normal podem ter efeitos deletérios, incluindo a redução do fornecimento de oxigénio aos tecidos, electrólitos e alterações na contractilidade muscular cardíaca; a sobrevivência é reduzida se o pH sanguíneo descer abaixo de 6,8 ou subir acima de 7,8.
O problemfor o corpo é que o metabolismo normal está associado withcontinuous produção de íons hidrogênio (H+) e dióxido de carbono(CO2), os quais tendem a reduzir o pH. O mechanismwhich supera esse problema e serve para manter normal o pH do sangue(por exemplo, preservar ácido-base homeostase) é um complexo de sinergia ofaction envolvendo química de buffers no sangue, células vermelhas(hemácias), que circulam no sangue e a função de threeorgans: pulmões, rins e cérebro.antes de explicar como estes cinco elementos contribuem para a manutenção global do pH sanguíneo, seria útil rever rapidamente alguns conceitos básicos.o que é um ácido, o que é uma base e o que é pH?
um ácido é uma substância que desprende íons-hidrogénio (H+) na dissociação em solução.por exemplo:: Ácido clorídrico (HCl) dissocia-se para hydrogenions e íons de cloreto
HCl ![]() H+ + Cl-
H+ + Cl-
o ácido Carbônico (H2CO3) dissocia-se tohydrogen íons e bicarbonato de íons
H2CO3 ![]() H+ +HCO3–
H+ +HCO3–
fazemos a distinção entre ácidos fortes como o ácido clorídrico andweak ácidos como o ácido carbônico. A diferença é que ácidos fortes dissociam mais do que ácidos fracos. Consequentemente, a concentração de hidrogênio de um ácido forte é muito maior do que a de um fracote.
uma base é uma substância que na solução Aceita íons de didrogénio.por exemplo, o bicarbonato de base (HCO3–)aceita íons de hidrogênio para formar ácido carbônico:
HCO3– + h+![]() H2CO3
H2CO3
pH é uma escala de 0-14 de acidez e alcalinidade. A água pura tem um pH de 7 e é neutra (nem ácida nem alcalina). pH superior a 7 is alcalino e inferior a 7 ácido. Assim, o pH do sangue (7.35-7.45) é ligeiramente alcalino, embora na medicina clínica o termo alcalosisis, talvez confusamente, reservado para o pH do sangue maior que 7.45e o termo acidose é reservado para pH sanguíneo inferior a 7,35.
pH é uma medida da concentração de iões de hidrogénio (h+).Os dois estão relacionados, de acordo com o followingequation:
pH = – log10
a, onde a é a concentração de íons de hidrogênio inmoles por litro (mol/L)
a Partir desta equação
pH 7.4 = H+ concentração de 40 nmol/L
pH 7,0 = H+ concentração de 100 nmol/L
pH 6,0 = H+ concentração de 1000 nmol/L
é claro que:
- os dois parâmetros variam inversamente; à medida que a concentração de iões de hidrogénio aumenta, o pH diminui
- devido à relação logarítmica, uma grande alteração na concentração de iões de hidrogénio é, na verdade, uma pequena alteração no pH. por exemplo, a duplicação da concentração de iões de hidrogénio faz com que o pH caia apenas 0,3
o que é um tampão? – o sistema tampão de bicarbonato
tampões são produtos químicos em solução que minimizam as alterações de pH que ocorrem quando se adicionam ácidos através da lavagem de íons de hidrogénio. Um buffer é uma solução de um ácido fraco e sua base de açúcar. No sangue, o principal sistema tampão é o ácido carbônico fraco (H2CO3) e sua base conjugada, bicarbonato (HCO3–). Para explicar howthis sistema minimiza as alterações no pH, suponha que adicionar um ácido forte,por exemplo, HCl, o bicarbonato de buffer:
O ácido vai dissocia, liberando íons de hidrogênio:
HCl ![]() H+ + Cl–
H+ + Cl–
O bicarbonato de buffer, em seguida, ‘absorve’ o de íons de hidrogênio, formingcarbonic ácido no processo de:
HCO3– + H+ ![]() H2CO3 (ácido carbônico)
H2CO3 (ácido carbônico)
O ponto importante é que, devido a íons de hidrogênio a partir de HClhave sido incorporado ao fraca de ácido carbônico, que faz notdissociate tão facilmente, o número total de íons de hidrogênio em solutionand, portanto, o pH não alterar tanto quanto seria occurredin a ausência do buffer.
embora um buffer minimize grandemente a mudança deesph, ele não o elimina porque mesmo um ácido fraco (ácido likecarbônico) dissocia-se em certa medida. O pH de uma solução-tampão é uma função das concentrações relativas do fracacido e da sua base conjugada.
pH = 6.1 + log (/)
Where = concentration ofbicarbonate
= concentration of carbonic acid
This relationship, known as the Henderson-Hasselbalch equation,shows that pH is governed by the ratio of base(HCO3–) concentration to acid(H2CO3) concentration. adicionam-se iões de hidrogénio ao tampão bicarbonato.:
H+ +HCO3– ![]() H2CO3
H2CO3
bicarbonato (base) é consumida (concentração diminui) andcarbonic ácido é produzido (aumenta a concentração). Se os hidrogênios continuarem a ser adicionados, todos os bicarbonato eventualmente beconsumed (convertido em ácido carbônico) e haveria efeito nobuffering – pH, em seguida, iria cair drasticamente se mais ácido fosse acrescentado.no entanto, se o ácido carbónico pudesse ser continuamente removido do sistema e bicarbonato constantemente regenerado, então a capacidade de carga e, portanto, o pH poderiam ser mantidos apesar da adição contínua de íons de hidrogénio.
As will become clear with more detail of the physiology ofacid-base balance, that is, in effect, what happens in the body. Inessence, the lungs ensure removal of carbonic acid (as carbondioxide) and the kids ensure continuous regeneration ofbicarbonate.
Este papel dos pulmões é dependente de uma singularacterística do sistema de tamponamento de bicarbonato e que é a possibilidade do ácido carbônico a ser convertido em dióxido de carbono e água.
O seguinte equação descreve a relação de allelements do bicarbonato de memória intermédia de sistema como ele opera em thebody
H+ +HCO3– ![]() H2CO3
H2CO3 ![]() H2O + CO2
H2O + CO2
é importante observar que as reações são reversíveis.A direcção depende da concentração relativa de cada elemento. De modo que, por exemplo, um aumento na concentração de dióxido de carbono força reação à esquerda com o aumento da forma de ácido carbônico e, em última análise, íons hidrogênio.isto explica o potencial acídico do dióxido de carbono e leva-nos à contribuição importante que os pulmões e os glóbulos vermelhos contribuem para a estabilidade ácida global.
função pulmonar, transporte de CO2 e basebalância ácida
uma quantidade constante de CO2 no sangue, essencial para o equilíbrio normal-base, reflecte um equilíbrio entre o que é produzido como resultado do metabolismo das células dos tecidos e o que é excretado pelo ar barato dos pulmões.os pulmões regulam o teor de dióxido de carbono do sangue.A sequência de eventos desde a produção de dióxido de carbono nos seus componentes até à eliminação no ar expirado é descrita na Fig. 1.O dióxido de carbono difunde-se das células dos tecidos para cercar o sangue capilar (Fig. 1a). Uma pequena proporção dissolve-se no bloodplasma e é transportada para os pulmões sem alterações.
mas a maioria dos glóbulos vermelhos difusivos onde se combina com água para formar ácido carbónico.O ácido dissocia-se com a produção de iões de hidrogénio e debicarbonato. Íons de hidrogênio se combinam com hemoglobina desoxigenada(hemoglobina está atuando como um tampão aqui), impedindo uma queda perigosa no pH celular, e bicarbonato se difunde ao longo de um concentrationongradient de glóbulos vermelhos para plasma.assim, a maior parte do dióxido de carbono produzido nos tecidos é transportada para os pulmões como plasma sanguíneo bicarbonateína.
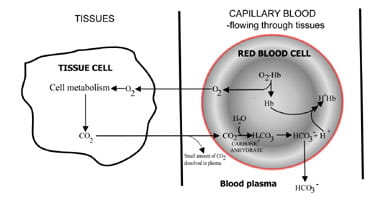
Fig. 1a. CO2 produzido em tecidos convertidos em bicarbonato para transporte para os pulmões.
|
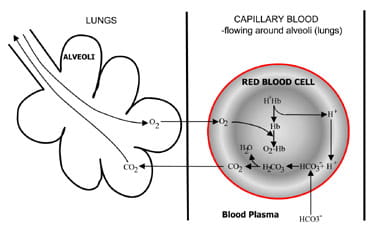
|
Fig. 1b. At the lungs bicarbonate convertedback to CO2 and eliminated by the lungs.nos alvéolos pulmonares, o processo é invertido(Fig. 1b).Íons de hidrogênio são deslocados da hemoglobina à medida que absorve Oxigen do ar inspirado. Os íons de hidrogênio são agora buffered bybicarbonato que se difunde do plasma de volta para os glóbulos vermelhos, e o ácido carbônico é formado. À medida que a concentração aumenta, é convertida em água e dióxido de carbono. Por último, o dióxido de carbono reduz um gradiente de concentração dos glóbulos vermelhos para os alvéolos de forexcrição no ar expirado.os quimioreceptores respiratórios no tronco cerebral respondem a alterações na concentração de dióxido de carbono no sangue, causando um aumento da ventilação (respiração) se a concentração de dióxido de carbono aumentar e uma ventilação reduzida se o dióxido de carbono diminuir.o metabolismo celular normal resulta na produção contínua de iões de hidrogénio. Vimos que, combinando com estes íons de hidrogénio, o tampão de bicarbonato no sangue minimiza o seu efeito. No entanto,o buffering só é útil a curto prazo, e, em última análise, íons de hidrogênio têm de ser removidos do corpo.Além disso, é importante que o bicarbonato que é usado íons de hidrogênio tobuffer seja continuamente substituído.estas duas tarefas,a eliminação dos iões do hidrogénio e a regeneração do bicarbonato, são completadas pelos rins. As células tubulares renais são ricas em anidrase carbónica, o que facilita a formação de carbonicacídeos a partir de dióxido de carbono e água. O ácido carbónico dissocia o tobicarbonato e os iões de hidrogénio. O bicarbonato é reabsorvido no boblood e os íons de hidrogénio passam para o lúmen do túbulo e são eliminados do corpo na urina.esta eliminação urinária depende da presença, na urina, de tampões, principalifosfato e iões de amoníaco.a maioria das alterações ácido-base resultam de doenças ou danos nos órgãos (rins, pulmões, cérebro) cuja função normal é necessária para a homeostase ácido-base, doença que provoca um aumento anormal da produção de ácidos metabólicos de tal forma que os mecanismos homeostáticos são esmagados pela intervenção médica (ex. ventilação mecânica, alguns fármacos)
Três parâmetros medidos durante a análise dos gases do sangue, o pH (pH) do sangue arterial, a pressão parcial de dióxido de carbono no sangue arterial (pCO2(a)) e a concentração de bicarbonato (HCO3–) são de importância crucial (ver Quadro I para a gama de referência (normal))).Os resultados destes três estudos permitem classificar a aglomeração ácida numa De quatro categorias etiológicas:
- Respiratory acidosis
- Respiratory alkalosis
- Metabolic acidosis
- Metabolic alkalosis
|
Adults |
Neonates |
|
|
pH |
7.35-7.45 |
7.30-7.40 |
|
pCO2 (kPa) |
4.7-6.0 |
3.5-5.4 |
|
Bicarbonate |
22-28 |
15-25 |
TABLE I. Aproximado de referência (normal)faixas
Para entender como os resultados de pH, pCO2(a)e bicarbonato são usados para classificar ácido-base distúrbios da thisway, temos que voltar para o Henderson-Hasselbalch equação
pH = 6.1 + log (/ )
Podemos medir o pH e do bicarbonato, mas não o ácido carbônico(H2CO3). No entanto, há uma relação entre pCO2 (a) e H2CO3 que permite a reafirmação da equação de Henderson-Hasselbalch interms dos três parâmetros (pH, pCO2(a) ebicarbonato) medidos durante a análise dos gases sanguíneos:
pH = 6.1 + log ( /( pCO2(a) × 0.23))
ao remover todas as constantes desta equação, a relação entre os três parâmetros medidos pode ser mais simplista:
pH ∝ / pCO2(a)
esta relação, crucial para a compreensão de todos os follows relativos a perturbações ácidas da base, afirma que o pH do sangue arterial é proporcional à razão de concentração de bicarbonato pCO2(a). It allows the followingdeductions:
- pH remains normal so long as the ratio: pCO2( a) remains normal
- pH increases (i.e. alkalosis occurs) if either increases or pCO2(a) decreases.
- pH diminui (i.e. acidose ocorre) se diminui ou pCO2(a) aumenta a
- Se tanto pCO2(a) e aumentaram relativamente a mesma quantidade, a relação e, portanto, o pH é normal
- Se tanto pCO2(um) e são diminuiu relativamente a mesma quantidade, a relação e, portanto, o pH é normal.as perturbações ácido-base afectam principalmente o eitherpCO2 (a), caso em que se designa por perturbação respiratória, ou, caso em que se designa por aglomeração não respiratória ou metabolicdestributiva.:
- Se o principal distúrbio é uma levantada pCO2(a) (o que provoca acidose – ver acima), a condição é chamada de acidose respiratória
- Se o principal distúrbio é uma redução da pCO2(a) (o que faz com que ao alkalosis – ver acima), a condição é chamada respiratória ao alkalosis
- Se a principal perturbação está associada com a redução do bicarbonato (o que resulta em acidose – ver acima), a condição é chamada de acidose metabólica
- Se o principal distúrbio é associado com elevado bicarbonato (o que resulta em ao alkalosis – ver acima), a condição é chamada de metabólica ao alkalosis
Causas de ácido-básico, distúrbios
Respiratória acidose – (levantou pCO2(a),redução do pH)
Respiratória acidose láctica é caracterizada por increasedpCO2(a) devido à falta de ventilação alveolar(hipoventilação) e consequente redução de eliminação ofCO2 a partir do sangue. As doenças respiratórias, tais como a broncopneumonia, o enfisema, a asma e a diase pneumática obstrutiva crónica, podem estar todas associadas a hipoventilação suficiente para causar acidose respiratória.algumas drogas (ex. morfina ebarbitúricos) podem causar acidose respiratória ao deprimir o centro terespiratório no cérebro. Danos ou traumas na parede torácica e na musculatura envolvida na mecânica da respiração podem reduzir a taxa de ventilação. Isto explica a acidose respiratória que pode complicar o curso de doenças como poliomielite,síndrome de Guillain-Barre e recuperação de trauma torácico grave.
alcalose respiratória – (reducedpCO2(a), pH aumentado)
por contraste, a alcalose respiratória é caracterizada por decrasedpco2(a) Devido à excessiva ventilação alveolar e resultando na eliminação excessiva de CO2 do sangue.Doença na qual, devido à redução de oxigênio no sangue (hipoxemia), o centro terespiratório é estimulado pode resultar em respiratorialkalose.os exemplos incluem anemia grave, embolismo pulmonar e Síndrome Respiratória do adulto. A hiperventilação é suficiente paraassegurar que a alcalose respiratória pode ser uma característica dos ataques de ansiedade e responder a dor intensa. Uma das propriedades menos bem-vindas do salicilato (aspirina) é o seu efeito estimulante no respiratório. Este efeito explica a alcalose respiratória que ocorre após sobredosagem com salicilato. Por último, a ventilação mecânica demasiado entristúsica pode causar alcalose respiratória.acidose metabólica – (decrasedhco3 -, pH diminuído)
bicarbonato reduzido é sempre uma característica da metabolicacidose. Isto ocorre por uma de duas razões: aumento da utilização de bicarbonato para amortecer uma carga ácida anormal ou aumento da perda de bicarbonato pelo organismo. Cetoacidose diabética e lacticacidose são duas condições caracterizadas pela superprodução de ácidosmetabólicos e consequente exaustão de bicarbonato.no primeiro caso, as concentrações sanguíneas anormalmente elevadas de ceto-ácidos(ácido B-hidroxibutírico e ácido acetoacético) reflectem os vários desvios etabólicos que resultam da insulindeficiência. todas as células produzem ácido láctico se tiverem falta de oxigénio,pelo que a produção de ácido láctico aumentada e a metabolicacidose resultante ocorrem em qualquer situação em que o fornecimento de oxigénio aos tecidos esteja gravemente comprometido.
exemplos incluem cardiac arrestand qualquer condição associada a choque hipovolêmico (por exemplo, perda massivefluid). O fígado desempenha um papel importante na remoção da pequena quantidade de ácido láctico que é produzida durante o normal hematabolismo celular, de modo que a acidose láctica pode ser uma característica do mal-estar do fígado.a perda anormal de bicarbonato do corpo pode ocorrer durante a diarréia de duringsevere. Se não for controlada, isto pode levar a acidose metabólica.A falha em regenerar bicarbonato e excretar íons de hidrogênio explica a acidose metabólica que ocorre na falha renal. a alcalose metabólica – (aumento do CO3 -, aumento do pH)
bicarbonato é sempre aumentada em alcalose metabólica. Raramente, a administração excessiva de bicarbonato ou a ingestão de preparação antiácida bicarbonateína podem causar alcalose metabólica, mas esta é habitualmente transitória. A perda anormal de íons de hidrogênio do corpo pode ser o problema primário. Bicarbonato que, de outra forma, seria fumado para amortecer estes íons de hidrogénio perdidos, consequentemente, acumula-se no sangue. O suco gástrico é ácido e gastricaspiração ou qualquer processo de doença em que o conteúdo gástrico arelost do corpo representa uma perda de íons de hidrogénio.o vómito do sumo gástrico, por exemplo, explica a alcalose metabólica que pode ocorrer em doentes com piloricstenose. A depleção grave de potássio pode causar alcalossisdue metabólica para a relação recíproca entre hidrogênio e potassiumions.é vital para a vida que o pH não renuncie muito longe do normal,e o corpo sempre tentará retornar um pH anormal towardsnormal quando o equilíbrio ácido-base é perturbado. A compensação é então dada a este processo de preservação da vida. Para compreender a compensação, é importante recordar que o pH é governado pela theratio : pCO2(a).enquanto a razão for normal, o pH será normal.
considere o doente com acidose metabólica cujo pH é baixo porque o bicarbonato é baixo. Para compensar a razão baixa e voltar a ser tão importante para o normal, o paciente deve baixar a hispCO2 (a). Os quimioreceptores no centro respiratório do cérebro respondem a uma concentração crescente de iões de hidrogénio(baixo pH), causando um aumento da ventilação (hiperventilação) e, consequentemente, uma maior eliminação de dióxido de carbono; o CO2(a) diminui e a razão : o CO2(a) regressa ao normal.
compensação pela alcalose metabólica na qual é elevada, em contraste, envolve a diminuição da respiração e, assim, a retenção de dioxideso de carbono que o pCO2(a) sobe para igualar o aumento . No entanto, a depressão respiratória tem o efeito secundário indesejável de ameaçar uma adequada oxigenação dos tecidos. Por esta razão, a compensação respiratória da alcalose metabólica é limitada.as perturbações primárias do pCO2(a) (respiratoriacidose e alcalose) são compensadas por ajustes renais da excreção iónica de hidrogénio que resultam em alterações que compensam adequadamente a alteração primária do pCO2 (a). Assim, a compensação renalpara a acidose respiratória (raisedpCO2(a)) envolve um aumento da reabsorção debicarbonato, e a compensação renal para a alcalose respiratória(redução do pCO2(a)) envolve uma redução da bicarbonatereabsorção.o conceito de equilíbrio ácido-base durante a compensação é transmitido visualmente na Fig. 2. A tabela II resume os resultados dos gases sanguíneos que caracterizam todas as quatro perturbações ácido-base antes e depois da compensação.
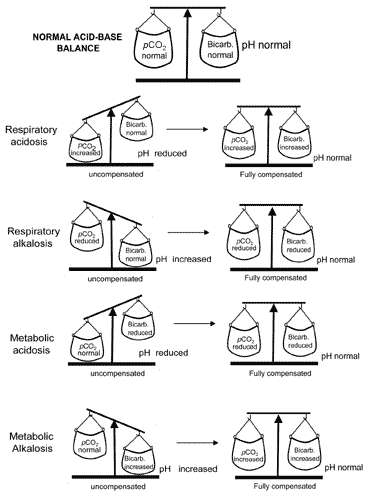
Fig. 2. A “balança ácido-base” : compensationrestores normal pH
Primary disturbance
Respiratory
acidosis
primary
increase
in pCO2Repiratory
alkalosis
primary
decrease
in pCO2Metabolic
acidosis
primary
decrease
in bicarb.Metabolic
alkalosis
primary
increase
in bicarb.Some
common
causesEmphysema
COPD
Pneumonia
Depression
of repiratory
centerHyper-
ventilation
Anxiety
attacks
Stimulation
of brain
respiratory
centerRenal failure
Diabetic
ketoacidosis
Circulatory
failure
– clinical
shock
(lactic
acidosis)Bicarbonate
admini-
strationPotassium
depletionCompen-
satory
mechanismRENAL
increase
bicarbonateRENAL
decrease
bicarbonateRESPIRA-
TORY
decrease
pCO2RESPIRA-
TORY
increase
pCO2
but limited
compen-
sation
in metabolic
alkalosisInitial blood
gas results
(uncompen-
sated)pH
decreased
pCO2
increased
Bicarbonate
normalpH
increased
pCO2
decreased
Bicarbonate
normalpH
decreased
pCO2
normal
Bicarbonate
decreasedpH
increased
pCO2
normal
Bicarbonate
increasedBlood gas
results after
parcial
compensação-
organizaçãopH
diminuição
mas o mais próximo
normalpCO2
inreased
Bicarbonato
maiorpH
maior
mas mais próximo
normalpCO2
diminuição
Bicarbonato
marginalmente
diminuiçãopH
diminuição
mas o mais próximo
normalpCO2
marginalmente
diminuição
Bicarbonato
diminuiçãoLimitado
compensação-
ção em
metabólica
ao alkalosisBlood gas
results after
full
compen-
sationpH normal
pCO2
increased
Bicarbonate
increasedpH normal
pCO2
decreased
Bicarbonate
decreasedpH normal
pCO2
decreased
Bicarbonate
decreasedLimited
compen-
sation in
metabolic
alkalosisPrintfriendly version of table, pdf.tabela II. os gases sanguíneos resultam em perturbações do equilíbrio de base dos ácidos a compensação respiratória para uma perturbação metabólica primária ocorre muito mais rapidamente do que a compensação metabólica (renal) para uma perturbação respiratória pré-primária. No segundo caso, a compensação ocorre mais em dias do que em horas.se a compensação resultar num retorno do pH ao normal, diz-se que o doente é totalmente compensado. Mas em muitos casos a compensação retorna pHtowards normais sem realmente alcançar a normalidade; em tais casos, o paciente é considerado parcialmente compensado.
Forreasons descritos acima, a alcalose metabólica é muito raramente complementada. pode partir-se da discussão acima que todos os doentes com perturbação ácido-base sofrem de apenas uma das quatro categorias de equilíbrio ácido-base. Este pode muito bem ser o caso, mas em circunstâncias particulares os pacientes podem apresentar mais do que uma perturbação.por exemplo, considere o doente com uma doença crónica, como o enfisema, que tem uma acidose respiratória compensada partialde longa data. Se este doente também fosse adiabético e não tivesse tomado a sua dose normal de insulina e como resultado num estado de cetoacidose diabética, os resultados dos gases sanguíneos iriam reflectir o efeito combinado de acidose respiratória e acidose metabólica.estas perturbações de base ácida mista não são infrequentes e podem ser difíceis de desvendar apenas com base nos resultados dos gases de sangue arterial.
resumo
a manutenção do pH sanguíneo normal envolve vários sistemas de órgãos e depende da integridade circulatória. Não é de surpreender que a perturbação do equilíbrio ácido-base possa complicar o curso de doenças muito diversas, bem como o trauma em muitas partes do corpo. O corpo tem um poder considerável para preservar o pH sanguíneo, e asurbações geralmente implicam ou doença crônica grave ou doença acutecrítica.os resultados da análise dos gases sanguíneos arteriais podem identificar perturbações ácido-base e fornecer informações valiosas sobre a sua causa.
Some suggested furtherreading
- Thomson WST, Adams JF, Cowan RA. Balança ácido-base clínica. Oxford: Oxford Medical Publications 1997
- Harrison RA. Equilíbrio ácido-base. Respir Care Clin N. America 1995; 1,1: 7-21
- Woodrow P. Arterial blood gas analysis. Nursing Standard 2004; 18,21: 45-52
- Sirker AA, Rhodes a, Gounds RM, Bennet ED. Acid-base physiology: the’ traditional ‘and the’ modern ‘ approach. Anestesia 2002; 57: 348-56