assim como você sabe, Dmitri Mendeleev é o pai da tabela periódica. Mas sabia que a tabela periódica moderna que usamos foi desenvolvida por um cientista chamado Henry Moseley? Vamos aprender a história fascinante por trás da tabela periódica.
Suggested Videos
Moderna Tabela Periódica
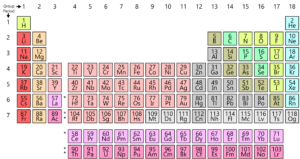
Como você sabe, todos os elementos encontrados na terra são organizados em uma grade ou matriz chamado a Moderna Tabela Periódica. A disposição destes elementos é de acordo com um padrão. A tabela periódica foi realmente desenvolvida e por Mendeleev no início de 1800. No entanto, foi aperfeiçoado por Henry Moseley, um físico inglês em 1913. Ao fazer ajustes na lei periódica, ele melhorou em todas as falhas da tabela Mendeleev. Vejamos esta evolução.
Procurar mais Tópicos sob Periódica de Classificação Dos Elementos
- Tentativas Anteriores de Classificação de Elementos
- a Posição dos Elementos na Moderna Tabela Periódica
- Tendências da Moderna Tabela Periódica
Utilizar Número Atômico
Primeiro, vamos dar uma olhada em um átomo da estrutura. Cada átomo é constituído por um núcleo constituído por protões e neutrões. Aqui os protões têm uma carga positiva e um neutrão não tem carga. Agora os elétrons (carregando uma carga negativa) rodeiam o núcleo. Agora o número de massa atômica é o número total de prótons e nêutrons em um átomo. E o número atômico é o número de prótons em um átomo. Este número atômico é completamente único para cada elemento, o que significa que cada elemento no planeta tem seu próprio número atômico único.foi Henry Moseley que sugeriu um arranjo melhor do que Mendeleev. Ele organizou os elementos de acordo com seu número atômico, em vez de sua massa atômica. Ao fazê-lo, melhorou em relação à mesa anterior e removeu algumas das suas dificuldades e anomalias.
posição do hidrogénio
Mendeleev nunca conseguiu descobrir a posição correcta do hidrogénio na sua tabela. Como o hidrogênio pode ganhar ou perder um elétron, ele pode encontrar um lugar no Grupo 1 ou 17. A sua configuração electrónica assemelha-se à dos metais alcalinos. Embora possa também combinar-se com metais e não-metais formando ligações covalentes como halogéneos.
mas na tabela periódica moderna, não há dilema. Uma vez que o número atômico de hidrogênio é 1 que é onde ele encontra seu lugar apropriado no início da tabela.isótopos
isótopos
isótopos são átomos diferentes de um elemento cada um dos quais tem o mesmo número de prótons, mas um número diferente de nêutrons em seus núcleos. Isto implica que, embora sua massa atômica varie, seu número atômico é o mesmo. Como por exemplo, o carbono-14 é um isótopo radioativo do átomo de carbono que tem oito nêutrons.
Considerando que isso apresentou um problema para Mendeleev, uma vez que a tabela dependia da massa atômica, não é um problema com a tabela periódica moderna. Todos os isótopos dos elementos não têm lugares separados na mesa.
ordem de certos elementos
Mendeleev quando usa massa atômica para organizar elementos enfrentaram outro problema. Houve certos casos em que houve uma quebra deste arranjo de modo que elementos com propriedades semelhantes estavam em um grupo juntos. Tome o exemplo de iodo e telúrio. Agora a massa atômica do iodo é menor que o telúrio. E mesmo assim Mendeleev colocou-o atrás do telúrio para que pudesse estar no mesmo grupo que o flúor e o cloro.
na tabela periódica moderna, a massa atômica torna-se irrelevante e os elementos são agrupados com elementos similares baseados em seu número atômico.
Elementos de terras Raras
A moderna tabela periódica resolveu outro problema colocando os elementos de terras raras, tais como o Cério, Lantânio, Érbio, etc em uma tabela separada na parte inferior da tabela Periódica, de modo a não interferir com o Periódico Lei.exemplo resolvido para si
Q: De todos os 118 elementos que conhecemos, quantos elementos ocorrem naturalmente?