porque a maioria dos novos íons hidróxido são removidos, o pH não aumenta muito.remoção dos íons de hidróxido reagindo com íons de hidrogênio lembre-se que existem alguns íons de hidrogênio presentes na ionização do ácido etanóico.
![]()
![]()
Assim que isso acontece, o equilíbrio dicas para substituí-los. Isto continua a acontecer até que a maioria dos íons de hidróxido são removidos.
![]()
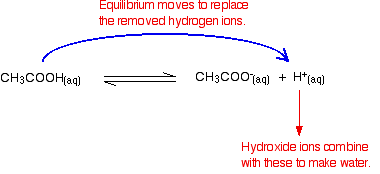
de novo, porque tem equilíbrios envolvidos, nem todos os íons de hidróxido são removidos – apenas a maioria deles. A água formou reionises em uma pequena extensão para dar alguns íons de hidrogênio e íons de hidróxido.
soluções alcalinas de tampão
vamos tomar uma mistura de amoníaco e soluções de cloreto de amónio como típico.amônia é uma base fraca, e a posição deste equilíbrio será bem à esquerda.:
![]()
![]()
adicionando cloreto de amónio a isto adiciona muitos iões de amónio extra. De acordo com o princípio de Le Chatelier, isso irá inclinar a posição do equilíbrio ainda mais para a esquerda.
a solução contém, portanto, estas coisas importantes:
-
lotes de amoníaco não reagido;
-
lotes de iões de amónio provenientes do cloreto de amónio;
hidróxido de sódio suficiente para tornar a solução alcalina.
outras coisas (como água e íons cloreto) que estão presentes não são importantes para o argumento.
adicionando um ácido a esta solução tampão
existem dois processos que podem remover os iões de hidrogénio que está a adicionar.a substância básica mais provável com a qual um íon de hidrogênio vai colidir é uma molécula de amônia. Eles vão reagir para formar íons de amônio.
![]()
![]()
a Maioria, mas não todos, os íons de hidrogênio, serão removidos. O íon amônio é fracamente ácido, e assim alguns dos íons de hidrogênio serão liberados novamente.remoção dos íons de hidrogénio por reacção com íons de hidróxido lembre-se que existem alguns íons de hidróxido presentes na reacção entre a amónia e a água.
![]()
![]()
hidrogénio iões podem combinar-se com estes íons hidróxido para produzir água. Assim que isso acontece, o equilíbrio inclina-se para substituir os íons hidróxido. Isso continua acontecendo até que a maioria dos íons de hidrogênio são removidos.
![]()
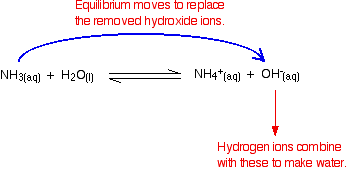
de Novo, porque você tem equilíbrios envolvidos, nem todos os íons de hidrogênio são removidas apenas a maioria deles.os íons hidróxido do álcali são removidos por uma simples reação com íons de amónio.
![]()
![]()
porque o amoníaco formado é uma base fraca, pode reagir com a água – e assim a reacção é ligeiramente reversível. Isso significa que, novamente, a maioria (mas não todos) dos íons hidróxido são removidos da solução.
Cálculos envolvendo soluções tampão
Esta é apenas uma breve introdução. Há mais exemplos, incluindo várias variações, mais de 10 páginas no meu livro de cálculos de química.soluções tampão ácidas
isto é mais fácil de ver com um exemplo específico. Lembre-se que um tampão ácido pode ser feito a partir de um ácido fraco e um de seus sais.suponhamos que tinha uma solução-tampão contendo 0, 10 mol dm-3 de ácido etanóico e 0.20 mol dm-3 de etanoato de sódio. Como você calcula seu pH?em qualquer solução que contenha um ácido fraco, existe um equilíbrio entre o ácido não ionizado e os seus íons. Assim, para ethanoic ácido, você tem o equilíbrio:
![]()
![]()
com A presença do ethanoate íons de sódio, ethanoate vai ter movido o equilíbrio para a esquerda, mas o equilíbrio ainda existe.isso significa que podes escrever a constante de equilíbrio, Ka, para ela.:
![]()
![]()
Onde você tem feito os cálculos usando esta equação anteriormente com um ácido fraco, você vai ter assumido que as concentrações de íons de hidrogênio e ethanoate íons foram os mesmos. Cada molécula de ácido etanóico que se divide dá um de cada tipo de íon.
isso já não é verdade para uma solução-tampão:
![]()
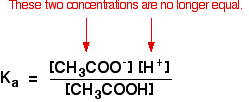
Se o equilíbrio foi empurrado ainda mais para a esquerda, o número de ethanoate íons provenientes do ethanoic ácido vai ser completamente insignificante em comparação com aqueles de sódio ethanoate.
portanto, supomos que a concentração iónica de etanoato é a mesma que a concentração do etanoato de sódio – neste caso, 0,20 mol dm-3.
em um cálculo ácido fraco, normalmente supomos que tão pouco do ácido ionizou que a concentração do ácido no equilíbrio é a mesma que a concentração do ácido que usamos. Isso é ainda mais verdade Agora que o equilíbrio foi movido ainda mais para a esquerda.
Então, os pressupostos que fazer para uma solução tampão são:
![]()
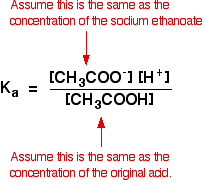
Agora, se conhecemos o valor de Ka, podemos calcular a concentração do íon de hidrogênio e, portanto, o pH.
Ka para ethanoic ácido é de 1,74 x 10-5 mol dm-3.lembre-se que queremos calcular o pH de uma solução tampão contendo 0,10 mol dm-3 de ácido etanóico e 0,20 mol dm-3 de etanoato de sódio.
![]()
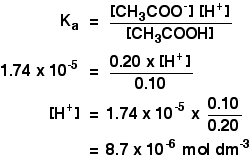
em Seguida, tudo que você tem a fazer é encontrar o pH utilizando a expressão
pH = -log10
Você continuará a ter o valor para a concentração do íon de hidrogênio na sua calculadora, por isso, prima o botão gravar e ignorar o sinal negativo (para permitir que o sinal de menos no pH expressão).
deve obter uma resposta de 5, 1 a duas figuras significativas. Você não pode ser mais preciso do que isso, porque suas concentrações foram dadas apenas a dois números.