Se você já estudou uma tabela periódica dos elementos (veja abaixo), você provavelmente já está ciente de que esta tabela revela muito sobre as propriedades químicas dos átomos que compõem o nosso mundo.
mas você pode não perceber que cada quadrado na tabela periódica realmente representa uma família de isótopos-átomos que compartilham o mesmo nome e propriedades químicas, mas têm massas diferentes.
para entender o que são isótopos e como podemos usá-los, precisamos dar uma olhada mais de perto no interior de um átomo.

blocos de Construção da matéria
Um átomo é composto de um incrivelmente denso núcleo (chamado de um núcleo) de prótons e nêutrons, rodeado por uma nuvem difusa de elétrons.
pode pensar em prótons e nêutrons como o mesmo tipo de partícula com uma diferença chave: os prótons são positivamente carregados, enquanto os nêutrons não carregam carga. Isto significa que os prótons podem “sentir” campos elétricos ou magnéticos, enquanto os nêutrons não podem.
os elétrons, que são muito mais leves que prótons ou nêutrons, carregam a mesma magnitude de carga que um próton, mas com o sinal oposto, o que significa que cada átomo que tem números iguais de prótons e elétrons é eletricamente neutro.
são os elétrons que determinam o comportamento químico de um determinado elemento.

Isotopes of an element share the same number of protons but have different numbers of neutrons. Vamos usar o carbono como exemplo.
Existem três isótopos de carbono encontrados na natureza – carbono-12, carbono-13 e carbono-14. Todos os três têm seis prótons, mas seus números de nêutrons – 6, 7, e 8, respectivamente-todos diferem. Isto significa que todos os três isótopos têm massas atômicas diferentes (carbono-14 Sendo o mais pesado), mas compartilham o mesmo número atômico (Z=6).quimicamente, todos os três são indistinguíveis, porque o número de elétrons em cada um destes três isótopos é o mesmo.
assim diferentes isótopos do mesmo elemento são idênticos, quimicamente falando. Mas alguns isótopos têm a capacidade de contornar esta regra, transformando-se em outro elemento inteiramente.
Marcha para a estabilidade
Este transformador capacidade de alguns isótopos têm a ver com o fato de nem todos os isótopos são estáveis, e é o que levou Frederick Soddy para seu ganhador do Prêmio Nobel de descoberta dos isótopos, em 1913.alguns isótopos-como o carbono – 12-continuarão alegremente a existir como carbono, a menos que algo extraordinário aconteça. Outros-carbono-14, digamos – irão em algum momento decair em um isótopo estável próximo.
neste caso, um dos neutrões do carbono-14 transforma-se num próton, formando azoto-14. Durante este processo, que é conhecido como decaimento beta, o núcleo emite radiação na forma de um elétron e um antineutrino.
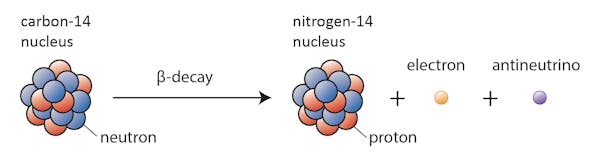
há muitos fatores que podem causar o decaimento de um núcleo. Um dos mais importantes é a razão entre prótons e nêutrons que um determinado núcleo tem. Se um núcleo tem muitos nêutrons (a definição de “muitos” depende de quão pesado o núcleo é), há uma chance de que ele irá decair para a estabilidade.
o mesmo é verdade se um núcleo tem muitos protões. Esta é uma das razões pelas quais alguns isótopos de um dado elemento são radioativos, enquanto outros não.
a partir das barrigas das estrelas
por esta altura, você pode estar se perguntando como todos esses isótopos foram criados em primeiro lugar. Ao que parece, esta questão é complexa, mas dá alguma verdade ao adágio de que somos todos feitos de poeira estelar.alguns dos isótopos mais leves foram formados muito cedo na história do universo, durante o Big Bang. Outros resultam de processos que acontecem dentro das estrelas ou como resultado de colisões aleatórias entre núcleos altamente energéticos – conhecidos como raios cósmicos – dentro da nossa atmosfera.
a maioria dos isótopos naturalmente existentes são o produto final (estável ou de longa duração) resultante de uma longa série de reações nucleares e decaimentos.
na maioria destes casos, núcleos de luz tiveram que quebrar junto com energia suficiente para permitir a força forte – uma ligação semelhante à cola que se forma quando prótons e nêutrons se aproximam o suficiente para tocar-para superar a força eletromagnética – que empurra prótons para longe. Se a força forte vencer, os núcleos de colisão se unem, ou se fundem, para formar um núcleo mais pesado. o nosso sol é um bom exemplo disso. Uma de suas principais fontes de energia é uma série de reações de fusão e processos de decaimento beta que transformam hidrogênio em hélio.

Transformar o conhecimento em ferramentas
Desde o início de 1900, quando a existência de isótopos primeiro foi realizado, físicos nucleares e químicos têm sido a busca de formas para estudar como os isótopos podem ser formados, como eles decadência, e como podemos usá-los.como se vê, a natureza dos isótopos – sua uniformidade Química, sua distintividade nuclear – os torna úteis para uma ampla gama de aplicações em campos tão diversos como medicina, Arqueologia, agricultura, geração de energia e Mineração.
Se você já teve uma tomografia, você se beneficiou de um subproduto do decaimento radioativo de certos isótopos (muitas vezes chamado de isótopos médicos). Nós produzimos esses isótopos médicos usando nosso conhecimento de como as reações nucleares se processam, com a ajuda de reatores nucleares ou aceleradores chamados ciclotrões.
mas também encontrámos formas de utilizar isótopos radioactivos naturais. A datação por carbono, por exemplo, faz uso do isótopo carbono-14 de longa duração para determinar a idade dos objetos. em circunstâncias normais, o carbono-14 é produzido na nossa atmosfera através de reacções de raios cósmicos com azoto-14. Tem uma meia-vida de aproximadamente 5.700 anos, o que significa que metade de uma quantidade de carbono-14 terá decaído nesse período de tempo.

Enquanto um organismo biológico está vivo, leva-se em cerca de um carbono-14 isótopos para cada trilhão estável carbono-12 e de isótopos do carbono 12 e carbono-14 proporção permanece sobre a mesma, enquanto o organismo vive. Uma vez que morre, a nova ingestão de carbono pára. isto significa a razão entre as alterações de carbono-14 e carbono-12 nos restos deste organismo ao longo do tempo.se extrairmos carbono usando métodos químicos de uma amostra, podemos então aplicar um método chamado espectrometria de massa do acelerador (AMS) para separar os isótopos de carbono individuais em peso.
AMS faz uso do fato de que partículas aceleradas com a mesma carga, mas massas diferentes seguem caminhos separados através de campos magnéticos. Ao fazer uso destes caminhos separados, podemos determinar rácios de isótopos com uma precisão incrível.
Como você pode ver a partir destes exemplos, nós aplicamos o nosso conhecimento de isótopos em uma variedade de maneiras. Produzimo-los, detectamo-los, extraímo-los, e estudamo-los com o duplo propósito de compreender porque o núcleo atómico se comporta como se comporta, e como podemos aproveitar o seu poder para nosso benefício.