Termos-Chave
certifique-se que você pode definir e usar no contexto, os termos-chave abaixo.
- Adams’ catalisador
- hidrogenação
Estudo
reações Químicas que são heterogêneos têm reagentes que estão em pelo menos duas fases diferentes (e.g. gás com uma sólida), enquanto homogênea reações ocorrem em uma única fase (e.g. gás com outro gás).
pode surgir alguma confusão a partir da descrição do catalisador utilizado na reacção entre alcenos e hidrogénio. Três metais-níquel, platina e paládio—são comumente usados, mas um químico não pode simplesmente colocar um pedaço de um desses metais em uma mistura de alqueno e hidrogênio e obter uma reação. Cada catalisador metálico deve ser preparado de uma forma especial:
- níquel é geralmente usado em uma forma finamente dividida chamada “níquel Raney”.”É preparado reagindo uma liga Ni-Al com NaOH.o paládio é obtido comercialmente “apoiado” numa substância inerte, como o carvão vegetal (Pd/C). O alceno é geralmente dissolvido em etanol quando Pd/C é usado como catalisador.
- platina é usado como PtO2, catalisador de Adams, embora seja na verdade metal de platina que é o catalisador. O hidrogênio usado para adicionar à ligação dupla carbono-carbono também reduz o óxido de platina (IV) a um metal de platina finamente dividido. Etanol ou ácido acético é usado como solvente para o alceno.outros tipos de compostos que contenham múltiplas ligações, tais como cetonas, ésteres e nitriles, não reagem ao hidrogénio nas condições utilizadas para hidrogenar os alcenos. The examples below show reduction of an alkene, but the ketone and nitrile groups present remain intact and are not reduced.

anéis aromáticos também não são reduzidos nas condições utilizadas para reduzir os alcenos, embora estes anéis pareçam conter três ligações duplas carbono-carbono. Como você verá mais tarde, anéis aromáticos realmente não contém quaisquer ligações duplas, e muitos químicos preferem representar o anel de benzeno como um hexágono com um círculo dentro de ti

ao invés de um hexágono com três ligações duplas alternadas.
a representação do anel de benzeno será discutida mais adiante na secção 15.2.
a reação entre ligações duplas carbono-carbono e hidrogênio fornece um método para determinar o número de ligações duplas presentes em um composto. Por exemplo, uma mole de ciclohexeno (d reage com um mol de hidrogênio para produzir um mol de ciclo-hexano:

mas uma mole de 1,4-cyclohexadiene reage com dois moles de hidrogênio para formar um mol de ciclo-hexano:
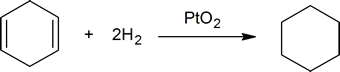
Um químico diria que ciclohexeno (d reage com um equivalente de hidrogênio, e 1,4-cyclohexadiene reage com dois equivalentes de hidrogênio. Se você pegar uma quantidade conhecida de um hidrocarboneto insaturado desconhecido e determinar a quantidade de hidrogênio que ele irá absorver, você pode facilmente determinar o número de ligações duplas presentes no hidrocarboneto (ver pergunta 2, abaixo).
adição de hidrogénio a uma ligação dupla carbono-carbono é chamada hidrogenação. O efeito global de tal adição é a remoção redutiva do grupo funcional de dupla ligação. Regioseletividade não é uma emissão, Uma vez que o mesmo grupo (um átomo de hidrogênio) Está ligado a cada um dos carbons de dupla ligação. A fonte mais simples de dois átomos de hidrogênio é hidrogênio molecular (H2), mas misturar alcenos com hidrogênio não resulta em qualquer reação discernível. Embora a reação de hidrogenação geral seja exotérmica, uma alta energia de ativação impede que ocorra em condições normais. Esta restrição pode ser contornada pelo uso de um catalisador, como mostrado no diagrama seguinte.
um exemplo de uma reacção de adição de alceno é um processo chamado hydrogenation.In a hydrogenation reaction, two hydrogen atoms are added across the double bond of an alkene, resulting in a saturated alkane. A hidrogenação de uma ligação dupla é uma reação termodinamicamente favorável porque forma um produto mais estável (menor energia). Em outras palavras, a energia do produto é menor que a energia do reagente; assim, é exotérmica (o calor é liberado). O calor liberado é chamado de calor da hidrogenação, que é um indicador da estabilidade de uma molécula.


são substâncias que alteram a velocidade de uma reacção química sem serem consumidos ou aparecerem como parte do produto. Os catalisadores agem baixando a energia de ativação das reações, mas não alteram a energia potencial relativa dos reagentes e produtos. Metais finamente divididos, como platina, paládio e níquel, estão entre os catalisadores de hidrogenação mais amplamente utilizados. A hidrogenação catalítica ocorre em pelo menos duas fases, como descrito no diagrama. Em primeiro lugar, o alceno deve ser adsorvido na superfície do catalisador juntamente com algum do hidrogênio. Em seguida, dois hidrogénios mudam da superfície de metal para os carbonos da dupla ligação, e o hidrocarboneto saturado resultante, que é mais fraco adsorvido, deixa a superfície do catalisador. A natureza exacta e o calendário dos últimos acontecimentos não são bem compreendidos.

conforme mostrado no diagrama de energia, a hidrogenação dos alcenos é exotérmica, e o calor é liberado correspondente ao ΔE (verde colorido) no diagrama. Este calor de reação pode ser usado para avaliar a estabilidade termodinâmica de alcenos com diferentes números de substituintes de alquilo na ligação dupla. Por exemplo, o quadro que se segue enumera as bacias de hidrogenação de três alcenos C5H10 que produzem o mesmo produto de alcano (2-metilbutano). Uma vez que um grande calor de reação indica um reagente de alta energia, estes aquecimentos são inversamente proporcionais às estabilidades dos isômeros de alceno. Para uma aproximação áspera, vemos que cada substituinte alquilo em uma ligação dupla estabiliza este grupo funcional em um pouco mais de 1 kcal/mole.
| Alkene Isomer | (CH3)2CHCH=CH2 3-methyl-1-butene |
CH2=C(CH3)CH2CH3 2-methyl-1-butene |
(CH3)2C=CHCH3 2-methyl-2-butene |
|---|---|---|---|
| Heat of Reaction ( ΔHº ) |
–30.3 kcal/mole | –28.5 kcal/mole | –26.9 kcal/mole |

do mecanismo mostrado aqui seria de esperar que a adição de hidrogênio ocorra com sin-estereoseletividade. Isto é muitas vezes verdade, mas os catalisadores de hidrogenação também podem causar isomerização da dupla ligação antes da adição de hidrogênio, caso em que a estereosseletividade pode ser incerta.

Exercícios
- Na reação
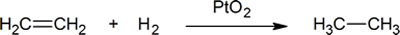
- 0.500 mol de eteno reage com _______ mol de hidrogênio. Assim, um químico pode dizer que eteno reage com um _ _ _ _ _ _ _ _ de hidrogênio.
- ethene is being __________; while _ _ _ _ _ _ _ _ _ _ _ está a ser oxidado.
- o número de oxidação do carbono no eteno é ________; no etano é________.quando 1000 g de um determinado triglicérido (tecido adiposo) é tratado com gás hidrogénio na presença do catalisador de Adams, verifica-se que o volume de hidrogénio consumido a 99,8 kPa e 25,0°C é de 162 mL. Um experimento separado indica que a massa molar da gordura é 914 g mol-1. Quantas ligações duplas carbono-carbono o composto contém?
Resposta:
-
-
Mostrar Resposta
-
Mostrar resposta
-
Show Answer
-
-
Mostrar Resposta
Examples
Question
Predict the products if the following alkenes were reacted with catalytic hydrogen.

Solution

Contributors
- Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
- Prof. Steven Farmer (Sonoma State University)
- Química Orgânica com ênfase biológica por Tim Soderberg (University of Minnesota, Morris)