plasticidade muscular
músculo esquelético é o maior tecido do corpo. É altamente plástico e pode sofrer oscilações não-patológicas dramáticas em massa e força em resposta a uma miríade de influências ambientais. Após exercício de resistência ou exposição a esteróides anabolizantes, os músculos sofrem hipertrofia e aumentam a sua massa, área transversal e força (Aagaard, 2004).; Schiaffino et al., 2013). Estes mesmos parâmetros podem declinar vertiginosamente, quando os músculos iniciar atrofia em resposta a qualquer dos variedade de insultos, que incluem: a fome, a denervation, imobilização, sepse, câncer, caquexia, insuficiência cardíaca, diabetes, insuficiência renal, doença pulmonar obstrutiva crônica e a síndrome da imunodeficiência adquirida (Schiaffino et al., 2013).as consequências da atrofia têm implicações óbvias para a saúde. A fraqueza muscular é um dos principais factores de mortalidade e morbilidade e está associada ao aumento do risco de todas as causas de morte (Metter et al., 2002). Na verdade, a redução da atrofia muscular na caquexia cancerosa pode prolongar significativamente a vida (Zhou et al., 2010). Além disso, muitos indivíduos mais velhos sofrem de sarcopenia, um transtorno de desperdício muscular prolongado que normalmente começa após a idade de 50 e envolve uma perda de cerca de 1% da massa muscular por ano (Woo, 2017). Isto significa que aos 80 anos, os indivíduos sarcopênicos perderam cerca de 40% de sua massa muscular, um fator chave em quedas, fragilidade e admissões em lares de idosos. Consequentemente, compreender os mecanismos e as potenciais respostas terapêuticas à atrofia é de amplo interesse básico e clínico (Ali e Garcia, 2014; Cohen et al., 2015; Ziaaldini et al., 2017).
a hipótese do domínio Myonuclear
o músculo esquelético é bastante único na medida em que as células maduras são sinciciais e podem conter centenas de núcleos. Esta é uma adaptação necessária dado que as fibras musculares individuais podem ser enormes, alcançando comprimentos de até ~600 mm (23 in) (por exemplo, músculo sartorius; Yang et al., 1998) e volumes que podem ser mais de 100.000 vezes maiores que uma célula mononucleada típica (Bruusgaard et al., 2003). As contribuições de múltiplos núcleos são necessárias para produzir grandes quantidades de mRNA necessárias para dirigir a prodigiosa síntese proteica necessária para gerar e manter o aparelho contráctil (Nevalainen et al., 2013).tanto a natureza plástica do músculo como a sua organização sincicial deram origem a uma Controvérsia que só recentemente parece ter sido resolvida—a “hipótese do domínio myonuclear” (Qaisar e Larsson, 2014; Gundersen, 2016; Schwartz et al., 2016). Esta teoria tem suas origens no conceito de “wirkungssphäre” ou “esfera de influência” proposto por Strassburger (1893), no qual ele argumentou que um núcleo só pode suportar um volume discreto de citoplasma, definindo assim os limites superiores ao tamanho das células. Este princípio foi mais elaborado por Gregory (2001), que argumentou que o conteúdo e o volume do ácido desoxirribonucleico celular estão estreitamente ligados. A natureza sincicial do músculo esquelético ajuda estas células a superar esta limitação. A hipótese do domínio myonuclear dita que, a fim de manter a razão nuclear-citoplasmática adequada, novos núcleos são adicionados durante a hipertrofia e perdidos com atrofia.existem dados substanciais que demonstram que o número nuclear aumenta com a hipertrofia muscular (Moss, 1968; Cabric and James, 1983; Egner et al., 2016), embora reste alguma controvérsia (Murach et al., 2018). Este processo tem sido uma área de intensa investigação e alguns dos mecanismos moleculares subjacentes que regulam a aquisição de novos núcleos durante a hipertrofia foram definidos recentemente (Guerci et al., 2012; Bentzinger et al., 2014; Ross et al., 2018). Estes núcleos supranumerários são adquiridos quando células estaminais restritas à linhagem, normalmente células satélites, se fundem com fibras musculares e contribuem com seus núcleos (Brack e Rando, 2012; Bachman et al., 2018). Células satélite residem sob a membrana basilar e abut o sarcolemma (Katz, 1961; Mauro, 1961). Eles permanecem Quiescentes até serem estimulados por esteróides anabolizantes como testosterona ou por lesão focal após o exercício de resistência, em que eles reentram no ciclo celular e proliferam (Joubert e Tobin, 1995; Abreu et al., 2017). Algumas das células filhas fundem-se com a fibra muscular e facilitam a reparação e o crescimento, enquanto outras prendem e reconstituem a piscina satélite (Dumont et al., 2015; Goh and Millay, 2017). As restantes células excedentárias passam por apoptose (Schwartz, 2008).
O aspecto controverso da hipótese do domínio myonuclear é a afirmação de que os myonucleos são perdidos durante a atrofia. Existem muitas intervenções que induzem atrofia em modelos animais, incluindo: imobilização, denervação e sépsis (Fitts et al., 1986; Minnaard et al., 2005; O’Leary et al., 2012). Em cada caso, verifica-se uma perda líquida da área transversal do músculo (o doseamento primário) e do aparecimento de células apoptóticas no tecido (McCall et al., 1998; Smith et al., 2000; Strasser et al., 2000; Alway et al., 2003; McClung et al., 2007; Andrianjafiniony et al., 2010; Guo et al., 2012; Palumbo et al., 2012; Barnes et al., 2015; Cheema et al., 2015; Li et al., 2016; Kletzien et al., 2018). Nestes estudos, a apoptose é medida numa variedade de métodos, incluindo activação da caspase, libertação mitocondrial de EndoG, ou fragmentação do ADN . Estes estudos fornecem dados convincentes de que a apoptose aumenta dramaticamente durante a fase inicial da atrofia. Por exemplo, num estudo recente e abrangente (Guo et al., 2012), Guo et al. o ratinho foi submetido a 14 dias de suspensão no traseiro, um tratamento que resultou numa redução de ~69% no peso húmido muscular e numa redução de ~43,8% na área da secção transversal em relação ao músculo contralateral não pilotado. Os autores também quantificaram uma série de marcadores de apoptose, incluindo coloração de TUNEL, clivagem/ativação da caspase-3, e a clivagem da Poli(adenosina difosfato ribose) polimerase (PARP), uma proteína envolvida na reparação do DNA. Cada uma destas medidas de apoptose aumentou significativamente após a suspensão posterior. Enquanto o foco principal deste artigo era avaliar o impacto positivo da estimulação elétrica na limitação da atrofia após um insulto, eles e muitos outros pesquisadores interpretam esse tipo de dados como fornecendo forte apoio para a hipótese do domínio myonuclear.
de uma perspectiva biológica celular, a perda presumível de núcleos dentro de um tecido sincicial como o músculo esquelético apresenta um grande problema prático. Como pode um núcleo individual ficar tão comprometido que seu genoma rapidamente condensa e fragmenta enquanto seus vizinhos persistem e ajudam a manter a viabilidade da fibra muscular? Dado que a apoptose é tipicamente mediada pela activação da classe das proteases cisteína conhecidas como caspases, não é claro que mecanismo pode servir para restringir a actividade de uma protease difusível dentro de um citoplasma comum.esta questão tem sido abordada indiretamente em outro tipo de células sinciciais, o sincitiotrofoblasto humano, um tecido que envolve a placenta e contém cerca de 5 × 1010 núcleos (Mayhew et al., 1999). Quando a apoptose é induzida no sincitiotrofoblasto, propaga-se como uma onda a uma taxa de cerca de 5 mícrons por minuto até que todo o tecido esteja envolvido (Longtine et al., 2012). Consequentemente, não há regiões “privilegiadas” dentro do citoplasma sincicial e todos os núcleos são finalmente destruídos.
Um dos principais desafios com a análise da apoptose no músculo esquelético é que é um tecido muito heterogêneo, onde aproximadamente metade de seus núcleos residem fora das fibras musculares (Schmalbruch e Hellhammer, 1977). Estas células mononucleadas incluem células satélites, células endoteliais, fibroblastos, pericitos e macrófagos (Tedesco et al., 2010). Consequentemente, é muito difícil determinar qual o lado do sarcolemma, um núcleo reside, e, portanto, se é um verdadeiro mionucleo.
in Vivo Time-Lapse Imaging of Labeled Mouse Muscle Fibers
Despite the large number of papers demonstrating apoptosis during muscle atrophy, several authors have questioned these results (Wada et al., 2002; Zhong et al., 2005; Aravamudan et al., 2006; Gundersen and Bruusgaard, 2008; Duddy et al., 2011; Qaisar e Larsson, 2014). Por exemplo, usando fibras musculares isoladas in vitro, Duddy et al. observou que, enquanto o volume da fibra muscular diminuiu ao longo do tempo, refletivo de um processo atrófico, o número de mionucleos parecia ser estável (Duddy et al., 2011).em uma série de experimentos elegantes, o laboratório Gundersen injetou fibras musculares extensoras individuais (EDL) ou dos músculos soleus com corantes que independentemente rotularam os núcleos e citoplasma em ratos anestesiados (Bruusgaard e Gundersen, 2008; Bruusgaard et al., 2010). Isso permitiu-lhes identificar cada núcleo dentro de fibras musculares individuais in vivo ao longo do tempo e, em seguida, avaliar o seu destino. Por exemplo, os músculos EDL foram induzidos a hipertrofia pela ablação de seus principais sinérgicos (Bruusgaard et al., 2010). Entre os dias 6 e 11, O número de mionúcleos aumentou cerca de 54% e entre os dias 9 e 14 houve um aumento de 35% na área transversal (Figura 1). Estes dados são consistentes com a hipótese de que os músculos adquirem núcleos supranumerários antes do maior crescimento da fibra durante a hipertrofia.

Figura 1. Os myonucleos são adquiridos durante a hipertrofia, mas não se perdem durante a atrofia no rato. Micrografos da mesma fibra muscular EDL ao longo do tempo, após a indução de hipertrofia (linha superior) e a subsequente indução de atrofia (linha inferior). Oligonucleótidos fluorescentemente rotulados foram usados para visualizar os núcleos in vivo. As linhas pontilhadas representam o sarcolemma. Barra de escala = 50 µm. (Adaptado de Bruusgaard et al., 2010. Usado por permissão dos trabalhos da Academia Nacional de Ciências.)
em seguida, examinaram o destino destes mononucleos únicos identificáveis nas mesmas fibras musculares quando foram induzidos a sofrer atrofia. A denervação levou a uma redução de aproximadamente 50% no volume de fibras musculares, mas nenhuma perda de mionucleos (Figura 1; Bruusgaard et al., 2010). A inobservância nuclear perda não foi devido à atrofia estímulo empregado, desde que obtidos os mesmos resultados, quando os músculos foram induzidos a atrofia em resposta a tetrodotoxin induzida pelo bloqueio do nervo, hindlimb suspensão, câncer, caquexia, ou o cancelamento do treinamento (Bruusgaard e Gundersen, 2008; Bruusgaard et al., 2010; Winje et al., 2018a). Na verdade, durante o curso de seus estudos, eles examinaram mais de 200.000 individuais myonuclei em atrofia os músculos e observado apenas 4 TUNEL-positivos (apoptótico) núcleos, o que representa uma perda de apenas ~0.002% dos núcleos (Bruusgaard et al., 2012). Estes dados apoiam fortemente a hipótese de que a atrofia do músculo esquelético não é acompanhada pela morte mionuclear.por mais poderosos que estes estudos sejam, existem algumas limitações inerentes ao uso de modelos de mamíferos. Em primeiro lugar, eles invariavelmente dependem de intervenções experimentais como a denervação para induzir atrofia muscular. Em segundo lugar, o músculo contralateral é tipicamente usado como um controle interno, embora também seja exposto a alguns dos mesmos sinais ambientais, tais como hormônios de estresse (Bonaldo e Sandri, 2013). Por último, os músculos esqueléticos também podem sofrer morte celular programada (PCD) durante o desenvolvimento, e estes modelos raramente abordam o papel da apoptose nestas células.
Um modelo alternativo que não sofre de nenhuma destas limitações, e permite o estudo de núcleos musculares durante a atrofia e ocorrência natural de PCD, é o músculo intersegmental (ISM) do hawkmoth Manduca sexta. Os ismos são compostos por folhas de fibras musculares gigantes, onde cada célula tem cerca de 5 mm de comprimento e até 1 mm de diâmetro (figura 2A). Os ismos se ligam aos limites segmentais dentro do abdômen e geram o comportamento rastejante das larvas e o comportamento eclosivo (emergência) da traça adulta quando ela escapa da cutícula pupal no final da metamorfose.
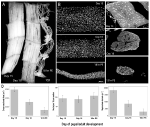
Figura 2. Retenção de myonucleos durante a atrofia e morte dos músculos intersegmentais (ISMs) da mariposa Manduca sexta. A) ismos de três fases de desenvolvimento: homeostáticos (dias 15 de desenvolvimento pupal-adulto; esquerda); atróficos (dia 18; Meio); e morrer (18 h pós-eclosão; direita). A barra de escala é igual a ~1 mm (adaptado de Schwartz et al., 2016). B) os ISMs destes mesmos estádios de desenvolvimento foram limpos e manchados com o corante Nuclear DAPI e visualizados através de Microscopia confocal (adaptado de Schwartz et al., 2016). C) as secções de fibras ISM (10 µm) foram manchadas com o corante nuclear DAPI. Observe a perda dramática de proteína muscular (área cinzenta clara) durante a atrofia e morte, mas a retenção de núcleos em todas as fases (adaptado de Schwartz et al., 2016). (D) quantificação do volume de fibras ISM (esquerda), número nuclear (meio), e tamanho do domínio myonuclear (direita) durante a homeostase, atrofia e morte. (Erro médio ± padrão.) (Adaptado de Schwartz et al., 2016).
No dia 15 dos 18 dias normais de desenvolvimento pupal-adulto, o ISMs inicia um programa de atrofia com efeito hormonal que resulta numa perda de massa de 40% no momento da eclosão 3 dias depois (figura 2A; Schwartz e Truman, 1983). Esta perda dramática de massa muscular é equivalente à observada em indivíduos de 80 anos de idade com sarcopenia, mas ocorre ao longo de 3 dias em vez de 30 anos. Enquanto os ISMs perdem massa, eles retêm propriedades fisiológicas normais, tais como potencial de repouso e força/área transversal (Schwartz e Ruff, 2002). Os ISMs são usados para gerar o comportamento eclosivo no final do dia 18 e, em seguida, iniciar PCD, ambos os quais são desencadeados por um hormônio peptídico (Schwartz e Truman, 1982, 1983). .em contraste com os músculos dos mamíferos, os ismos não contêm Capilares, células satélites, células endoteliais ou pericitos, o que significa que praticamente todos os núcleos do tecido residem dentro das próprias fibras musculares (Beaulaton e Lockshin, 1977). Usamos dois métodos independentes para monitorar o destino nuclear durante atrofia e morte neste modelo (Schwartz et al., 2016). O primeiro foi uma abordagem anatômica padrão. Quando os ISMs sofrem atrofia e morte, há reduções dramáticas tanto no volume quanto na área transversal das fibras, mas, grosseiramente, o número nuclear permaneceu inalterado (figura 2B). Usando tecidos seccionados para estudos quantitativos, descobrimos que houve uma redução de cerca de 49% na área transversal da fibra durante a atrofia e um novo declínio de 30% durante os estágios iniciais da morte (figuras 2C,D; Schwartz et al., 2016). No entanto, o número de núcleos não mudou durante este mesmo período, O que significa que houve uma redução funcional de 84% no domínio myonuclear.
O segundo método utilizado foi medir o teor de ADN das fibras musculares individuais dos animais no dia 13, quando os músculos são homeostáticos, até 18 h após a eclosão, quando os músculos são altamente degenerados (Schwartz et al., 2016). Quantificámos o teor de ADN de 420 células individuais e descobrimos que não houve perda significativa durante o desenvolvimento. Estas análises bioquímicas concordam bem com os dados anatômicos e sugerem que a concentração relativa de ambos os núcleos e DNA genômico funcionalmente aumentou à medida que os músculos atrofiavam e morriam. Consequentemente, dados de ratos e mariposas sugerem que os núcleos musculares não sofrem de apoptose durante a atrofia (ou PCD) e leva à conclusão de que a hipótese do domínio myonuclear deve ser rejeitada.
conclusões
estas observações têm uma série de implicações para a compreensão da biologia básica do músculo e para o desenvolvimento de potenciais intervenções terapêuticas. Embora existam dados substanciais que relatam a presença de núcleos apoptóticos no tecido após insultos atróficos, dados recentes sugerem que estes não são myonucleos verdadeiros, mas sim, células mononucleares condenadas que residem fora da fibra muscular. A principal razão para esta discrepância é que as ferramentas tradicionais usadas para detectar apoptose não têm a resolução necessária para determinar adequadamente qual o lado do sarcolemma uma célula moribunda reside. Métodos que rotulam myonuclei especificamente, quer através de injecções in vivo de corantes fluorescentes (Bruusgaard e Gundersen, 2008) quer através de manipulações genéticas para expressar proteínas marcadores (Duddy et al., 2011), reveal few if any apoptotic nuclei within the labeled fibers. A recente demonstração de que os anticorpos dirigidos contra a proteína Pericentriolar Material 1 (PCM1) rotulam apenas mionuclei autênticos oferece uma ferramenta promissora que pode ser aplicada aos materiais histológicos tradicionais que são regularmente analisados no campo (Winje et al., 2018b).não é surpreendente a incapacidade dos músculos esqueléticos de utilizarem a apoptose como mecanismo para eliminar os mionúcleos. Parece que o músculo esquelético maduro é, em grande parte, impedido de iniciar apoptose, na medida em que ele eleva a expressão de proteínas de sobrevivência potentes, como inibidor de ligação X da proteína de apoptose (XIAP) (Smith et al., 2009) and apoptosis repressor with caspase recruitment domain (ARC) (Xiao et al., 2011), enquanto simultaneamente expressando baixos níveis de mediadores de apoptose como o fator ativador da protease apoptótica 1 (APAF-1) (Burgess et al., 1999). Isso faz sentido teleologicamente, uma vez que os músculos estão sujeitos a perturbações extremas, incluindo a ruptura do sarcolemma após um exercício intenso, então seria catastrófico se eles despoletassem a morte celular ao invés de iniciar a reparação de tecidos e possivelmente hipertrofia. Como outras células terminalmente diferenciadas, os músculos tendem a empregar mecanismos não apoptóticos, mais notavelmente PCD autofágico (também conhecido como degeneração Tipo II) (Clarke, 1990; Schwartz et al., 1993; Kole et al., 2013; Ginet et al., 2014) quando morrem durante o desenvolvimento.mesmo que houvesse um mecanismo pelo qual os músculos pudessem atingir seletivamente núcleos individuais, não é claro que isso seria benéfico. De facto, a retenção de núcleos “excedentários” durante a atrofia confere uma vantagem distinta ao indivíduo, uma vez que os músculos esqueléticos sofrem frequentemente ciclos de atrofia e hipertrofia em resposta a condições ambientais como a disponibilidade de alimentos. A capacidade de se recuperar rapidamente utilizando myonuclei pré-existentes pode servir um papel importante na adaptação (Jackson et al., 2012) e ajudar a explicar o fenômeno da memória muscular (Staron et al., 1991; Gundersen, 2016). Está bem documentado no campo da fisiologia do exercício que é muito mais fácil readquirir um certo nível de aptidão muscular através do exercício do que era para alcançá-lo o primeiro lugar, mesmo que tenha havido um longo período de abstinência. Em outra palavra, a frase “use-a ou perca-a” pode ser mais precisamente articulada como “use-A ou perca-a, até que você trabalhe nela novamente.”Isso foi demonstrado diretamente por outro experimento do Laboratório Gundersen que demonstrou que uma vez que um músculo tenha adquirido novos núcleos, ele os retém muito depois que o estímulo hipertrófico é removido. Induziram hipertrofia muscular em ratinhos fêmea ao tratá-los durante 2 semanas com testosterona e depois examinaram os músculos 3 semanas após a retirada dos esteróides (Egner et al., 2013). O volume muscular voltou à linha de base, mas os núcleos recentemente adquiridos persistiram mesmo 3 meses depois. Quando os músculos foram submetidos a sobrecarga para reiniciar hipertrofia, os tratados com Esteróides rapidamente passaram por um aumento de 36% no volume de fibras, enquanto os músculos de controle cresceram apenas 6%. Estes dados sugerem que os núcleos” excedentários ” poderiam ser mobilizados rapidamente para facilitar a reciclagem.estas observações têm implicações potenciais para a Política de saúde pública. Tem sido demonstrado que o crescimento muscular, a função fisiológica e a capacidade regenerativa diminuem com a idade, em grande parte devido à redução da proliferação celular por satélite (Blau et al., 2015). Consequentemente, o exercício durante a adolescência, quando o crescimento muscular é reforçada por hormônios, a alimentação e o robusta por satélite piscina, pode funcionalmente servem para permitir que os indivíduos “banco” myonuclei que poderia ser utilizada mais tarde na vida para diminuir os efeitos do envelhecimento e, possivelmente, evitar a sarcopenia.além disso, estes dados têm implicações na área dos desportos competitivos. O uso de esteróides anabolizantes é um estímulo potente para hipertrofia muscular e a adição de novos myonucleos (Egner et al., 2013). Uma vez que estes núcleos persistem muito tempo após o fim do uso de esteróides, os atletas provavelmente derivam os benefícios do uso ilegal de drogas sem o risco de detecção.
em resumo, enquanto a adição de novos núcleos com crescimento muscular é amplamente aceita, a perda apoptótica de núcleos com atrofia não pode ser suportada, sugerindo que a interpretação estrita da hipótese do domínio myonuclear não pode ser suportada. Em vez disso, parece que uma vez adquirido, myonucleos persistem mesmo quando um músculo se torna atrófico ou inicia a morte celular.
contribuições do autor
o autor confirma ser o único contribuinte desta obra e aprovou-a para publicação.
financiamento
o trabalho para esta publicação foi apoiado por fundos do Eugene M. e Ronnie Isenberg Professorship Endowment. Não foi prestado apoio empresarial ao autor e não foram mencionados nem aprovados produtos comerciais.
Declaração de conflito de interesses
o autor declara que a investigação foi realizada na ausência de quaisquer relações comerciais ou financeiras que possam ser interpretadas como um potencial conflito de interesses.
agradecimentos
o autor gostaria de agradecer à Sra. Christine Brown pela assistência na preparação deste manuscrito e a dotação de Apoio de Eugene M. e Ronnie Isenberg.
Aagaard, P. (2004). Tornando os músculos “mais fortes”: exercício, nutrição, drogas. J. Musculosquelet. Neuronal. Interagir. 4, 165–174.
PubMed Abstract/Google Scholar
Abreu, P., Mendes, S. V., Ceccatto, V. M., and Hirabara, S. M. (2017). Ativação celular por satélite induzida por adaptação muscular aeróbica em resposta ao exercício de resistência em humanos e roedores. Life Sci. 170, 33–40. doi: 10.1016 / j. lfs.2016.11.016
PubMed Abstract | CrossRef Full Text/Google Scholar
Ali, S., and Garcia, J. M. (2014). Sarcopenia, cachexia e envelhecimento: diagnóstico, mecanismos e opções terapêuticas—uma mini-revisão. Gerontology 60, 294-305. doi: 10.1159 / 000356760 PubMed Abstract | CrossRef Full Text/Google Scholar
Alway, S. E., Martyn, J. K., Ouyang, J., Chaudhrai, A., and Murlasits, Z. S. (2003). Id2 expression during apoptosis and satellite cell activation in unloaded and loaded quail skeletal muscles. Am. J. Physiol. Regul. Integr. Comp. Physiol. 284, R540–R549. doi: 10.1152/ajpregu.00550.2002
PubMed Abstract | CrossRef Full Text | Google Scholar
Andrianjafiniony, T., Dupre-Aucouturier, S., Letexier, D., Couchoux, H., and Desplanches, D. (2010). Oxidative stress, apoptosis, and proteolysis in skeletal muscle repair after unloading. Am. J. Phys. Cell Physiol. 299, C307–C315. doi: 10.1152/ajpcell.00069.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
Aravamudan, B., Mantilla, C. B., Zhan, W. Z., and Sieck, G. C. (2006). Efeitos de denervação no domínio myonuclear do tamanho das fibras de diafragma de rato. J. Appl. Physiol. 100, 1617–1622. doi: 10.1152 / japplphysiol.01277.2005
CrossRef Texto Completo | Google Scholar
Bachman, J. F., Klose, A., Liu, W., Paris, N. D., Blanc, R. S., Schmalz, M., et al. (2018). O crescimento do músculo esquelético na pré-puberdade requer uma contribuição myonuclear derivada de células-satélite de Pax 7. Desenvolvimento 145: 167197.
Google Scholar
Barnes, B. T., Confides, A. L., Rich, M. M., and Dupont-Versteegden, E. E. (2015). Vias apoptóticas musculares distintas são ativadas em músculos com diferentes tipos de fibras em um modelo de rato de doença crítica miopatia. J. Muscle Res. Cell Motil. 36, 243–253. doi: 10.1007 / s10974-015-9410-8
PubMed Abstract | CrossRef Full Text/Google Scholar
Beaulaton, J., and Lockshin, R. A. (1977). Ultrastrutural study of the normal degeneration of the intersegmental muscles of Anthereae polyphemus and Manduca sexta (insecta, lepidoptera) with particular reference of cellular autophagy. J. Morphol. 154, 39–57. doi: 10.1002 / jmor.1051540104
PubMed Abstract | CrossRef Full Text | Google Scholar
Bentzinger, C. F., von Maltzahn, J., Dumont, N. A., Stark, D. A., Wang, Y. X., Nhan, K., et al. (2014). O Wnt 7a estimula a motilidade das células estaminais miogénicas e a engraxação, resultando numa melhoria da força muscular. J. Cell Biol. 205, 97–111. doi: 10.1083 / jcb.201310035
PubMed Abstract | CrossRef Full Text/Google Scholar
Blau, H. M., Cosgrove, B. D., and Ho, A. T. (2015). O papel central das células estaminais musculares na falha regenerativa com o envelhecimento. Conversao. Med. 21, 854–862. doi: 10.1038 / nm.3918
PubMed Abstract | CrossRef Full Text | Google Scholar
Bonaldo, P., and Sandri, M. (2013). Mecanismos Celulares e moleculares de atrofia muscular. S. Modelo. Mecanico. 6, 25–39. doi: 10.1242/dmm.010389
CrossRef Full Text | Google Scholar
Brack, A. S., and Rando, T. A. (2012). Células estaminais específicas do tecido: lições da célula satélite do músculo esquelético. Células Estaminais 10, 504-514. doi: 10.1016 / j. stem.2012.04.001
PubMed Resumo | CrossRef Texto Completo | Google Scholar
Bruusgaard, J. C., Egner, I. M., Larsen, T. K., Dupre-Aucouturier, S., Desplanches, D., e Gundersen, K. (2012). Não há alteração no número myonuclear durante a descarga muscular e recarga. J. Appl. Physiol. 113, 290–296. doi: 10.1152 / japplphysiol.00436.2012
PubMed Abstract / CrossRef Full Text | Google Scholar
Bruusgaard, J. C., and Gundersen, K. (2008). A microscopia in vivo com intervalo de tempo não revela perda de myonucleos murinos durante semanas de atrofia muscular. J. Clin. Investir. 118, 1450–1457. Doi: 10.1172/JCI34022
PubMed Abstract | CrossRef Full Text/Google Scholar
Bruusgaard, J. C., Johansen, I. B., Egner, I. M., Rana, Z. A., and Gundersen, K. (2010). Os myonucleos adquiridos pelo exercício de sobrecarga precedem a hipertrofia e não se perdem no treino. Procedimento. Natl. Acad. Ciência. U. S. A. 107, 15111-15116. doi: 10.1073 / pnas.0913935107
CrossRef Full Text | Google Scholar
Bruusgaard, J. C., Liestol, K., Ekmark, M., Kollstad, K., and Gundersen, K. (2003). Número e distribuição espacial de núcleos nas fibras musculares de ratinhos normais estudados in vivo. J. Physiol. 551, 467–478. doi: 10.1113 / jphysiol.2003.045328
PubMed Resumo | CrossRef Texto Completo | Google Scholar
Burgess, D. H., Svensson, M., Dandrea, T., Gronlund, K., Hammarquist, F., Orrenius, S., et al. (1999). Os citosóis do músculo esquelético humano são refractários à activação dependente do citocromo C das caspases do tipo II e carecem de APAF-1. A Morte Celular É Diferente. 6, 256–261. doi: 10.1038 / sj.cdd.4400489
PubMed Abstract | CrossRef Full Text/Google Scholar
Cabric, M., and James, N. T. (1983). Análises morfométricas dos músculos dos cães treinados e não treinados. Manha. J. Anat. 166, 359–368. doi: 10.1002 / aja.1001660309
PubMed Abstract | CrossRef Full Text | Google Scholar
Cheema, N., Herbst, A., McKenzie, D., and Aiken, J. M. (2015). Apoptose e necrose mediam a perda de fibras musculares esqueléticas nas anomalias enzimáticas mitocondriais induzidas pela idade. Aging Cell 14, 1085-1093. doi: 10.1111 / acel.12399
PubMed Abstract | CrossRef Full Text/Google Scholar
Clarke, P. G. (1990). Morte celular no desenvolvimento: diversidade morfológica e múltiplos mecanismos. Anat. Embriol. 181, 195–213.
Google Scholar
Cohen, S., Nathan, J. A., and Goldberg, A. L. (2015). Perda de músculos em doenças: mecanismos moleculares e terapias promissoras. Conversao. Rev. Drug Discov. 14, 58–74. doi: 10.1038/nrd4467 PubMed Abstract | CrossRef Full Text/Google Scholar
Duddy, W. J., Cohen, T., Duguez, S., and Partridge, T. A. (2011). A fibra muscular isolada como um modelo de atrofia desusa: caracterização usando o PhAct, um método para quantificar a f-actina. Expo. Cell Res. 317, 1979-1993. D. N.: 10.1016 / j. yexcr.2011.05.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Dumont, N. A., Wang, Y. X., and Rudnicki, M. A. (2015). Mecanismos intrínsecos e extrínsecos que regulam a função das células de satélite. Development 142, 1572-1581. doi: 10.1242 / dev.114223
PubMed Abstract | CrossRef Full Text | Google Scholar
Egner, I. M., Bruusgaard, J. C., Eftestol, E., and Gundersen, K. (2013). Um mecanismo de memória celular ajuda a sobrecarregar hipertrofia muscular muito tempo após uma exposição episódica a esteróides anabolizantes. J. Physiol. 591, 6221–6230. doi: 10.1113 / jphysiol.2013.264457
PubMed Abstract | CrossRef Full Text | Google Scholar
Egner, I. M., Bruusgaard, J. C., and Gundersen, K. (2016). A depleção de células por satélite impede a hipertrofia das fibras no músculo esquelético. Desenvolvimento 143, 2898-2906. doi: 10.1242 / dev.134411
PubMed Abstract | CrossRef Full Text | Google Scholar
Fitts, R. H., Metzger, J. M., Riley, D. A., and Unsworth, B. R. (1986). Models of disuse: a comparison of hindlimb suspension and imobilization. J. Appl. Physiol. 60, 1946–1953.
o Google Scholar
Ginet, V., Pittet, M. P., Rummel, C., Osterheld, M. C., Meuli, R., Clarke, P. G., et al. (2014). Neurónios moribundos no tálamo de recém-nascidos asfixiados e ratos são autofágicos. Anao. Neurol. 76, 695–711. D. O. I.: 10.1002 / ana.24257
PubMed Abstract | CrossRef Full Text | Google Scholar
Goh, Q., and Millay, D. P. (2017). Requisito de fusão de células estaminais mediadas pelo myomaker para hipertrofia do músculo esquelético. elife 6. doi: 10.7554 / eLife.20007
PubMed Abstract | CrossRef Full Text/Google Scholar
Gregory, T. R. (2001). Coincidência, coevolução ou causa? Conteúdo de ADN, tamanho das células e o enigma do valor C. Biol. Rev. Camb. Filo. Soc. 76, 65–101. doi: 10.1017/s1464793100005595
PubMed Resumo | CrossRef Texto Completo | Google Scholar
Guerci, A., Lahoute, C., Hebrard, S., Couve, L., Graindorge, D., Favier, M., et al. (2012). Sinais de paracrina dependentes de Srf produzidos por miofibers controlam hipertrofia muscular esquelética mediada por células-satélite. Célula Metab. 15, 25–37. doi: 10.1016 / j. cmet.2011.12.001
PubMed Abstract | CrossRef Full Text/Google Scholar
Gundersen, K. (2016). Memória muscular e um novo modelo celular para atrofia muscular e hipertrofia. J. Exp. Biol. 219, 235–242. doi: 10.1242 / jeb.124495
PubMed Abstract | CrossRef Full Text/Google Scholar
Gundersen, K., and Bruusgaard, J. C. (2008). Domínios nucleares durante atrofia muscular: núcleos perdidos ou paradigmas perdidos? J. Physiol. 586, 2675–2681. doi: 10.1113 / jphysiol.2008.154369
PubMed Abstract | CrossRef Full Text | Google Scholar
Guo, B. S., Cheung, K. K., Yeung, S. S., Zhang, B. T., and Yeung, E. W. (2012). A estimulação eléctrica influencia a proliferação celular por satélite e a apoptose na atrofia muscular induzida pela descarga em ratinhos. PLoS One 7: e30348. doi: 10.1371 / journal.pone.0053523
PubMed Resumo | CrossRef Texto Completo | Google Scholar
Jackson, J. R., Mula, J., Kirby, T. J. Fry, C. S., Lee, J. D., Ubele, M. F., et al. (2012). A depleção das células por satélite não inibe o crescimento do músculo esquelético adulto após atrofia induzida pela descarga. Manha. J. Phys. Physiol Celular. 303, C854-C861. doi: 10.1152 / ajpcell.00207.2012
PubMed Abstract | CrossRef Full Text | Google Scholar
Joubert, Y., and Tobin, C. (1995). O tratamento com testosterona resulta na activação das células satélite Quiescentes e no seu recrutamento para o ciclo celular no músculo do levator ani do rato. Desenvolvimento. Biol. 169, 286–294. doi: 10.1006 / dbio.1995.1144
PubMed Abstract | CrossRef Full Text/Google Scholar
Katz, B. (1961). The terminations of the afferent nerve fibre in the muscle spindle of the frog. Filo. Transexual. R. Soc. Lond. B Biol. Ciência. 243, 221–240.
PubMed Abstract/Google Scholar
Kletzien, H., Hare, A. J., Leverson, G., and Connor, N. P. (2018). Efeito relacionado com a idade da morte celular na morfologia das fibras e número no músculo da língua. Nervo Muscular 57, E29-E37. doi: 10.1002 / mus.25671
PubMed Abstract | CrossRef Full Text/Google Scholar
Kole, A. J., Annis, R. P., and Deshmukh, M. (2013). Neurônios maduros: equipados para sobrevivência. Cel Death Dis. 4: e689. doi: 10.1038 / cddis.2013.220
PubMed Abstract | CrossRef Full Text/Google Scholar
Li, T. S., Shi, H., Wang, L., and Yan, C. (2016). Efeito das células estaminais mesenquimais da medula óssea na proliferação de células satélite e apoptose na atrofia muscular induzida pela imobilização em ratos. Med. Ciência. Monit. 22, 4651–4660. doi: 10.12659 / MSM.898137
PubMed Abstract | CrossRef Full Text | Google Scholar
Lockshin, R. A., and Williams, C. M. (1965). Morte celular programada-I. citologia da degeneração nos músculos intersegmentais do pernyi silkmoth. J. Fisiol De Insecto. 11, 123–133. doi: 10.1016/0022-1910(65)90099-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Longtine, M. S., Barton, A., Chen, B., and Nelson, D. M. (2012). Imagens de células vivas mostram que a apoptose inicia localmente e propaga-se como uma onda através de sincitiotrofoblastos em culturas primárias de trofoblastos villos placentários humanos. Placenta 33, 971-976. doi: 10.1016 / j. placenta.2012.09.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Mauro, A. (1961). Célula satélite de fibras musculares esqueléticas. J. Biophys. Bioquímica. Citol. 9, 493–495.
Google Scholar
Mayhew, T. M., Leach, L., McGee, R., Ismail, W. W., Myklebust, R., and Lammiman, M. J. (1999). Proliferação, diferenciação e apoptose no trofoblasto villous às 13-41 semanas de gestação (incluindo observações sobre o anulado lamelas e complexos de poros nucleares). Placenta 20, 407-422. doi: 10.1053 / plac.1999.0399.
PubMed Resumo | CrossRef Texto Completo | Google Scholar
McCall, G. E., Allen, D. L., Linderman, J. K., Grindeland, R. E., Roy, R. R., Mukku, V. R., et al. (1998). Manutenção do tamanho do domínio myonuclear em rat soleus após sobrecarga e tratamento com hormona de crescimento/IGF-I. J. Appl. Physiol. 84, 1407–1412.
o Google Scholar
McClung, J. M., Kavazis, A. N., DeRuisseau, K. C., Falk, D. J., Deering, M. A., Lee, Y., et al. (2007). Caspase-3 regulamentação do domínio myonuclear do diafragma durante atrofia mecânica induzida pela ventilação. Manha. J. Respir. Critico. Cuidados Médicos. 175, 150–159. doi: 10.1164 / rccm.200601-142OC
PubMed Abstract | CrossRef Full Text | Google Scholar
Metter, E. J., Talbot, L. A., Schrager, M., and Conwit, R. (2002). Força muscular esquelética como um preditor de todas as causas de mortalidade em homens saudáveis. J. Gerontol. Uma Biol. Ciência. Med. Ciência. 57, B359-B365. doi: 10.1093 / gerona / 57.10.B359
PubMed Resumo | CrossRef Texto Completo | Google Scholar
Minnaard, R., Drost, M. R., Wagenmakers, A. J., van Kranenburg, G. P., Kuipers, H., e Hesselink, M. K. (2005). Perda de músculo esquelético e desempenho contráctil em ratos sépticos. Nervo Muscular 31, 339-348. doi: 10.1002 / mus.20268
PubMed Abstract / CrossRef Full Text | Google Scholar
Moss, F. P. (1968). A relação entre as dimensões das fibras e o número de núcleos durante o crescimento normal do músculo esquelético nas aves domésticas. Manha. J. Anat. 122, 555–563. doi: 10.1002 / aja.1001220308
PubMed Resumo | CrossRef Texto Completo | Google Scholar
Murach, K. A., Englund, D. A., Dupont-Versteegden, E. E., McCarthy, J. J., e Peterson, C. A. (2018). A flexibilidade do domínio Myonuclear desafia suposições rígidas sobre a contribuição das células satélites para hipertrofia da fibra muscular esquelética. Frente. Physiol. 9:635. doi: 10.3389 / fphys.2018.00635
CrossRef Texto Completo | Google Scholar
Nevalainen, M., Kaakinen, M., e Metsikko, K. (2013). Distribuição de transcrições de mRNA e actividade de tradução em miofibras esqueléticas. Cell Tissue Res. 353, 539-548. doi: 10.1007 / s00441-013-1659-X
PubMed Abstract | CrossRef Full Text | Google Scholar
O’Leary, M. F., Vainshtein, A., Carter, H. N., Zhang, Y., and Hood, D. A. (2012). Disfunção mitocondrial induzida pela denervação e autofagia no músculo esquelético de animais deficientes em apoptose. Manha. J. Phys. Physiol Celular. 303, C447-C454. doi: 10.1152/ajpcell.00451.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
Palumbo, C., Rovesta, C., and Ferretti, M. (2012). Striated muscle fiber apoptosis after experimental tendon lesion in a rat model. J. Anat. 221, 358–363. doi: 10.1111/j.1469-7580.2012.01554.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Qaisar, R., and Larsson, L. (2014). What determines myonuclear domain size? Indian J. Physiol. Pharmacol. 58, 1–12.
PubMed Abstract | Google Scholar
Ross, J. A., Levy, Y., Svensson, K., Philp, A., Schenk, S., and Ochala, J. (2018). O SIRT1 regula o número nuclear e o tamanho do domínio nas fibras do músculo esquelético. J. Cell. Physiol. 233, 7157–7163. doi: 10.1002 / jcp.26542
PubMed Abstract | CrossRef Full Text | Google Scholar
Schiaffino, S., Dyar, K. A., Ciciliot, S., Blaauw, B., and Sandri, M. (2013). Mecanismos que regulam o crescimento do músculo esquelético e atrofia. FEBS J. 280, 4294-4314. doi: 10.1111/febs.12253
PubMed Abstract | CrossRef Full Text/Google Scholar
Schmalbruch, H., and Hellhammer, U. (1977). O número de núcleos nos músculos adultos do rato com especial referência às células satélites. Anat. Gravacao. 189, 169–175. doi: 10.1002 / ar.1091890204
PubMed Abstract | CrossRef Full Text/Google Scholar
Schwartz, L. M. (2008). Atrofia e morte celular programada do músculo esquelético. A Morte Celular É Diferente. 15, 1163–1169. doi: 10.1038 / cdd.2008.68
PubMed Abstract | CrossRef Full Text/Google Scholar
Schwartz, L. M., Brown, C., McLaughlin, K., Smith, W., and Bigelow, C. (2016). O domínio myonuclear não é mantido no músculo esquelético durante atrofia ou morte celular programada. Manha. J. Phys. Physiol Celular. 311, C607-C615. doi: 10.1152 / ajpcell.00176.2016
PubMed Abstract | CrossRef Full Text/Google Scholar
Schwartz, L. M., and Ruff, R. L. (2002). Alterações nas propriedades contrácteis do músculo esquelético durante atrofia e morte programadas para o desenvolvimento. Manha. J. Phys. Physiol Celular. 282, C1270-C1277. doi: 10.1152 / ajpcell.01275.2000
CrossRef texto completo/Google Scholar
Schwartz, L. M., Smith, S. W., Jones, M. E.) , and Osborne, B. A. (1993). Todas as mortes programadas de células ocorrem por apoptose? Procedimento. Natl. Acad. Ciência. U. S. A. 90, 980-984.
Google Scholar
Schwartz, L. M., and Truman, J. W. (1983). Controlo Hormonal das taxas de desenvolvimento metamórfico no tabaco hornworm Manduca sexta. Desenvolvimento. Biol. 99, 103–114. doi: 10.1016/0012-1606(83)90257-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Schwartz, L. M., and Truman, J. W. (1982). Regulação peptídica e esteróide da degeneração muscular num insecto. Science 215, 1420-1421. doi: 10.1126 / science.6278594
PubMed Abstract | CrossRef Full Text | Google Scholar
Smith, H. K., Maxwell, L., Martyn, J. A., and Bass, J. J. (2000). Fragmentação do ADN Nuclear e alterações morfológicas no músculo esquelético do coelho adulto após imobilização a curto prazo. Cell Tissue Res. 302, 235-241. doi: 10.1007 / s004410000280
PubMed Abstract | CrossRef Full Text/Google Scholar
Smith, M. I., Huang, Y., and Deshmukh, M. (2009). A diferenciação do músculo esquelético evoca o XIAP endógeno para restringir a via apoptótica. PLoS 1 4: e5097. doi: 10.1371 / journal.pone.0005097
CrossRef Texto Completo / Google Scholar
Staron, R. S., Leonardi, M. J., Karapondo, D. L., Malicky, E. S., Falkel, J. E., Hagerman, F. C., et al. (1991). Adaptação da força e do músculo esquelético em mulheres com forte resistência após formação e reciclagem. J. Appl. Physiol. 70, 631-640.
Google Scholar
Strassburger, E. (1893). A esfera de ação dos núcleos e o tamanho da célula. Histol Beitr. 5, 97-124.
Google Scholar
Strasser, H., Tiefenthaler, M., Steinlechner, M., Eder, I., Bartsch, G., and Konwalinka, G. (2000). Apoptose dependente da idade e perda de células de rhabdosphincter. J. Urol. 164, 1781–1785. doi: 10.1016/S0022-5347(05)67106-6
PubMed Resumo | CrossRef Texto Completo | Google Scholar
Tedesco, F. S., Dellavalle, A., Diaz-Manera, J., Messina, G., e cruzamento de cossu, G. (2010). Reparação do músculo esquelético: potencial regenerativo das células estaminais do músculo esquelético. J. Clin. Investir. 120, 11–19. doi: 10.1172/JCI40373
PubMed Abstract | CrossRef Full Text | Google Scholar
Wada, K. I., Takahashi, H., Katsuta, S., and Soya, H. (2002). Não há diminuição no número myonuclear após a denervação a longo prazo em ratos adultos. Manha. J. Phys. Physiol Celular. 283, C484-C488. doi: 10.1152 / ajpcell.00025.2002
CrossRef Texto Completo | Google Scholar
Winje, I. M., Sheng, X., Hansson, K. A., Solbrå, A., Tennøe, S., Saatcioglu, F., et al. (2018a). A caquexia não induz a perda de mionucleos ou fibras musculares durante o cancro da próstata xenografado em ratinhos. Acta Physiol. e13204. doi: 10.1111 / apha.13204
CrossRef Texto Completo | Google Scholar
Winje, I. M., Bengtsen, M., Eftestol, E., Juvkam, I.= = Ligações externas = = * site oficial Rotulagem específica dos mionúcleos por um anticorpo contra o material pericentriolar 1 em secções do tecido muscular esquelético. Acta Physiol. 223: e13034. doi: 10.1111 / apha.13034
CrossRef Full Text | Google Scholar
Woo, J. (2017). Sarcopenia. Clin. Geriatr. Med. 33, 305–314. doi: 10.1016 / j. cger.2010.02.012
CrossRef Full Text | Google Scholar
Xiao, R., Ferry, A. L., and Dupont-Versteegden, E. E. (2011). A resistência à morte celular dos miotubos diferenciados está associada a mecanismos anti-apoptóticos melhorados em comparação com os mioblastos. Apoptose 16, 221-234. doi: 10.1007 / s10495-010-0566-9
PubMed Abstract | CrossRef Full Text/Google Scholar
Yang, D., Morris, S. F., and Sigurdson, L. (1998). The sartorius muscle: anatomic considerations for reconstructive surgeons. Radial De Prisão. Anat. 20, 307–310. doi: 10.1007
PubMed Abstract | CrossRef Full Text/Google Scholar
Zhong, H., Roy, R. R., Siengthai, B., and Edgerton, V. R. (2005). Efeitos da inactividade no tamanho da fibra e no número myonuclear no músculo Soleus do rato. J. Appl. Physiol. 99, 1494–1499. doi: 10.1152 / japplphysiol.00394.2005
CrossRef Full Text | Google Scholar
Zhou, X., Wang, J. L., Lu, J., Song, Y., Kwak, K. S., Jiao, Q., et al. (2010). A reversão da caquexia cancerígena e o desperdício muscular pelo antagonismo do Act RIIB levam a uma sobrevivência prolongada. Cela 142, 531-543. doi: 10.1016/j. cell.2010.07.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Ziaaldini, M. M., Marzetti, E., Picca, A., and Murlasits, Z. (2017). Biochemical pathways of sarcopenia and their modulation by physical exercise: a narrative review. Frente. Med. 4:167. doi: 10.3389 / fmed.2017.00167
CrossRef Texto Completo | Google Scholar