determinar determinados parâmetros, tais como tamanho, comprimento e ângulo na escala atómica, não é fácil. Devido à importância destes parâmetros, os cientistas desenvolveram métodos para deduzir ou calcular OS parâmetros em nível atômico. A ordem de ligação e o comprimento da ligação são dois parâmetros tão importantes que indicam o tipo e a força das ligações entre um par de átomos. este artigo explica, 1. O que são a ordem de ligação e o comprimento da ligação
2. How to Calculate Bond Order and Bond Length
– How to Calculate Bond Order
– How to Calculate Bond Length
What are Bond Order and Bond Length
Bond length and bond order are two parameters that are associated with covalent bonds. A ordem de ligação é o número de ligações químicas entre dois átomos e o comprimento da ligação é a distância entre dois núcleos de átomos que estão covalentemente ligados entre si. Este artigo explica como calcular a ordem de ligação e o comprimento da ligação num nível atómico.
como calcular a ordem de ligação
ordem de ligação é o número de ligações químicas entre dois átomos. Indica a estabilidade de uma ligação. Em ligações covalentes, a ordem de ligação é o número de elétrons compartilhados. Por exemplo, a ordem de ligação de um par de átomos ligados por uma única ligação é uma, enquanto a ordem de ligação de um par de átomos ligados por uma ligação dupla é duas. A ordem de ligação Zero indica que não há ligação entre átomos. A estabilidade de uma molécula aumenta com o aumento da ordem de ligação. As moléculas com ligação por ressonância não precisam ser um inteiro. Em compostos covalentes com dois átomos, a ordem de ligação entre um par de átomos é determinada primeiro desenhando a estrutura de Lewis, e depois determinando o tipo de ligações entre os átomos – ligação zero, ligação única, dupla ou tripla. Por exemplo, a ordem de ligação do hidrogénio gasoso é determinada da seguinte forma.
- Draw the Lewis structure
H: H
- Determine the number of bonds/pair of valence electrons
One P > one pair of electrons, hence the bond order is 1.se houver mais de dois átomos, a ordem de ligação é determinada da seguinte forma. Ver o exemplo: ião nitrato.
- Desenhar a estrutura de Lewis
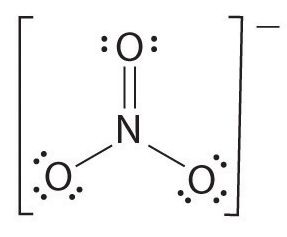
- Contagem do número total de títulos (de acordo com nitrato de íons de lítio, 4)
- O número de bond grupos entre átomos individuais (de acordo com amônia, 3)
- Portanto, o vínculo de ordem = número Total de títulos/ número de bond grupos
= 4/3
= 1.33
Portanto, o vínculo, a fim de nitrato, íon é 1.33
como calcular o comprimento da ligação
Comprimento da ligação é a distância entre dois núcleos de átomos que estão ligados covalentemente. O comprimento da ligação é geralmente de 0,1 a 0,2 nm. Quando dois átomos similares estão ligados entre si, metade do comprimento da ligação é referido como raio covalente. O comprimento da ligação depende do número de elétrons ligados de dois átomos ou da ordem da ligação. Maior a ordem de ligação, menor o comprimento da ligação será devido a forças de tracção fortes de núcleos carregados positivamente. A unidade de comprimento da ligação é o picómetro. Em individuais, duplos e triplos títulos, o comprimento de ligação aumenta na ordem de
ligação tripla<ligação dupla<título único
Electronegativity pode ser usado para calcular o comprimento de ligação entre dois átomos com diferentes electronegativities. A seguinte fórmula empírica foi proposta por Shoemaker e Stevenson para calcular o comprimento da ligação.
dA-B = rA + rB-0.09 (xA – xB)
a dA a-B é bond distância entre dois átomos A e B, rA e rB são covalente raios A e B e
(xA – xB) é electronegativity diferença entre A e B.
Outro método é usado para cálculo aproximado do comprimento de ligação. In this method, first Lewis structure is drawn to determine the covalent bond type. Em seguida, usando um gráfico * feito sobre os estudos feitos por Cordero et al., e Pyykkö e Atsumi, os raios correspondentes das ligações feitas por cada átomo são determinados. Em seguida, o comprimento da ligação é determinado tomando a soma dos dois raios. Por exemplo, ao determinar o comprimento de ligação do dióxido de carbono, a primeira estrutura de Lewis é desenhada.
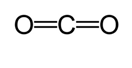
de Acordo com o gráfico, o raio covalente de carbono da ligação dupla é de 67 picometers e do oxigênio, ligação dupla é de 57 picometers. Portanto, o comprimento de ligação do dióxido de carbono é de aproximadamente 124 picómetros (57 pm+ 67 pm).
*gráfico covalente encontra-se aqui
referência:
Cordero, Beatriz, et al. “Covalent radii revisited.”Dalton Transactions 21 (2008): 2832-2838.Libretexts. “Bond Order and Lengths.”Chemistry LibreTexts. Libretexts, 05 Dec. 2016. Site. 10 Jan. 2017.Lister, Ted e Janet Renshaw. Compreender a química para um nível avançado. N. p.: Nelson Thornes, 2000. Imprimir.Pratiyogita Darpan. “Properties of Elements in Relation to their Electronic Structure .”Competition Science Vision Aug. 1998: n. pag. Imprimir.Pyykkö, Pekka e Michiko Atsumi. “Radii covalente de ligação dupla Molecular para os elementos Li-E112.”Chemistry-A European Journal 15.46 (2009): 12770-12779.
![]()