prawidłowy metabolizm komórkowy zależy od utrzymania pH krwi w bardzo wąskich granicach (7,35-7,45).
nawet stosunkowo łagodne skurcze poza tym normalnym zakresem pH mogą mieć szkodliwe skutki, w tym zmniejszone dostarczanie tlenu do tkanek, zaburzenia elektrolitowe i zmiany kurczliwości mięśnia sercowego; przeżycie jest rare, jeśli pH krwi spadnie poniżej 6,8 lub wzrośnie powyżej 7,8.
problem dla organizmu polega na tym, że normalny metabolizm jest związany z ciągłą produkcją jonów wodorowych (H+) i dwutlenku węgla(CO2), z których oba mają tendencję do obniżania pH. mechanizm, który pokonuje ten problem i służy do utrzymania prawidłowego pH krwi(tj. zachowania homeostazy kwasowo-zasadowej) jest złożoną synergią z udziałem buforów chemicznych we krwi, czerwonych krwinek(erytrocytów), które krążą we krwi, oraz funkcji trzech narządów: płuc, nerek i mózgu.
przed wyjaśnieniem, w jaki sposób te pięć elementów przyczynia się do ogólnego utrzymania pH krwi, pomocne byłoby szybkie zapoznanie się z podstawowymi pojęciami.
- co to jest kwas, co to jest zasada i co to jest pH?
- co to jest bufor? – system buforowy wodorowęglanów
- funkcja płuc, transport CO2 i równowaga kwasowa
- nerki i równowaga kwasowo-zasadowa
- zaburzenia równowagi kwasowo-zasadowej
- przyczyny zaburzeń kwasowo-zasadowych
- kwasica oddechowa – (podwyższone pCO2(a),obniżone pH)
- zasadowica oddechowa – (zmniejszonapco2(a), zwiększone pH)
- kwasica metaboliczna – (zmniejszonahco3–, obniżone pH)
- zasadowica metaboliczna – (wzrosthco3– , podwyższone pH)
- Kompensacja – konsekwencja kwasoodporności
- mieszane zaburzenia kwasowo-zasadowe
- podsumowanie
- niektórzy sugerują dalsze zmiany
co to jest kwas, co to jest zasada i co to jest pH?
kwas jest substancją uwalniającą jony hydrogenowe (H+) podczas dysocjacji w roztworze.
na przykład: Kwas solny (HCl) dysocjuje na jony wodorowęglanowe i wodorowęglanowe
HCl ![]() H+ + Cl-
H+ + Cl-
kwas węglowy (H2CO3) dysocjuje na jony wodorowęglanowe i jony wodorowęglanowe
H2CO3 ![]() H+ +HCO3–
H+ +HCO3–
rozróżniamy silne kwasy, takie jak kwas solny i kwasy tłuszczowe, takie jak kwas węglowy. Różnica polega na tym, że silne kwasydisocjować więcej niż słabe kwasy. W związku z tym jononcentracja wodorowa mocnego kwasu jest znacznie wyższa niż w przypadku słabego kwasu.
baza jest substancją, która w roztworze przyjmuje jony hydrogenowe.
na przykład, wodorowęglan zasadowy (HCO3–)przyjmuje jony wodorowe do postaci kwasu węglowego:
HCO3– + H+ ![]() H2CO3
H2CO3
pH jest skalą 0-14 kwasowości i zasadowości. Czysta woda ma pH 7 i jest obojętna (ani kwaśna, ani zasadowa). pH powyżej 7 jest zasadowe, a poniżej 7 kwaśne. Tak więc pH krwi (7,35-7,45) jest lekko zasadowe, chociaż w medycynie klinicznej termin alkalozy, być może myląco, zarezerwowany dla pH krwi większego niż 7.45I termin kwasica jest zarezerwowany dla pH krwi poniżej 7,35.
pH jest miarą stężenia jonów wodorowych (H+).Oba są ze sobą powiązane zgodnie z następującym równaniem:
pH = – log10
Gdzie jest stężenie jonów wodorowych inmoli na litr (mol/L)
z tego równania
pH 7,4 = h+ stężenie 40 nmol/l
pH 7,0 = h+ stężenie 100 nmol/l
pH 6,0 = h+ stężenie 1000 nmol/l
p>
oczywiste jest, że:
- dwa parametry zmieniają się odwrotnie; ponieważ stężenie jonów wodorowych wzrasta, pH spada
- ze względu na zależność logarytmiczną, duża zmiana stężenia jonów wodorowych jest w rzeczywistości małą zmianą pH. na przykład podwojenie stężenia jonów wodorowych powoduje spadek pH o zaledwie 0,3
co to jest bufor? – system buforowy wodorowęglanów
bufory są substancjami chemicznymi w roztworze, które minimalizują zmianę pH, która występuje, gdy kwasy są dodawane przez „zmywanie” jonów wodorowych. Bufor jest roztworem słabego kwasu i jego zasady. We krwi zasadowym układem buforowym jest słaby kwas węglowy (H2CO3) i jego koniugat, wodorowęglan (HCO3–). Aby wyjaśnić, w jaki sposób ten system minimalizuje zmiany pH, Załóżmy, że dodamy silny kwas, np. HCl, do buforu wodorowęglanowego:
kwas dysocjuje, uwalniając jony wodorowe:
HCl![]() H+ + CL–
H+ + CL–
bufor wodorowęglanowy „absorbuje” jony wodorowe, tworząc kwas węglowy w procesie:
HCO3– + H+ ![]() H2CO3 (kwas węglowy)
H2CO3 (kwas węglowy)
ważne jest to, że ponieważ jony wodorowe z Hcl zostały włączone do słabego kwasu węglowego, który nie jest tak łatwo wiązany, całkowita liczba jonów wodorowych w roztworze, a zatem pH nie zmienia się tak bardzo, jak miałoby to miejsce w przypadku braku buforu.
mimo że bufor znacznie minimalizuje zmiany, nie eliminuje ich, ponieważ nawet słaby kwas (jak kwas węglowy) dysocjuje w pewnym stopniu. PH bufora jest funkcją względnego stężenia słabego kwasu i jego sprzężonej Zasady.
pH = 6,1 + log (/)
gdzie = stężenie bikarbonianu
= stężenie kwasu węglowego
ta zależność, znana jako równanie Hendersona-Hasselbalcha,pokazuje, że pH jest regulowane przez stosunek stężenia Zasady(HCO3–) do stężenia kwasu(H2CO3).
ponieważ jony wodorowe są dodawane do buforu wodorowęglanowego:
h+ +HCO3– ![]() H2CO3
H2CO3
zużywa się wodorowęglan (zasada) (zmniejsza stężenie) i wytwarza się kwas węglowy (zwiększa stężenie). Jeśli hydrogeniony będą nadal dodawane, cały wodorowęglan ostatecznie ulegnie zużyciu (przekształceniu w kwas węglowy) i nastąpi efekt nobufferingu – pH spadnie gwałtownie, jeśli więcej kwasu zostanie zużyte.
gdyby jednak kwas węglowy mógł być w sposób ciągły usuwany z systemu, a wodorowęglan stale się regenerował, wówczas zdolność buforowania i tym samym pH mogłoby być utrzymane pomimo ciągłego dodawania jonów wodorowych.
jak się okaże z większą szczegółowością fizjologiczno-zasadowej równowagi, czyli w efekcie tego, co dzieje się w organizmie. Bezsenność, płuca zapewniają usunięcie kwasu węglowego (jako karbonodioksyd), a nerki zapewniają ciągłą regenerację bikarbonianu.
ta rola płuc jest zależna od pojedynczego układu buforującego wodorowęglan i jest to zdolność kwasu węglowego do przemiany w dwutlenek węgla i wodę.
poniższe równanie przedstawia zależność wszystkich elementów systemu buforowania wodorowęglanu, ponieważ działa on w ciele
H+ +HCO3–![]() H2CO3
H2CO3![]() H2O + CO2
H2O + CO2
ważne jest, aby pamiętać, że reakcje są odwracalne.Kierunek zależy od względnego stężenia kaźdegoelement. Tak więc, na przykład, wzrost stężenia dioksydacji węgla wymusza reakcję na lewo ze zwiększonym formowaniem kwasu węglowego i ostatecznie jonów wodorowych.
To wyjaśnia kwasowy potencjał dwutlenku węgla i prowadzi nas do istotnego wpływu, jaki płuca i czerwone krwinki wytwarzają na ogólną równowagę kwasową.
funkcja płuc, transport CO2 i równowaga kwasowa
stała ilość CO2 we krwi, niezbędna do równowagi kwasowo-zasadowej, odzwierciedla równowagę między wytwarzaną w wyniku metabolizmu komórek tkankowych a wydalaną przez płuca niewytłumaczonym powietrzem.
zmieniając szybkość wydzielania dwutlenku węgla, płuca regulują zawartość dwutlenku węgla we krwi.Sekwencja zdarzeń od produkcji dwutlenku węgla w tissues do eliminacji w wydychanym powietrzu jest opisana na Fig. 1.Dwutlenek węgla dyfunduje z komórek tkanki do otaczającejkapilarnej krwi (rys. 1a). Niewielka część rozpuszcza się w plazmie krwi i jest transportowana do płuc w stanie niezmienionym.
ale większość dyfuzje do czerwonych krwinek, gdzie łączy się z wodą, tworząc kwas węglowy.Kwas dysocjuje z produkcją jonów wodorowych ibikarbonatu. Jony wodorowe łączą się z odtlenioną hemoglobiną (hemoglobina działa tutaj jako bufor), zapobiegając niebezpiecznemu spadkowi pH komórkowego, a wodorowęglan dyfunduje wzdłuż koncentratu z krwinek czerwonych do osocza.
tak więc większość dioksydatu węglowego wytwarzanego w tkankach jest transportowana do płuc jako dwuwęglan w osoczu krwi.
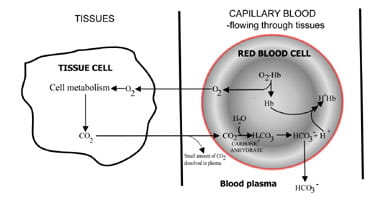
1A. CO2 wytwarzany w tkankach przekształca się w wodorowęglan w celu transportu do płuc.
|
|
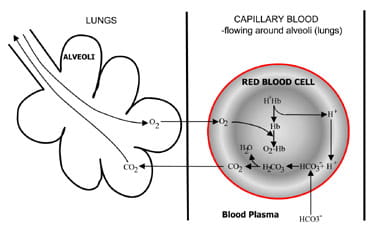
Fig. 1b. At the lungs bicarbonate convertedback to CO2 and eliminated by the lungs.
w pęcherzykach płucnych proces odwraca się (rys. 1B).Jony wodorowe są wypierane z hemoglobiny w miarę pobierania tlenu z powietrza. Jony wodorowe są teraz buforowane przezbikarbonat, który dyfunduje z osocza z powrotem do krwinek czerwonych i powstaje kwas węglowy. Ponieważ stężenie tego wzrasta, jestzawrócony do wody i dwutlenku węgla. Wreszcie, dioksyd węglowy obniża gradient stężenia z krwinek czerwonych do pęcherzyków płucnych w wydychanym powietrzu.
chemoreceptory oddechowe w pniu mózgu reagują na zmiany w stężeniu dwutlenku węgla we krwi, powodując zwiększoną wentylację (oddychanie), jeśli stężenie dwutlenku węgla wzrośnie i zmniejszoną wentylację, jeśli dwutlenek węgla spadnie.
nerki i równowaga kwasowo-zasadowa
prawidłowy metabolizm komórkowy powoduje ciągłą produkcję jonów wodorowych. Widzieliśmy, że poprzez połączenie z tymi jonami wodorowymi bufor wodorowęglanowy we krwi minimalizuje ich efekt. Jednak buforowanie jest przydatne tylko w krótkim okresie i ostatecznie jony wodorowe muszą zostać usunięte z organizmu.Ponadto ważne jest, aby wodorowęglan, który jest stosowany do wytwarzania jonów wodorowych, był stale wymieniany.
te dwa zadania,eliminacja jonów wodorowych i regeneracja wodorowęglanów, są realizowane przez nerki. Komórki kanalików nerkowych są bogate w anhydrazę węglanową, która ułatwia tworzenie węglanu kwasu z dwutlenku węgla i wody. Kwas węglowy dysocjuje jony wodorowęglanowe i wodorowe. Wodorowęglan jest wchłaniany do krwi, a jony wodorowe przechodzą do światła kanalika i są eliminowane z organizmu w moczu.
to wydalanie moczu zależy od obecności w moczu buforów, przede wszystkim jonów fosforanu i amoniaku.
zaburzenia równowagi kwasowo-zasadowej
większość zaburzeń kwasowo-zasadowych wynika z
- choroby lub uszkodzenia narządów (nerek, płuc, mózgu), których prawidłowe funkcjonowanie jest niezbędne do homeostazy kwasowo-zasadowej,
- choroby, która powoduje nienormalnie zwiększoną produkcję kwasów metabolicznych, tak że mechanizmy homeostatyczne są przytłoczone
- interwencji medycznej (np. Wentylacja mechaniczna, niektóre leki)
gazy krwi tętniczej są badaniem krwi służącym do identyfikacji i monitorowania zaburzeń kwasowo-zasadowych. Trzy parametry mierzone podczas analizy gazu krwi, pH krwi tętniczej (pH), ciśnienie cząstkowe dwutlenku węgla we krwi tętniczej (pCO2 (a)) i zagęszczenie wodorowęglanu (HCO3–) mają zasadnicze znaczenie (patrz Tabela i w zakresie odniesienia (normalny)).Wyniki tych trzech pozwalają na klasyfikację kwasoodporności do jednej z czterech kategorii etiologicznych:
- Respiratory acidosis
- Respiratory alkalosis
- Metabolic acidosis
- Metabolic alkalosis
|
Adults |
Neonates |
|
|
pH |
7.35-7.45 |
7.30-7.40 |
|
pCO2 (kPa) |
4.7-6.0 |
3.5-5.4 |
|
Bicarbonate |
22-28 |
15-25 |
TABLE I. Przybliżone zakresy odniesienia (normalne)
aby zrozumieć, w jaki sposób wyniki pH, pCO2(a) i wodorowęglanu są używane do klasyfikacji zaburzeń kwasowo-zasadowych w ten sposób, musimy wrócić do równania Hendersona-Hasselbalcha
pH = 6,1 + log (/)
mierzymy pH i wodorowęglan, ale nie kwas węglowy(H2CO3). Istnieje jednak zależność między pCO2 (a) i H2CO3, która umożliwia ponowne określenie równania Hendersona-Hasselbalcha pomiędzy trzema parametrami(pH, pCO2 (a) i węglanem) mierzonymi podczas analizy gazów we krwi:
pH = 6,1 + log (/(pCO2 (a) × 0.23))
usuwając wszystkie stałe z tego równania, zależność pomiędzy trzema mierzonymi parametrami można uprościć:
pH ∝ /pCO2(a)
ta zależność, kluczowa dla zrozumienia wszystkich następstw dotyczących zaburzeń kwasowo-zasadowych, stwierdza, że pH krwi tętniczej jest proporcjonalne do stosunku koncentracji wodorowęglanu do pCO2(a). Pozwala to na następujące ograniczenia:
- pH pozostaje w normie tak długo, jak stosunek: pCO2(a) pozostaje w normie
- pH wzrasta (tj. występuje zasadowica), jeśli albo wzrasta, albo zmniejsza się pCO2(a).
- pH maleje (tzn.
- Jeśli zarówno pCO2(a), jak i pCO2(A) zwiększają się o stosunkowo taką samą ilość, stosunek i w związku z tym pH są normalne
- Jeśli zarówno pCO2(a), jak i pCO2 (a) zmniejszają się o stosunkowo taką samą ilość, stosunek i w związku z tym pH są normalne.
zaburzenia kwasowo-zasadowe wpływają głównie na eiterpco2(a), w którym to przypadku nazywa się to zaburzeniem oddechowym lub, w którym to przypadku nazywa się to zaburzeniem oddechowym lub metabolicznym:
- Jeśli zaburzeniem pierwotnym jest podwyższony poziom pCO2(a) (co powoduje kwasicę – patrz wyżej), stan ten nazywa się kwasicą oddechową
- Jeśli zaburzeniem pierwotnym jest obniżony poziom pCO2(a) (co powoduje zasadowicę – patrz wyżej), stan ten nazywa się zasadowicą oddechową
- jeśli pierwotne zaburzenie jest związane ze zmniejszonym stężeniem wodorowęglanów (co powoduje kwasicę – patrz wyżej), stan ten nazywa się kwasicą metaboliczną
- jeśli pierwotne zaburzenie jest związane z podniesionym wodorowęglanem (co powoduje zasadowicę – patrz wyżej), stan nazywa się zasadowica metaboliczna
przyczyny zaburzeń kwasowo-zasadowych
kwasica oddechowa – (podwyższone pCO2(a),obniżone pH)
kwasica oddechowa charakteryzuje się zwiększeniem pCO2(a) z powodu niewystarczającej wentylacji pęcherzyków płucnych(hipowentylacji) i w konsekwencji zmniejszoną eliminacją CO2 z krwi. Choroby układu oddechowego, takie jak azbronchopneumonia, rozedma płuc, astma i przewlekła obturacyjna dróg oddechowychchoroba, mogą być związane z hipowentylacją wystarczającą do spowodowania kwasicy oddechowej.
niektóre leki (np. morfina ibarbiturany) może powodować kwasicę oddechową poprzez depresyjne centrum oddechowe w mózgu. Uszkodzenie lub uraz klatki piersioweji mięśni zaangażowanych w mechanikę oddychania może zmniejszyć szybkość wentylacji. Wyjaśnia to kwas oddechowy, który może skomplikować przebieg chorób,takich jak poliomyelitis, zespół Guillain-Barre i powrót do zdrowia po ciężkim urazie klatki piersiowej.
zasadowica oddechowa – (zmniejszonapco2(a), zwiększone pH)
natomiast zasadowica oddechowa charakteryzuje się zmniejszonapco2(a) z powodu nadmiernej wentylacji pęcherzykowej i wynikającej z niej nadmiernej eliminacji CO2 z krwi.Choroba, w której ze względu na zmniejszenie tlenu we krwi (hipoksemia), centrum oddechowe jest stymulowany może spowodować respiratoryalkalosis.
przykłady tutaj obejmują ciężką niedokrwistość, zator płucny i zespół oddechowy dorosłych. Hiperwentylacja wystarczająca do spowodowania zasadowicy oddechowej może być cechą ataków lękowych iresponse na silny ból. Jedną z mniej pożądanych właściwości salicylanu (aspiryny) jest jego stymulujący wpływ na respiratorycenter. Efekt ten stanowi zasadowicę oddechową, która występuje po przedawkowaniu salicylanu. Wreszcie, overenthusiastic Wentylacja mechaniczna może powodować zasadowicę oddechową.
kwasica metaboliczna – (zmniejszonahco3–, obniżone pH)
zmniejszenie wodorowęglanu jest zawsze cechą metabolicacidosis. Dzieje się tak z jednego z dwóch powodów: Zwiększone wykorzystanie bikarbonatu w buforowaniu nieprawidłowego obciążenia kwasem lub zwiększone straty wodorowęglanu z organizmu. Cukrzycowa kwasica ketonowa i kwas mlekowy to dwa stany charakteryzujące się nadprodukcją kwasów metabolicznych, a w konsekwencji wyczerpaniem wodorowęglanów.
w pierwszym przypadku nienormalnie wysokie stężenie keto-kwasów(kwasu B-hydroksymasłowego i kwasu acetooctowego) we krwi odzwierciedla poważne zaburzenia metaboliczne, które wynikają z niedoboru insuliny.
wszystkie komórki produkują kwas mlekowy,jeśli mają niedobór tlenu, więc zwiększona produkcja kwasu mlekowego i wynikająca z tego metabolicacidosis występuje w każdym stanie, w którym dostarczanie tlenu do organizmu jest poważnie zagrożone.
przykłady obejmują zatrzymanie krążenia i wszelkie schorzenia związane ze wstrząsem hipowolemicznym (np. masywna utrata płynu). Wątroba odgrywa ważną rolę w usuwaniu małejliczba kwasu mlekowego, który jest produkowany podczas normalnego cellmetabolism, tak, że kwasica mleczanowa może być cechą wątrobowości.
Nieprawidłowa utrata wodorowęglanu z organizmu może wystąpić podczas ciężkiej biegunki. Jeśli niezaznaczone, może to prowadzić do kwasicy metabolicznej.Brak regeneracji wodorowęglanów i wydalania jonów wodorowęglanowychwyjaśnia kwasicę metaboliczną, która występuje w renalfailure.
zasadowica metaboliczna – (wzrosthco3– , podwyższone pH)
wodorowęglan jest zawsze podwyższony w zasadowicy metabolicznej. Rzadko nadmierne podawanie wodorowęglanu lub spożycie preparatu zobojętniającego kwas wodorowęglanowy może powodować zasadowicę metaboliczną, ale jest to zwykle przemijające. Nieprawidłowa utrata jonów wodorowych z organizmu mogąbyć głównym problemem. Wodorowęglan, który w przeciwnym razie zostałby zużyty w buforowaniu tych utraconych jonów wodorowych, w konsekwencji kumuluje się we krwi. Sok żołądkowy jest kwaśny i żołądkowo-jelitowy lub jakikolwiek proces chorobowy, w którym zawartość żołądkowaostatnie z organizmu stanowi utratę jonów wodorowych.
na przykład wymioty z sokiem żołądkowym wyjaśniają temat zasadowica metaboliczna, która może wystąpić u pacjentów z odźwierniakstenozą. Ciężkie zubożenie potasu może powodować alkalia metabolicznez powodu wzajemnego związku między wodorem i potasami.
Kompensacja – konsekwencja kwasoodporności
ważne jest dla życia,aby pH nie odstąpiło zbyt daleko od normy, a organizm zawsze będzie próbował przywrócić nieprawidłowe pH w przypadku zaburzenia równowagi kwasowo-zasadowej. Rekompensata jest przyznawana temu procesowi podtrzymywania życia. Aby zrozumieć kompensację, ważne jest, aby pamiętać, że pH jest regulowane przez theratio: pCO2(a). tak długo, jak stosunek jest normalny, pH będzie normalne.
rozważ pacjenta z kwasicą metaboliczną, której pH jest niskie, ponieważ wodorowęglan jest niski. Aby zrekompensować niskie i przywrócićwszystko istotne stosunek do normalnego pacjent musi obniżyć hispCO2 (a). Chemoreceptory w respiratoryśrodek mózgu reagują na rosnące stężenie jonów wodorowych (niskie pH), powodując zwiększoną wentylację(hiperwentylację) i zwiększoną eliminację dwutlenku węgla; pCO2(a) spada, a stosunek : pCO2 (a) wraca do normy.
Kompensacja zasadowicy metabolicznej, w której jest wysoka, natomiast polega na zahamowaniu oddychania, a tym samym zatrzymaniu dioksydatu węglowegoo tym, że pCO2(a) wzrasta, aby dopasować wzrost . Jednak depresja oddechu ma niepożądany efekt uboczny zagrażający odpowiedniej tlenoterapii tkanek. Z tego powodu kompensacja oddechowa alkalozymetabolicznej jest ograniczona.
pierwotne zaburzenia pCO2(a) (respiratorykwaśność i zasadowica) są kompensowane przez nerkową regulację wydalania jonów wodorowych, co powoduje zmiany, które odpowiednio kompensują pierwotną zmianę pCO2(a). Zatem kompensacja renalna kwasicy oddechowej(podwyższony pCO2(a)) wiąże się ze zwiększonym wchłanianiem zwrotnym węglanu, a kompensacja nerkowa zasadowicy oddechowej(obniżony pCO2 (a)) wiąże się ze zmniejszonym wchłanianiem wodorowęglanu.
pojęcie równowagi kwasowo-zasadowej podczas kompensacjizostało przedstawione wizualnie na Fig. 2. Tabela II podsumowuje wyniki gazów we krwi, które charakteryzują wszystkie cztery zaburzenia kwasowo-zasadowe przed i po kompensacji.
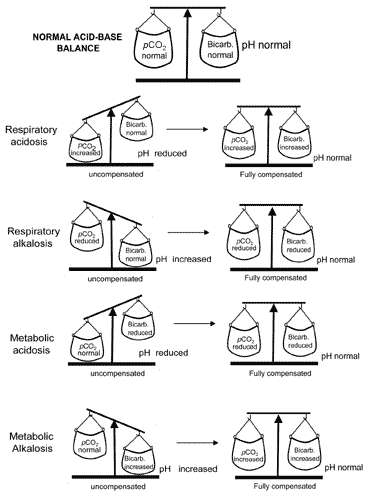
rys. 2. „Równowaga kwasowo-zasadowa” : compensationrestores normal pH
|
Primary disturbance |
||||
|
Respiratory |
Repiratory |
Metabolic |
Metabolic |
|
|
Some |
Emphysema |
Hyper- |
Renal failure |
Bicarbonate Potassium |
|
Compen- |
RENAL |
RENAL |
RESPIRA- |
RESPIRA- |
|
Initial blood |
pH |
pH |
pH |
pH |
|
Blood gas |
pH pCO2 |
pH pCO2 |
pH pCO2 |
Limited |
|
Blood gas |
pH normal |
pH normal |
pH normal |
Limited |
Wersja do wydruku tabeli, pdf.
tabela II. Gazometria krwi powoduje zaburzenia równowagi kwasowo-zasadowej
kompensacja układu oddechowego w przypadku pierwotnych zaburzeń metabolicznychwystępuje znacznie szybciej niż kompensacja metaboliczna (nerkowa) w przypadku pierwotnych zaburzeń oddechowych. W drugim przypadku rekompensatawystępuje w ciągu dni, a nie godzin.
Jeśli kompensacja spowoduje przywrócenie pH do normy, pacjent zostanie w pełni zrekompensowany. Ale w wielu przypadkach odszkodowanie zwraca pHtowards normalne bez rzeczywistego osiągnięcia normalności; w takich przypadkach mówi się, że pacjent ma częściową rekompensatę.
W przypadku wyżej opisanych schorzeń zasadowica metaboliczna jest bardzo rzadko w pełni wyrównana.
mieszane zaburzenia kwasowo-zasadowe
z powyższej dyskusji można założyć, że wszyscy pacjenci z zaburzeniami kwasowo-zasadowymi cierpią tylko na jedną z czterech kategorii równowagi kwasowo-zasadowej. Może tak być, ale w szczególnych okolicznościach pacjenci mogą wykazywać więcej niż jedno zaburzenie.
na przykład rozważ pacjenta z przewlekłą chorobą płuc, taką jak rozedma płuc, który ma długotrwałą częściowo wyrównaną kwasicę oddechową. Jeśli u tego pacjenta stwierdzono adiabatię, który nie przyjął normalnej dawki insuliny i w wyniku tego doszło do cukrzycowej kwasicy ketonowej, wyniki badania gazowego we krwi odzwierciedlałyby łączny efekt zarówno kwasicy oddechowej, jak i kwasicy metabolicznej.
takie mieszane zaburzenia kwasowo-zasadowe nie występują często i mogą być trudne do rozwikłania na podstawie samych wyników gazów tętniczych.
podsumowanie
utrzymanie prawidłowego pH krwi obejmuje kilka układów narządów i zależy od integralności krążenia. Nic więc dziwnego, że zaburzenie równowagi kwasowo-zasadowej może skomplikować przebieg bardzo różnych chorób, a także urazów wielu części ciała. Ciało ma znaczną siłę do zachowania pH krwi, aisturbances Zwykle implikują ciężką chorobę przewlekłą lub ostrą chorobę krytyczną.
wyniki analizy gazowej krwi tętniczej mogą zidentyfikować zaburzenia kwasowo–zasadowe i dostarczyć cennych informacji na temat jego przyczyny.
niektórzy sugerują dalsze zmiany
- Thomson WST, Adams JF, Cowan RA. Kliniczna równowaga kwasowo-zasadowa. Oxford: Oxford Medical Publications 1997
- Harrison RA. Równowaga kwasowo-zasadowa. Respir Care Clin N. America 1995; 1,1: 7-21
- Woodrow P. Nursing Standard 2004; 18,21: 45-52
- Sirker AA, Rhodes A, Gounds RM, Bennet ED. Fizjologia kwasowo-zasadowa: podejście „tradycyjne” i „nowoczesne”. Anestezjologia 2002; 57: 348-56