ponieważ większość nowych jonów wodorotlenowych jest usuwana, pH nie zwiększa się zbytnio.
usuwanie jonów wodorotlenowych poprzez reakcję z jonami wodorowymi
pamiętaj, że z jonizacji kwasu etanowego występują pewne jony wodorowe.
![]()
![]()
jony Wodorotlenkowe mogą łączyć się z nimi, tworząc wodę. Jak tylko to się stanie, wskazówki równowagi, aby je zastąpić. Dzieje się tak, dopóki większość jonów wodorotlenowych nie zostanie usunięta.
![]()
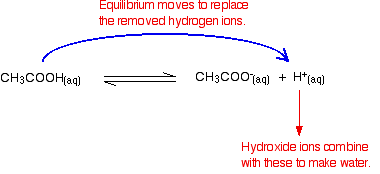
ponownie, z powodu braku równowagi, nie wszystkie jony wodorotlenowe są usuwane – tylko większość z nich. Utworzona woda ulega ponownej jonizacji w bardzo niewielkim stopniu, dając kilka jonów wodorowych i wodorotlenkowych.
alkaliczne roztwory buforowe
jako typowe weźmiemy mieszaninę amoniaku i roztworów chlorku amonu.
amoniak jest słabą zasadą, a pozycja tej równowagi będzie dobrze po lewej stronie:
![]()
![]()
dodanie chlorku amonu do tego dodaje wiele dodatkowych jonów amonowych. Zgodnie z zasadą Le Chateliera, to przechyli pozycję równowagi jeszcze dalej w lewo.
roztwór będzie zatem zawierał te ważne rzeczy:
-
dużo nieaktywnego amoniaku;
-
dużo jonów amonowych z chlorku amonu;
-
wystarczająco dużo jonów wodorotlenkowych, aby roztwór był alkaliczny.
inne rzeczy (takie jak woda i jony chlorkowe), które są obecne, nie są ważne dla argumentu.
dodawanie kwasu do tego roztworu buforowego
istnieją dwa procesy, które mogą usuwać dodawane jony wodorowe.
usuwanie poprzez reakcję z amoniakiem
najbardziej prawdopodobną substancją podstawową, z którą zderzy się jon wodorowy, jest cząsteczka amoniaku. Reagują tworząc jony amonowe.
![]()
![]()
Większość, ale nie wszystkie, jonów wodorowych zostanie usunięta. Jon amonowy jest słabo kwaśny, więc część jonów wodorowych zostanie ponownie uwolniona.
usuwanie jonów wodorowych poprzez reakcję z jonami wodorotlenkowymi
pamiętaj, że w reakcji między amoniakiem a wodą występują pewne jony wodorotlenkowe.
![]()
![]()
jony wodorowe mogą łączyć się z jonami wodorotlenkowymi, tworząc wodę. Jak tylko to się stanie, równowaga kończy się, aby zastąpić jony wodorotlenowe. Dzieje się tak, dopóki większość jonów wodorowych nie zostanie usunięta.
![]()
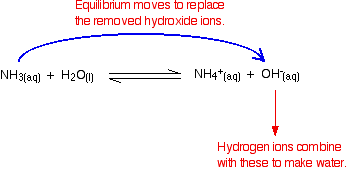
ponownie, ponieważ w grę wchodzi równowaga, nie wszystkie jony wodoru są usuwane – tylko większość z nich.
dodanie alkaliów do tego roztworu buforowego
jony wodorotlenkowe z alkaliów są usuwane w prostej reakcji z jonami amonowymi.
![]()
![]()
ponieważ powstały amoniak jest słabą zasadą, może reagować z wodą – a więc reakcja jest lekko odwracalna. Oznacza to, że ponownie Większość (ale nie wszystkie) jonów wodorotlenowych jest usuwana z roztworu.
obliczenia z wykorzystaniem rozwiązań buforowych
to tylko krótkie wprowadzenie. Jest więcej przykładów, w tym kilka odmian, ponad 10 stron w mojej książce do obliczeń chemicznych.
kwaśne roztwory buforowe
łatwiej to zobaczyć na konkretnym przykładzie. Pamiętaj, że bufor kwasowy może być wykonany ze słabego kwasu i jednej z jego soli.
Załóżmy, że masz roztwór buforowy zawierający 0,10 mol dm-3 kwasu etanowego i 0.20 mol dm-3 etanianu sodu. Jak obliczyć jego pH?
w każdym roztworze zawierającym słaby kwas istnieje równowaga między Nie-zjonizowanym kwasem a jego jonami. Tak więc dla kwasu etanowego mamy równowagę:
![]()
![]()
obecność jonów etanianowych z etanianu sodu przesunie równowagę w lewo, ale równowaga nadal istnieje.
oznacza to, że można zapisać stałą równowagi, Ka, dla niej:
![]()
![]()
Jeśli wcześniej wykonałeś obliczenia przy użyciu tego równania ze słabym kwasem, założysz, że stężenia jonów wodorowych i jonów etanianowych były takie same. Każda cząsteczka kwasu etanowego, która się rozpada, daje jeden z każdego rodzaju jonów.
to już nie dotyczy rozwiązania buforowego:
![]()
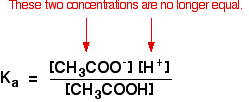
jeśli równowaga została przesunięta jeszcze dalej w lewo, liczba jonów etanolanowych pochodzących z kwasu etanowego będzie całkowicie znikoma w porównaniu do tych pochodzących z etanolanu sodu.
Zakładamy zatem, że stężenie jonów etanolanu jest takie samo jak stężenie etanolanu sodu – w tym przypadku 0,20 mol dm-3.
w obliczeniach słabego kwasu Zwykle Zakładamy, że tak mało kwasu zjonizowało się, że stężenie kwasu w równowadze jest takie samo jak stężenie kwasu, którego użyliśmy. Jest to tym bardziej prawdziwe, że równowaga została przesunięta jeszcze dalej w lewo.
więc założenia, które tworzymy dla roztworu buforowego są następujące:
![]()
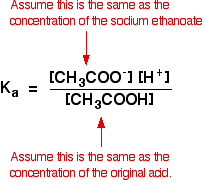
teraz, jeśli znamy wartość Ka, możemy obliczyć stężenie jonów wodorowych, a tym samym pH.
Ka dla kwasu etanowego wynosi 1,74 x 10-5 mol dm-3.
pamiętaj, że chcemy obliczyć pH roztworu buforowego zawierającego 0,10 mol dm-3 kwasu etanowego i 0,20 mol dm-3 etanianu sodu.
![]()
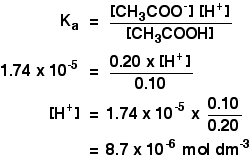
wszystko, co musisz zrobić, to znaleźć pH za pomocą wyrażenia
pH = -log10
nadal będziesz mieć wartość stężenia jonów wodorowych w kalkulatorze, więc naciśnij przycisk log i zignoruj znak ujemny (aby umożliwić znak minus w wyrażeniu pH).
powinieneś otrzymać odpowiedź 5.1 na dwie znaczące liczby. Nie możesz być bardziej dokładny, ponieważ twoje stężenia zostały podane tylko do dwóch liczb.