9.5 naruszenie zasady oktetu
cel nauki
- Rozpoznaj trzy główne rodzaje naruszeń Zasady oktetu.
równie ważne i użyteczne jak zasada oktetu jest w wiązaniu chemicznym, istnieją pewne dobrze znane naruszenia. Nie oznacza to, że zasada oktetu jest bezużyteczna—wręcz przeciwnie. Podobnie jak w przypadku wielu zasad, istnieją wyjątki lub naruszenia.
istnieją trzy naruszenia zasady oktetu. Odd-cząsteczka elektronowa o nieparzystej liczbie elektronów w powłoce walencyjnej atomu. stanowią pierwsze naruszenie zasady oktetu. Chociaż są nieliczne, niektóre stabilne związki mają nieparzystą liczbę elektronów w swoich powłokach walencyjnych. Przy nieparzystej liczbie elektronów, co najmniej jeden atom w cząsteczce będzie musiał naruszyć zasadę oktetu. Przykładami stabilnych cząsteczek nieparzystych elektronów są NO, NO2 i ClO2. Diagram kropki elektronu Lewisa dla NO jest następujący:
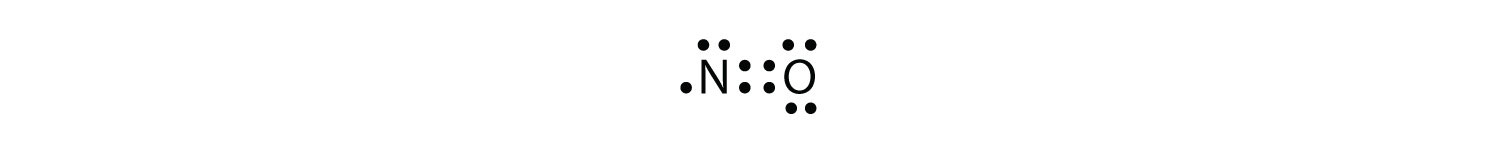
chociaż atom o ma oktet elektronów, atom N ma tylko siedem elektronów w swojej powłoce walencyjnej. Chociaż NO jest związkiem stabilnym, jest bardzo reaktywny chemicznie, podobnie jak większość innych związków nieparzystoelektronowych.
cząsteczka z niedoborem elektronów cząsteczka z mniej niż ośmioma elektronami w powłoce walencyjnej atomu. stanowi drugie naruszenie zasady oktetu. Te stabilne związki mają mniej niż osiem elektronów wokół atomu w cząsteczce. Najczęstszymi przykładami są kowalencyjne związki berylu i boru. Na przykład Beryl może tworzyć dwa wiązania kowalencyjne, w wyniku czego w powłoce walencyjnej znajdują się tylko cztery elektrony:
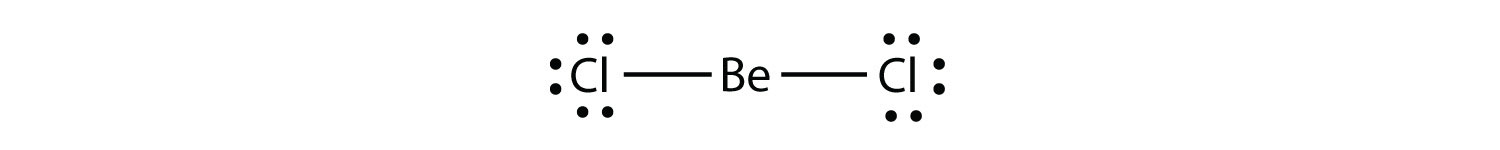
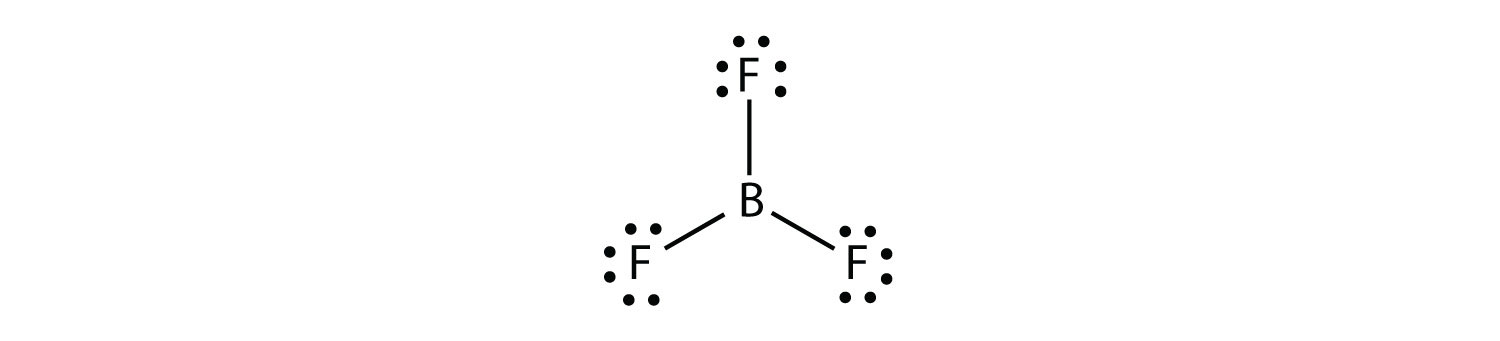
Bor zwykle tworzy tylko trzy wiązania kowalencyjne, w wyniku czego powstaje tylko sześć elektronów walencyjnych wokół atomu B. Dobrze znanym przykładem jest BF3:
trzecie naruszenie zasady oktetu występuje w tych związkach z więcej niż ośmioma elektronami przypisanymi do ich powłoki walencyjnej. Są one nazywane rozszerzoną cząsteczką walencyjną powłoki cząsteczka z więcej niż ośmiu elektronów w powłoce walencyjnej atomu.. Takie związki są tworzone tylko przez centralne Atomy w trzecim rzędzie układu okresowego lub poza nim, które mają puste orbitale d w swoich skorupach walencyjnych, które mogą uczestniczyć w wiązaniu kowalencyjnym. Jednym z takich związków jest PF5. Jedyny rozsądny diagram Kropkowy Lewisa dla tego związku ma atom P tworzący pięć wiązań kowalencyjnych:
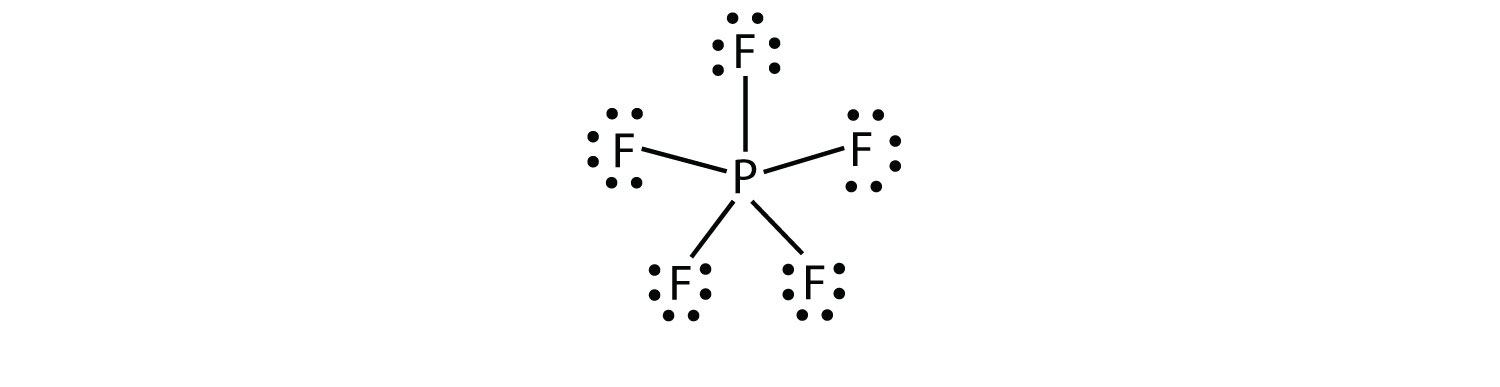
formalnie atom P ma 10 elektronów w swojej powłoce walencyjnej.
przykład 9
Zidentyfikuj każde naruszenie zasady oktetu, rysując diagram kropki elektronu Lewisa.
- ClO
- SF6
roztwór
-
z jednym atomem Cl i jednym atomem O, cząsteczka ta ma 6 + 7 = 13 elektronów walencyjnych, więc jest to cząsteczka nieparzystoelektronowa. Diagram kropki Lewisa dla tej cząsteczki jest następujący:

-
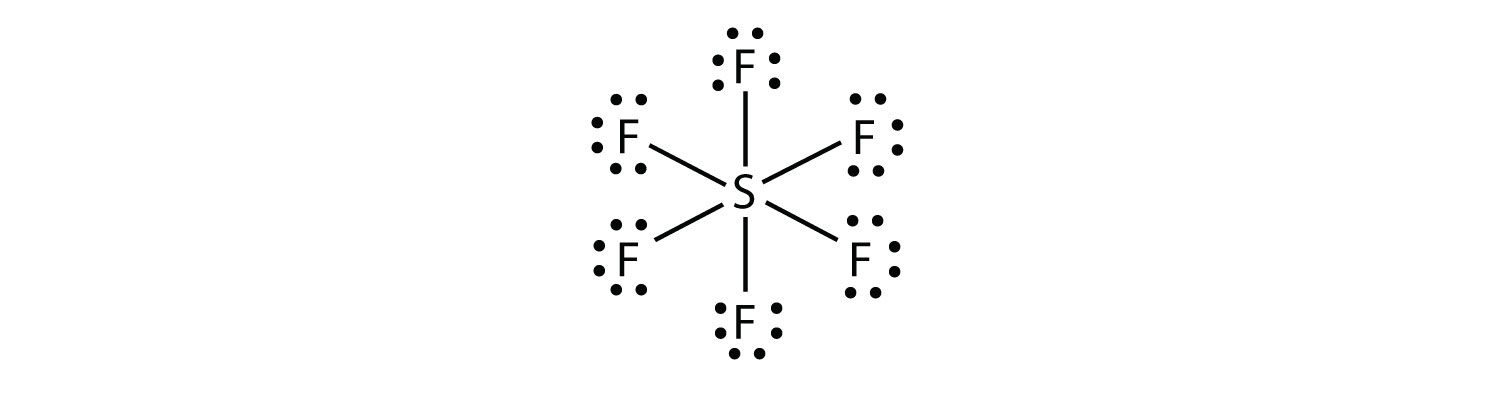
w SF6 centralny atom S tworzy sześć wiązań kowalencyjnych do sześciu otaczających atomów F, więc jest to rozszerzona cząsteczka powłoki walencyjnej. Jego diagram kropki elektronu Lewisa przedstawia się następująco:
Sprawdź się
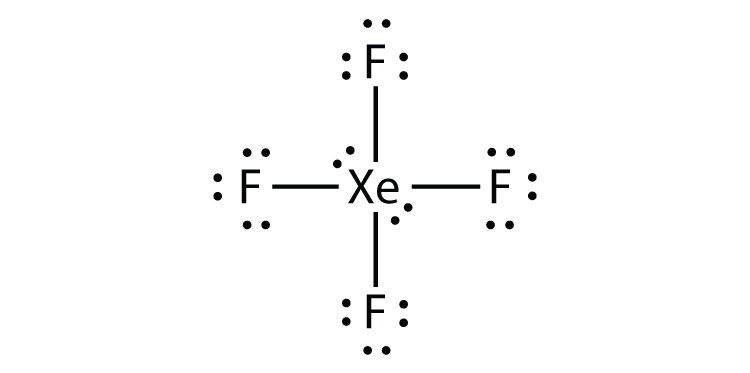
Zidentyfikuj naruszenie zasady oktetu w XeF2, rysując diagram kropki elektronu Lewisa.
odpowiedź
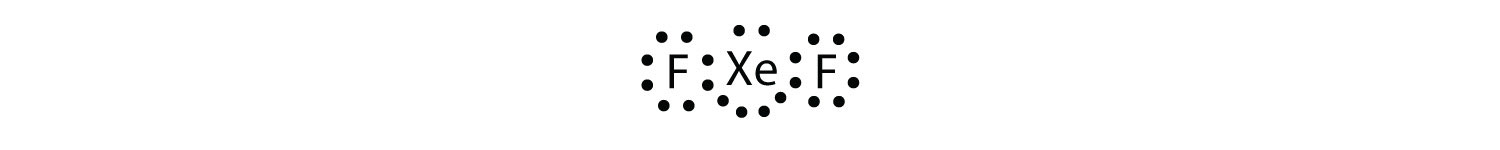
atom Xe ma rozszerzoną powłokę walencyjną z więcej niż ośmioma elektronami wokół siebie.
- istnieją trzy naruszenia zasady oktetu: cząsteczki nieparzyste-elektronowe, cząsteczki z niedoborem elektronów i rozszerzone cząsteczki powłoki walencyjnej.
ćwiczenia
-
Dlaczego cząsteczka nieparzystoelektronowa nie może spełniać zasady oktetu?
-
Dlaczego atom w drugim rzędzie układu okresowego nie może tworzyć rozszerzonych cząsteczek powłoki walencyjnej?
-
narysuj akceptowalny diagram kropek elektronów Lewisa dla tych cząsteczek, które naruszają zasadę oktetu.
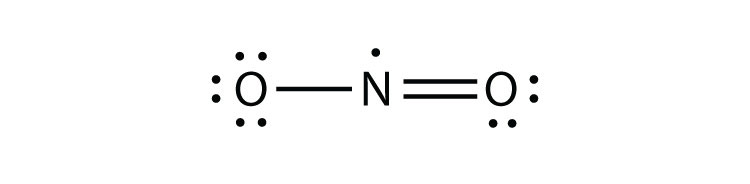
- NO2
- XeF4
-
narysuj akceptowalny diagram kropki elektronu Lewisa dla tych cząsteczek, które naruszają zasadę oktetu.
- BCl3
- ClO2
-
narysuj akceptowalny diagram kropki elektronu Lewisa dla tych cząsteczek, które naruszają zasadę oktetu.
- Pof3
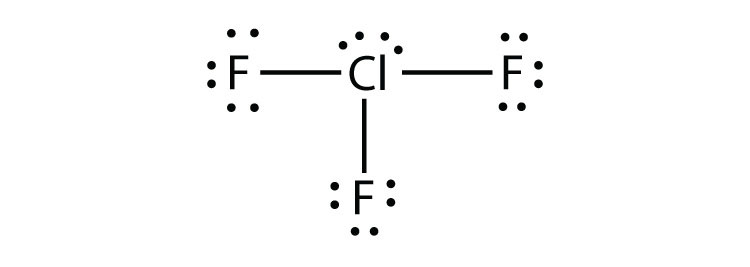
- ClF3
-
narysuj akceptowalny diagram kropki elektronu Lewisa dla tych cząsteczek, które naruszają zasadę oktetu.
- SF4
- BeH2
odpowiedzi
-
nie ma możliwości sparowania wszystkich elektronów, jeśli jest ich Nieparzysta liczba.