ile energii jest uwalniane w hydrolizie ATP?
tryb czytnika
ATP jest często określany jako waluta energetyczna komórki. Setki reakcji w komórce od przemian metabolicznych do zdarzeń sygnalizacyjnych są sprzężone z hydrolizą (dosłownie oznacza „rozluźnienie wody”) ATP przez wodę . Reakcja ATP + H2O <> ADP + Pi przekształca adenozynotrójfosforan (ATP) w adenozynotrójfosforan (ADP) i nieorganiczny fosforan (Pi). Zmiana energii swobodnej związana z tą reakcją napędza dużą część reakcji komórkowych z potencjałem błonowym i mocą redukcyjną będącą pozostałymi dwoma dominującymi źródłami energii. Ale dokładnie ile jest warta ta waluta energetyczna i co ujawnia na temat transakcji chemicznych, które można kupić? Oczywiście nie ma jednej odpowiedzi na to pytanie, ponieważ ilość energii wyzwolonej przez tę reakcję hydrolizy zależy od warunków wewnątrzkomórkowych, ale możliwe jest wyczucie przybliżonej „wartości” tej waluty, uciekając się do prostych szacunków.

Rysunek 1: stosunek energii wolnej Gibbsa hydrolizy ATP w warunkach standardowych do stałej równowagi oraz stosunek energii wolnej hydrolizy w warunkach fizjologicznych do fizjologicznych stężeń reagentów.
zmiana energii swobodnej Gibbsa (ΔG) spowodowana hydrolizą ATP zależy od stężeń różnych uczestników reakcji, jak pokazano na fig.1. Gdy stężenia znajdują się dalej od wartości równowagi, wartość bezwzględna ΔG jest większa. W warunkach „standardowych” (tj. stężenia 1M dla wszystkich reagentów z wyjątkiem wody, która jest pobierana przy charakterystycznym stężeniu 55M) Energia swobodna Gibbsa hydrolizy ATP waha się od -28 do -34 kJ/mol (tj. ≈12 kBT, BNID 101989) w zależności od stężenia kationu Mg2+. Zależność od jonów Mg występuje, ponieważ dodatnio naładowane jony magnezu pomagają stabilizować cząsteczkę ATP. Jednak w komórce warunki nigdy nie są nawet zbliżone do standardowych wartości stanu. Na przykład stężenie 1M ATP oznaczałoby, że masa substancji rozpuszczonej byłaby podobna do masy samego rozpuszczalnika wodnego. Na rysunku 1 pokazujemy często mylące wyprowadzenie fizjologicznej energii wolnej (ΔG), biorąc pod uwagę stosunek stężeń od wartości standardowej (ΔGo). Podział według pojęć takich, jakie są wymagane do dbania o jednostki jako logarytm powinien zawsze zawierać termin bez jednostek. Czasami zaskakujące jest myślenie, że gdyby komórka znajdowała się w równowadze, wartość ΔG byłaby zerowa i nie byłoby energii do uzyskania przez hydrolizę ATP. Na szczęście nigdy tak nie jest w organizmach żywych. .
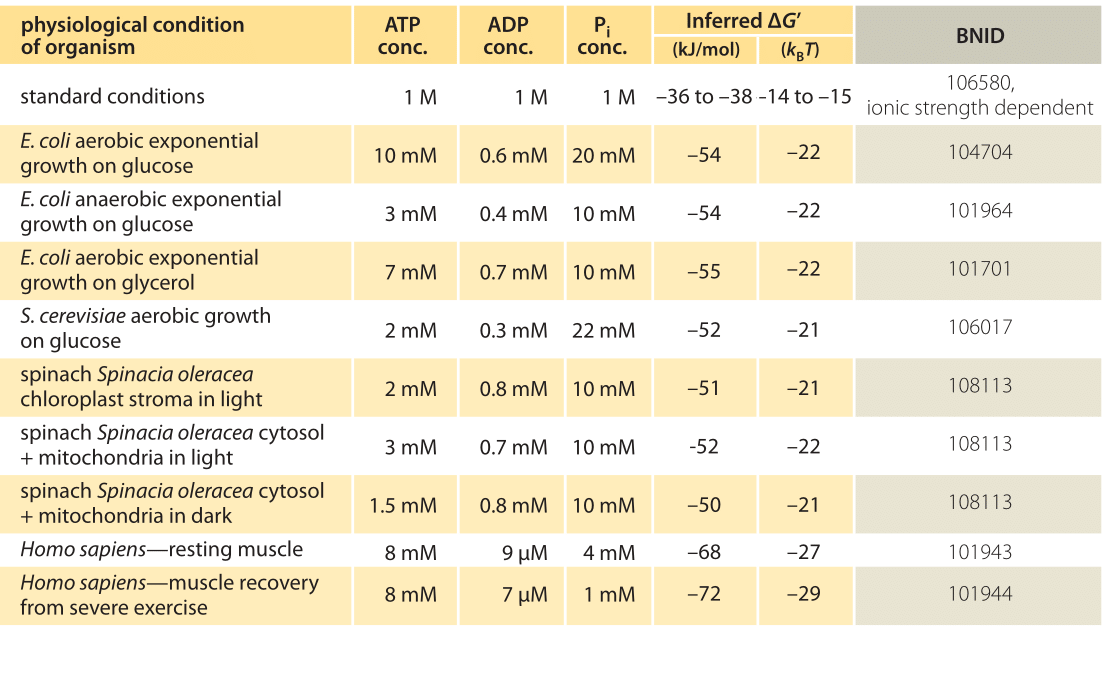
Tabela 1: Energia swobodna do hydrolizy ATP w różnych organizmach i w różnych warunkach fizjologicznych. Obliczanie ΔG „na podstawie wartości ΔG” 0 z -37,6 kJ / mol. To sprawia, że wartości tabeli są spójne między sobą, ale powoduje małe odchylenia od wartości ΔG ’ zgłoszonych w źródłach pierwotnych. Takie odchylenia mogą wynikać z różnic w sile jonowej, pH i metodach pomiaru. Wartości są zaokrąglane do jednej lub dwóch cyfr znaczących. W szpinaku, gdzie nie odnotowano stężenia Pi, zastosowano wartość charakterystyczną 10 mM (BNID 103984, 103983, 111358, 105540).
w praktyce warunki fizjologiczne zależą od badanego organizmu, tkanki lub przedziału w rozważanej komórce oraz od aktualnego zapotrzebowania energetycznego na reakcje metaboliczne i inne. Na przykład, w perfuzowanej wątrobie szczura stosunek ATP do ADP wynosił około 10: 1 w cytozolu, ale 1:10 w mitochondriach przy wysokich wskaźnikach glikolizy, a przy niskich wskaźnikach glikolizy oba wskaźniki były znacznie zbliżone do 1 (BNID 111357). W związku z tym oczekuje się zakresu wartości ΔG. Kluczem do zrozumienia tego zakresu jest zrozumienie, jak bardzo Q różni się od K, tj. jak stężenia różnią się od warunków standardowych. Typowe wewnątrzkomórkowe stężenia wszystkich istotnych składników (ATP, ADP i Pi) mieszczą się w zakresie mM, znacznie niższym niż w warunkach standardowych. Stosunek / ze stężeniami w zakresie mM jest znacznie niższy niż jeden, a reakcja będzie energetycznie korzystniejsza niż w standardowych warunkach, jak pokazano w tabeli 1. Najwyższą wartość ≈-70 kJ / mol (≈30kbt) obliczono na podstawie wartości w mięśniach ludzkich sportowców powracających do zdrowia po wysiłku (BNID 101944). W komórkach E. coli rosnących na glukozie odnotowano wartość -47 kJ/mol (≈20kbt, BNID 101964). Aby umieścić te liczby w perspektywie, silnik molekularny, który wywiera siłę około 5 pN (BNID 101832) na 10 nm (BNID 101857) rozmiar kroku działa rzędu 50 PN nm, wymagając nieco więcej niż 10 kBT energii, dobrze w zakresie tego, co pojedynczy ATP może dostarczyć.
obliczenia ΔG wymagają dokładnego pomiaru odpowiednich stężeń wewnątrzkomórkowych. Takie stężenia są mierzone in vivo u ludzi za pomocą jądrowego rezonansu magnetycznego. Naturalna forma fosforu (31P) ma właściwości magnetyczne, więc nie ma potrzeby dodawania żadnej substancji zewnętrznej. Interesująca tkanka, taka jak mięsień, jest umieszczona w silnym polu magnetycznym, a przesunięcia częstotliwości impulsów radiowych są wykorzystywane do wnioskowania o stężeniu ATP i Pi bezpośrednio ze szczytów w widmie NMR. W E. coli, stężenia ATP można zmierzyć bardziej bezpośrednio za pomocą testu BIOLUMINESCENCYJNEGO ATP. Próbka rosnących bakterii usuniętych z hodowli może być oznaczona za pomocą lucyferazy, białka pochodzącego od bakterii żyjących w symbiozie z kałamarnicami, ale to już dołączyło do zestawu narzędzi biologów jako reporter molekularny. Enzym lucyferazy wykorzystuje ATP w reakcji, która wytwarza światło, które można zmierzyć za pomocą luminometru, a stężenie ATP można wywnioskować z siły sygnału. Mamy więc zawartość komórek jako wejście, lucyferazę jako „urządzenie”, które przekształca ilość ATP w emisję światła, która służy jako zmierzony wynik. Za pomocą takich narzędzi stwierdza się, że w „prawdziwym życiu” ATP jest warte około dwa razy więcej niż w „standardowych” warunkach, ponieważ stężenia są bardziej korzystne dla reakcji do przodu.
kończymy zauważając, że jest to stałe pytanie, dlaczego nukleotyd adeninowy został wyróżniony jako główna waluta energetyczna z GTP i innymi nukleotydami pełniącymi znacznie mniej ważną rolę. Czy jest to przypadek przypadkowego wyboru, który później stał się” zamrożonym wypadkiem”, czy też była selektywna korzyść dla ATP nad GTP, CTP, UTP i TTP?


 ępnij w Google+
ępnij w Google+